浓香型白酒大曲制备过程中细菌群落、环境因子和理化特性研究
王志强,蒋学剑,张 亮,曾化伟,2,张加林*
(1.江苏汤沟两相和酒业有限公司,江苏连云港 222535;2.淮北师范大学,安徽淮北 235000)
大曲作为中国白酒酿造过程中物系、酶系及菌系的重要载体[1],为白酒发酵过程提供了丰富的微生物类群、功能酶及其风味物质,保证了糖化和发酵作用同时进行。大曲品质的好坏对于白酒的生产具有重要影响,大量研究表明曲中微生物的组成与大曲品质之间存在一定的关联性[2]。
行业内学者通过高通量测序进行了大曲菌群多样性的研究[3-4],同时也分析了大曲加工过程因子与微生物的关系[5-7]。然而,由于各家白酒酿造工艺的不同,造就了大曲制作工艺的差异性,同时形成了大曲种类的多样性,因此进一步研究大曲微生物组成与大曲品质之间的关联性对白酒风格形成的机理探究具有重要意义。
“汤沟白酒”作为中国国家地理标志产品,江淮派浓香型白酒代表之一,素有“香而不艳、净而不寡、绵而不淡、甜而不腻”的独特风格。为进一步探究汤沟白酒典型风格的形成机理,本研究从分析2批次大曲微生物与环境、理化因子的动态变化入手,进一步使用冗余分析(RDA)深度解析大曲微生物与与环境、理化因子的关系,以期为大曲品质提升提供理论依据。
1 材料与方法
1.1 材料、试剂及仪器
样品收集:“汤沟”大曲于7 月份(H,中高温曲)或8 月份(M,中温曲)开始生产,样品从江苏汤沟两相和酒业有限公司的实验车间采集。大曲样品在四个发酵阶段采集:主发酵阶段的第4 天(H1 和M1),潮火期阶段发酵的第12 天(H2 和M2),大火阶段的第12 天(H3 和M3),以及后火阶段的第32天(H4 和M4)。在存贮期还采集了3 次样品:第1个月(H5 和M5)、第2 个月(H6 和M6)和第3 个月(H7 和M7)。每个样品随机抽取五块大曲块,粉碎并混合在一起进行测定。
试剂:无菌PBS缓冲液,苯酚,氯仿。
仪器设备:安捷伦2100 生物分析仪,美国安捷伦;Quabit 2.0 荧光计,美国加利福尼亚州圣地亚哥Illumina;pH 计,中国上海伊内萨;涡流振荡器,真空冷冻干燥仪,冰箱等。
1.2 实验方法
1.2.1 DNA提取
将大曲样品(5 g)置于带有无菌PBS 缓冲液(1 mL)的20 mL试管中,并添加玻璃珠。使用涡流振荡器将混合物搅拌3 min,以300 r/min 离心匀浆5 min,收集上清液并以10000 r/min 离心5 min以收集细胞沉淀物。根据Wang等[4]的方法,使用苯酚和氯仿提取细胞沉淀物的DNA,真空冷冻干燥后溶解在无菌水中(50µL)。DNA 样本储存在-70 ℃以备使用。
1.2.2 文库制备和Illumina MiSeq测序
使用GENEWIZ Inc.设计的一组引物从DNA(50~100 ng)中产生扩增子。采用包含“CCTACGGRRBGCASCAGKVRVGAAT”序列的上游引物和包含“GGACTACNVGGGTWTCTAATCC”序列的下游引物扩增V3 和V4 区。通过PCR 向16S rDNA 的PCR 产物末端加上带有Index 的接头,以便进行NGS 测序。DNA 文库使用安捷伦2100 生物分析仪进行验证,并使用Quabit 2.0 荧光计进行定量。根据制造商的说明将DNA 文库进行复合并加载到Illumina MiSeq 仪器上。使用2×300 配对末端(PE)配置进行测序。图像分析和基址调用由MiSeq仪器中嵌入的MiSeq控制软件(MCS)进行。
1.2.3 环境和生化特性的测定
用温度计测定了大曲各取样曲块的中心温度(YT)和各取样曲块周围的环境温度(ET),使用湿度计测量每个采样点周围的环境湿度(EH)。根据105 ℃下的干/湿重量测量方法测定每个样品的含水量(WT)。使用pH 计测量蒸馏水(10 mL)中每个大曲样品(1 g)的pH 值。大曲糖化力(SP)和发酵力(FP)的测定参考中华人民共和国轻工业标准,SP单位定义为1 g大曲淀粉在35 ℃和pH 4.6下水解1 h 产生的葡萄糖量,表示为mg/g·h;FP 单位定义为糖化溶液在30 ℃下发酵0.5 g大曲72 h而损失的重量,表示为g/100 g·72 h。
1.2.4 数据分析
实验做了3 次重复,计算平均值和标准偏差,并使用Student t 检验评估显著差异。P 值为双尾,P<0.05 具有统计学意义。使用SPSS13.0 for Windows(SPSS Inc)对数据进行分析。
根据OTU 分析结果,对不同分类级别的样本进行分类分析,以获得目和属级别的群落结构图。贝塔多样性分析用于比较不同样本之间物种多样性(群落组成和结构)的差异。根据距离矩阵,采用算术平均无权对分组法(UPGMA)建树,得到多个距离上样本(含分组信息)的主成分分析(PCA)图。使用Canoco 4.5进行RDA分析,以评估属级微生物群与环境和生化特征之间的相关性。
2 结果与分析
2.1 环境和生化变量的时间变化
每天测定环境变量,结果如图1 所示。总的来说,两个批次的环境湿度先降低后升高,除第15天、第23~28 天和第35 天的发酵阶段外,8 月曲的湿度相对高于7 月曲。两个批次的湿度和样品温度先升高后降低,除第1 天外,7 月曲的相对湿度相对高于8 月曲,发酵第4 天至第30 天7 月曲的样品温度相对高于8 月曲,发酵第23 天和第24 天时,7月曲的最高温度为52 ℃,发酵第35 天时,8 月曲的最高温度为46 ℃。显然,相对较高的样品温度与相对较高的相对湿度有关。

图1 两批大曲的的环境和理化指标的变化
从发酵第4 天到发酵第32 天,两批大曲的水分含量急剧下降,在贮藏期的1 个月、2 个月和3 个月,水分含量略有下降。发酵0 d 时pH 值为6.37 和6.48,发酵过程中pH 值先降低后升高,最终pH 值稳定在6.82~6.86 之间。贮藏期pH 值有波动,8 月曲和7 月曲的pH 值分别在6.4~6.86 和5.70~6.82之间。两批大曲的糖化力值先上升后下降,稳定在190~240 mg/g·h(7 月曲)和440~530 mg/g·h(8 月曲)。发酵力在发酵过程中先上升后下降,在0.24~0.37 g/100 g·72 h(8月曲)和0.26~0.32 g/100 g·72 h(7月曲)的低水平下稳定。除发酵第4天外,7月曲的糖化力显著低于8 月曲,发酵力除第12 天外差异不显著。结果表明,糖化力与发酵力无明显相关性。
2.2 大曲样品细菌菌群多样性和稀释曲线
从表1 以及图2 发现,中温大曲样本的覆盖率指数Coverage 平均值为99.67%,高温大曲样本的覆盖率指数Coverage 平均值为99.95%,后者Coverage 平均水平偏高。虽然未达到饱和状态,但随着测序深度增加,新物种检测出的数量减少,曲线基本趋于平稳。说明样本的测序深度满足要求,大曲中主要的微生物种类都能够检测到。

图2 两批大曲的细菌群落的稀疏曲线
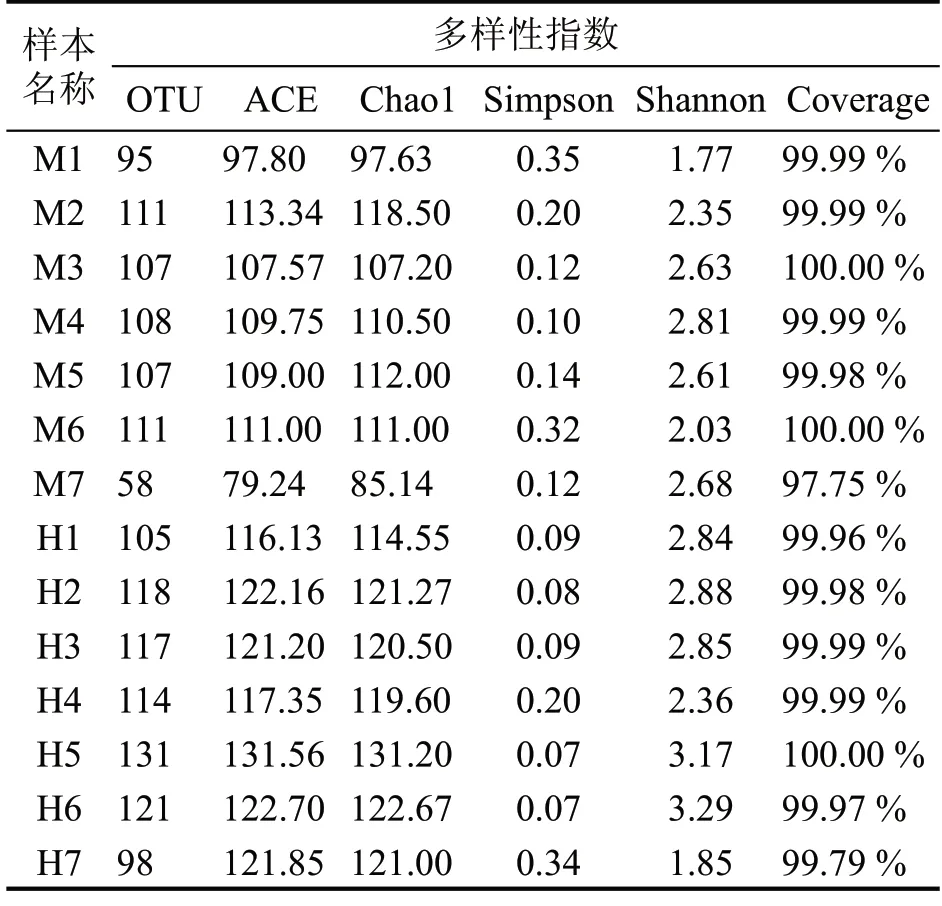
表1 两批次据大曲细菌群落测序数以及α-多样性分析
结合表1 以及图2 可知,发酵过程中细菌群落物种丰富度与多样性随着发酵时间的变化而改变。中温大曲发酵过程初期,样本中细菌群落的丰富度和多样性明显较其他样本低,说明新鲜曲坯中细菌种类较少;随着大曲发酵的进行,细菌群落的丰富度和多样性逐渐增加,且多样性在发酵后期(32 d)达到最大值,这说明环境中的微生物在大曲中富集,且大曲中存在的细菌开始适应环境,充分利用原料中的营养物质快速生长繁殖,随后在贮藏初期,细菌的多样性开始降低,在贮藏2 个月达到最小值。分析上述现象原因:(1)微生物在大曲制作前期迅速生长繁殖,并产生大量次级代谢产物,尤其是酸类物质,这些酸类物质会抑制酸性敏感细菌的生长;(2)大曲发酵前期微生物的生长代谢活动会产生大量的生物热;中温大曲发酵品温控制在50~60 ℃之间,因此,大曲中不耐热微生物的生长受到抑制或是逐渐消亡;(3)在贮藏时期,细菌群落的丰富度和多样性开始下降,这很可能是由于温度开始回落,大曲中原本适应高温环境的细菌受到抑制。
2.3 中、高温大曲发酵过程中细菌群落在属水平的结构组成以及动态变化
中温大曲发酵过程中细菌群落分析,从图3(a)中可以发现,细菌群落主要由7 个属构成(相对丰度>0.5 %):乳杆菌属(Lactobacillus)、魏氏菌属(Weissella)、克罗诺杆菌属(Cronobacter)、泛菌属(Pantoea)、克雷伯氏菌属(Klebsiella)、芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus),其相对丰度之和平均为89.4 %。乳杆菌属(Lactobacillus)、魏氏菌属(Weissella)作为主要的菌属在整个发酵及贮存过程中处于优势地位,其中乳杆菌属(Lactobacillus)较为特殊,作为发酵初期丰度最高的菌属,随着发酵的进行其相对丰度显著降低,22 d 后其相对丰度保持在21.7 %以下。这说明大曲的发酵环境对外源微生物是有选择压力的,由于大曲的制作过程是采用生料发酵,在发酵初期,很多原料中优势菌并不能直接利用生料,因此其生长会受到抑制,初步推断其可能为不耐热菌,随着发酵进行,微生物的生长代谢会产生大量的热,大曲的品温快速升高,通过采用通风等物理方法,使大曲品温(50~60 ℃)维持一段时间,不耐热的细菌会逐渐被其他耐热细菌替代。在贮藏时期温度恢复正常后,该菌又逐步恢复较高值、丰度值有很好的体现。克罗诺杆菌属(Cronobacter)在发酵过程中迅速成为主要的优势菌群,尤其是发酵中后期,保持在较高的水平24.6%,在贮存期保持在较低的水平(相对丰度<3.0 %)。泛菌属(Pantoea)在发酵和贮藏过程中,随着发酵的进行其相对丰度显著增加,发酵后期达10.5%,当开始贮藏放置时,相对丰度明显降低,直至贮藏后期丰度又出现大幅度增加现象,相对丰度保持在8.9%以上。克雷伯氏菌属(Klebsiella)与泛菌属(Pantoea)有着相似的丰度变化趋势。除以上5 种丰度较高的细菌外,芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)在发酵过程中,丰度呈相似稳定的变化趋势,在贮藏中后期迅速降低,并保持在较低的水平(相对丰度<1.7%)。
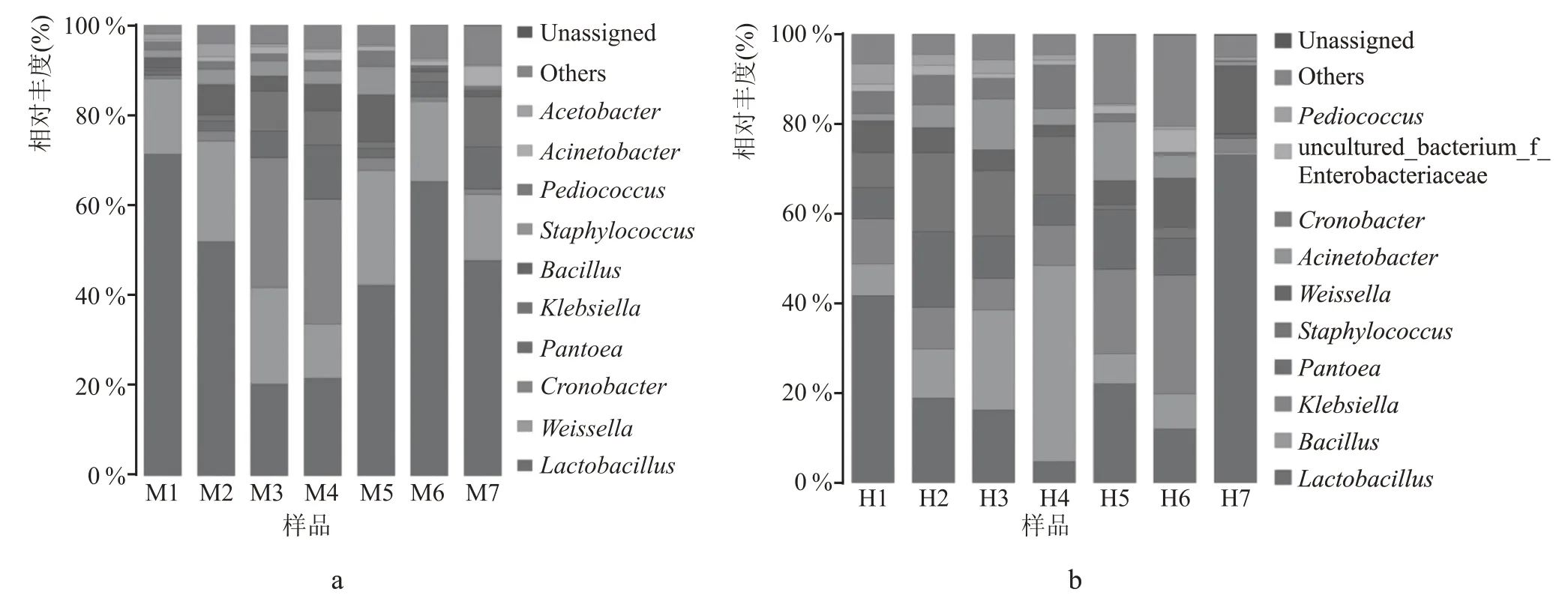
图3 两批大曲的发酵过程中细菌群落在属水平的组成
高温大曲发酵过程中细菌群落分析,从图3(b)中可以发现,细菌群落分类较为丰富,主要由10 个属构成(相对丰度>0.5 %),丰度较高的前8种:乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、克雷伯氏菌属(Klebsiella)、泛菌属(Pantoea)、葡萄球菌属(Staphylococcus)、魏氏菌属(Weissella)、不动杆菌属(Acinetobacter)、克罗诺杆菌属(Cronobacter),其相对丰度之和平均为83.1%。乳杆菌属(Lactobacillus)在发酵的前期和贮存后期具有较高丰度水平,尤其是贮藏后期保持在极高的水平,相对丰度达74.3 %。芽孢杆菌属(Bacillus)在发酵过程中迅速成为主要的优势菌群,尤其是发酵中后期,保持在较高的水平40.0 %,在贮存期保持在较低的水平(相对丰度<1.2%)。克雷伯氏菌属(Klebsiella)和泛菌属(Pantoea)作为主要的菌属在整个发酵及贮存过程中处于优势地位。葡萄球菌属(Staphylococcus)在发酵过程初期迅速成为优势菌群,尤其是发酵中后期,保持在较高的水平,最高丰度值达19.3 %,在贮存期保持在较低的水平(相对丰度<3.2 %)。魏氏菌属(Weissella)占比不大,菌群发展趋势类似于乳杆菌属(Lactobacillus)的变化趋势。不动杆菌属(Acinetobacter)、克罗诺杆菌属(Cronobacter)的菌群发展趋势类似于芽孢杆菌属(Bacillus)的变化趋势。
2.4 两批次大曲的菌群差异性分析
通过LEfSe 分析发现(图4),Pseudomonas_sp_Mexd38、Morganella、Morganella及Latobacillales、Lactobacillaceae、Lactobacillus_pontis、Leuconostocaceae、Weissella、uncultured bacteriumWeissella在两批次样品中有显著差异。

图4 两批大曲的大曲发酵过程中细菌LEfSe分析
2.5 细菌群落与环境生化指标的相关性研究
RDA 分析是一种约束排序,用于分析优势细菌的相对丰度(属级)与环境和生化变量之间的关系(图5)。虚线从中心点到细菌点的箭头锐角表示细菌群落与相应的环境或生化变量有正相关性,钝角表示负相关性。在发酵阶段,两批大曲中样品温度、室温与Acinetobacter、Staphylococcus、Cronobacter、Pantoea呈现正相关关系,Lactobaclius与样品温度、室温呈负相关关系。整个培养过程中,两批大曲的发酵力与Klebsiella菌有负相关关系。
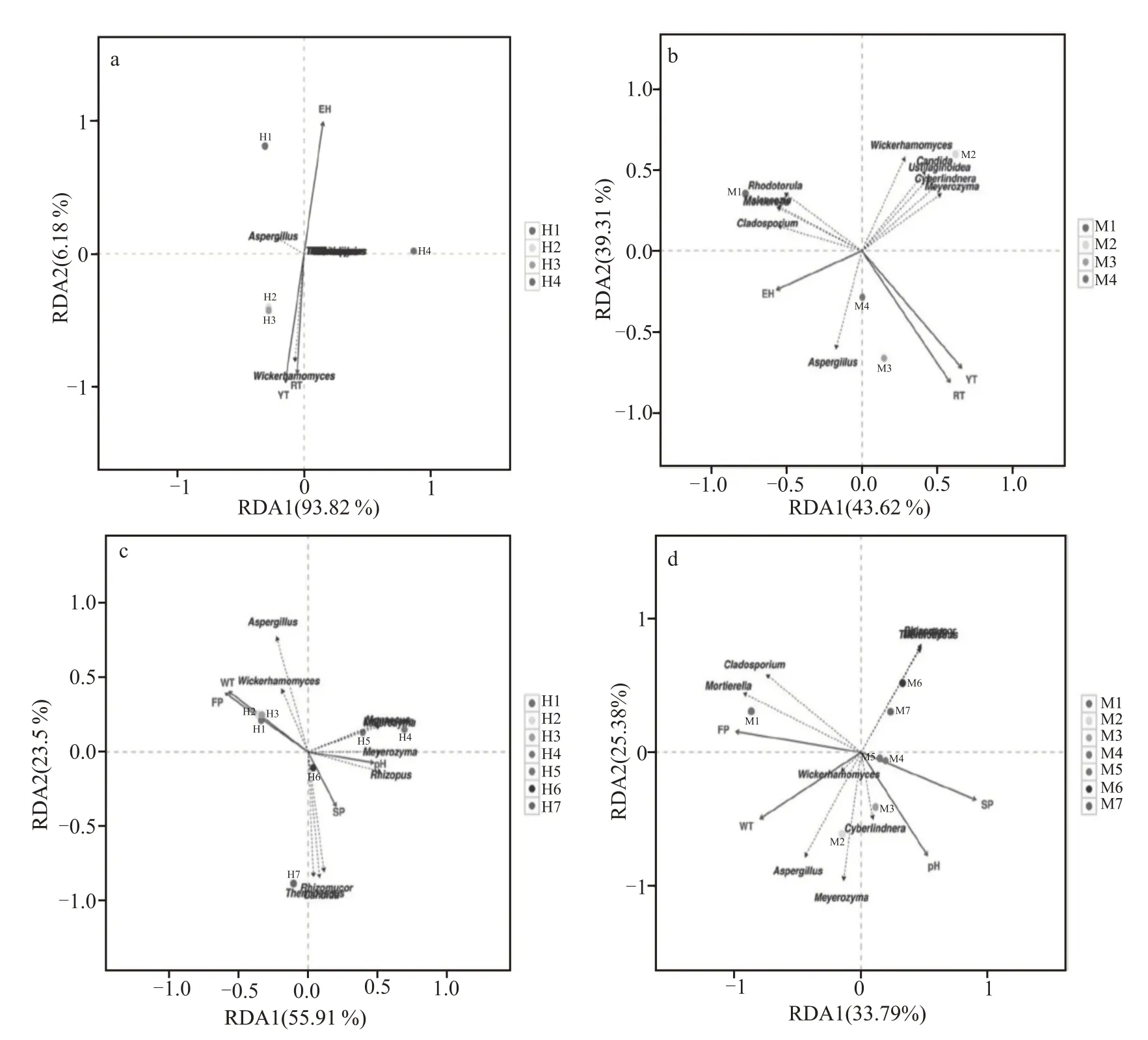
图5 细菌群落与环境和生化变量之间的相关性
3 结论
本研究揭示了两批次大曲制备过程中环境、理化指标及细菌群落的动态变化。中温大曲主要的菌 群Lactobacillus、Weissella、Cronobacter丰度较高,高温大曲主要的菌群Lactobacillus、Bacillus、Klebsiella、Pantoea、Staphylococcus丰度较高。总体上,Lactobacillus(乳杆菌属)是发酵前阶段最丰富的原核菌属,发酵后期其丰度有下降,经过三个月贮藏后Lactobacillus(乳杆菌属)丰度上升。在两批大曲制备过程中,温度是控制细菌群落的重要因素,发酵力与Klebsiella呈显著负相关关系。通过LEfSe 分析两批大曲的细菌群落结构发现了显著性差异标志性的细菌种。本研究加深了对大曲制备的理论认识(包括贮藏可能功能的鉴定、两批大曲细菌差异、菌群变化和因子关联性等),为提高大曲质量提供了潜在的控制方法。

