凤香型白酒新老制酒车间不同季节空气中的真菌群落结构差异研究
徐 晨,白莉圆,赵 帅,孟勤燕,荆 雄,张永利,2*
(1.陕西西凤酒股份有限公司,陕西宝鸡 721000;2.西北大学生命科学学院,陕西西安 710069)
西凤酒是凤香型白酒的鼻祖,具有“醇香典雅、甘润挺爽、诸味谐调、尾净悠长”的香味特点和“多类型香气、多层次风味”的典型风格,这与其秉持千年的独特酿造工艺、独特的酒海贮存和优良的酿酒环境密不可分。凤香型白酒的生产是开放式的多菌种发酵过程,在酿造过程中,长期的生产活动使得酿造环境形成了特定的微生态环境,长期的驯化形成了特有的酿造凤香型白酒所必须的微生物菌群。悬浮在空气中的微生物会通过自然接种附着在酒醅上参与发酵,在酿造过程中增殖和代谢,生成不同的香味物质,直接影响凤香型酒体风味的形成。因此,系统地研究环境中真菌菌群结构组成及其优势菌属有助于揭示环境微生物在酿造过程中的重要作用,对深入认识凤香型白酒的酿造机制具有重要意义。
近年来,有关酿造环境微生态的研究日渐增多。王兴初等[1]研究发现在茅台酒厂的生产环境中,空气中的细菌进行了选择性的富集,形成了菌体密度大、结构复杂的细菌区系;黎瑶依等[2]系统研究了茅台镇酱香型白酒不同酿造轮次生产环境中的真菌菌群结构及特征;符长彪等[3]对不同酿造方式下酿造车间不同环境区域的微生物群落结构及分布特征进行了研究,发现操作方式对于环境因子的改变以及微生物的相互作用等原因,导致了真菌类群在种类和相对丰度上具有一定差异。目前,凤香型白酒酿造微生物的研究主要集中在大曲和酒醅微生物方面,对酿造环境中的微生物研究较少。因此,本实验结合高通量测序法和数理统计方法对凤香型白酒新老制酒车间空气真菌群落结构组成及差异性进行了系统研究,旨在揭示酿造环境微生物对凤香型白酒制酒品质的影响,为进一步解析凤香型白酒酿造环境微生物的真菌菌群结构及酿造机理提供理论基础。
1 材料与方法
1.1 材料、试剂及仪器
空气样本:采样见1.2。
试剂及耗材:氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾,天津市天力化学试剂有限公司;0.22 μm滤膜,海宁市德滤新材料科技有限公司;Q5®High-Fidelity DNA 聚合酶(M0491L),美国NEB 公司;Quant-iT PicoGreen dsDNA Assay Kit(P7589),美国Invitrogen 公司;Agarose(75510-019),美国Invitrogen 公司;Marker(DL15000 或DL2000),日本Takara 公司;TAE(AM9870),美国Invitrogen公司。
仪器设备:液体撞击式微生物气溶胶采样器,辽阳市康洁仪器研究所;GM-0.33A 真空抽滤装置,天津津腾实验设备有限公司;DYY-6C 型电泳仪,北京六一仪器厂;BG-gdsAUTO(130)型凝胶成像系统,北京百晶生物技术有限公司;Nanodrop®NC2000 紫外定量设备,美国Thermo Scientific 公司;2720 型PCR 扩增仪,美国ABI 公司;FLX800T型酶标仪,美国BioTek 公司;MiSeq 测序仪,美国Illumina 公司。
1.2 实验方法
1.2.1 样品及采集方法
空气样本,采集自凤香型白酒企业新老两个酿造车间(下文中O 代表老车间,N 代表新车间)环境区域的空气。用液体撞击式微生物气溶胶采样器(采样液为PBS缓冲液)采样,选取酿酒车间室内距墙2 m 以外,高度距地面1.5 m 左右无人员流动的范围为采样点,每个样品由5 个采样点组成,采样完毕,用滤膜和抽滤装置对含有空气微生物的吸附液进行过滤,冷冻保存样品并尽快送样检测。
1.2.2 基因组提取
提取步骤参见OMEGA Soil DNA Kit (M5635-02)的操作说明。
1.2.3 PCR扩增
扩增引物:应用ITS1F(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')对真菌ITS 基因V1 区进行PCR扩增。
扩增体系(25 μL):5 μL 5×reaction 缓冲液,5 μL 5×GC 缓冲液,2 μL dNTPs(2.5 mM),1 μL 上游引物(10 μM),1 μL 下游引物(10 μM),2 μL 模板DNA,ddH2O 8.75 μL,0.25 μL Q5 DNA 聚合酶。
扩增参数:98 ℃预变性2 min,25~30 个循环(98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s),72 ℃稳定延伸5 min,最后在10 ℃下直到反应停止。
1.2.4 llumina Miseq测序
利用Illlumina NovaSeq 平台进行测序分析,上海派森诺生物技术有限公司。
1.2.5 序列分析
采用DADA2 和QIIME2 2019.4 (https://docs.qiime2.org/2019.4/tutorials/)分析序列[4]。使用软件对原始序列进行预处理,按最小样本序列数的97%抽平后,选取高质量序列进行分析。利用UNITE Release 8.0 真菌数据库对扩增子序列变异体(amplicon sequence varian,ASV)进行分类注释[5]。序列数据分析主要使用QIIME2和R包(v3.2.0)执行。使用QIIME2 中的ASV 表计算ASV 水平的alpha 多样性指数,计算Beta 多样性Jaccard 指数、Bray-Curtis和UniFrac 距离矩阵,并对样品间微生物群落结构变化进行非度量多维尺度(NMDS)和层次聚类分析。
2 结果与分析
2.1 新老车间不同月份空气真菌Alpha 多样性分析
本研究通过高通量测序技术分析新老制酒车间空气微生物多样性,真菌ITS 基因V1 区测序共获得3034106 条序列,其中高质量序列有2663167条,每条序列的平均长度是225.26,平均每个样品110965 条序列,其中最少59667 条,最多237060 条序列。经抽平后得到2032 个真菌种群ASV,两个车间真菌ASV 数量最少的均为4 月,新车间真菌ASV 最多的是5 月,老车间真菌ASV 最多的是12月(表1)。稀释曲线是表征样品测序结果是否能够反映样品实际生物信息的分析方式[6-7]。稀释曲线分析显示所有样品真菌ITS 基因测序都达到或接近平台期(图1),说明本次测序可覆盖样本中绝大多数真菌种群信息。
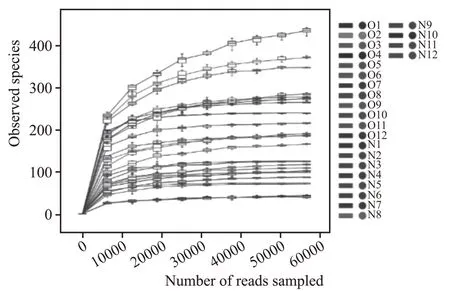
图1 真菌种群ITS基因测序稀释曲线(97%相似度水平)
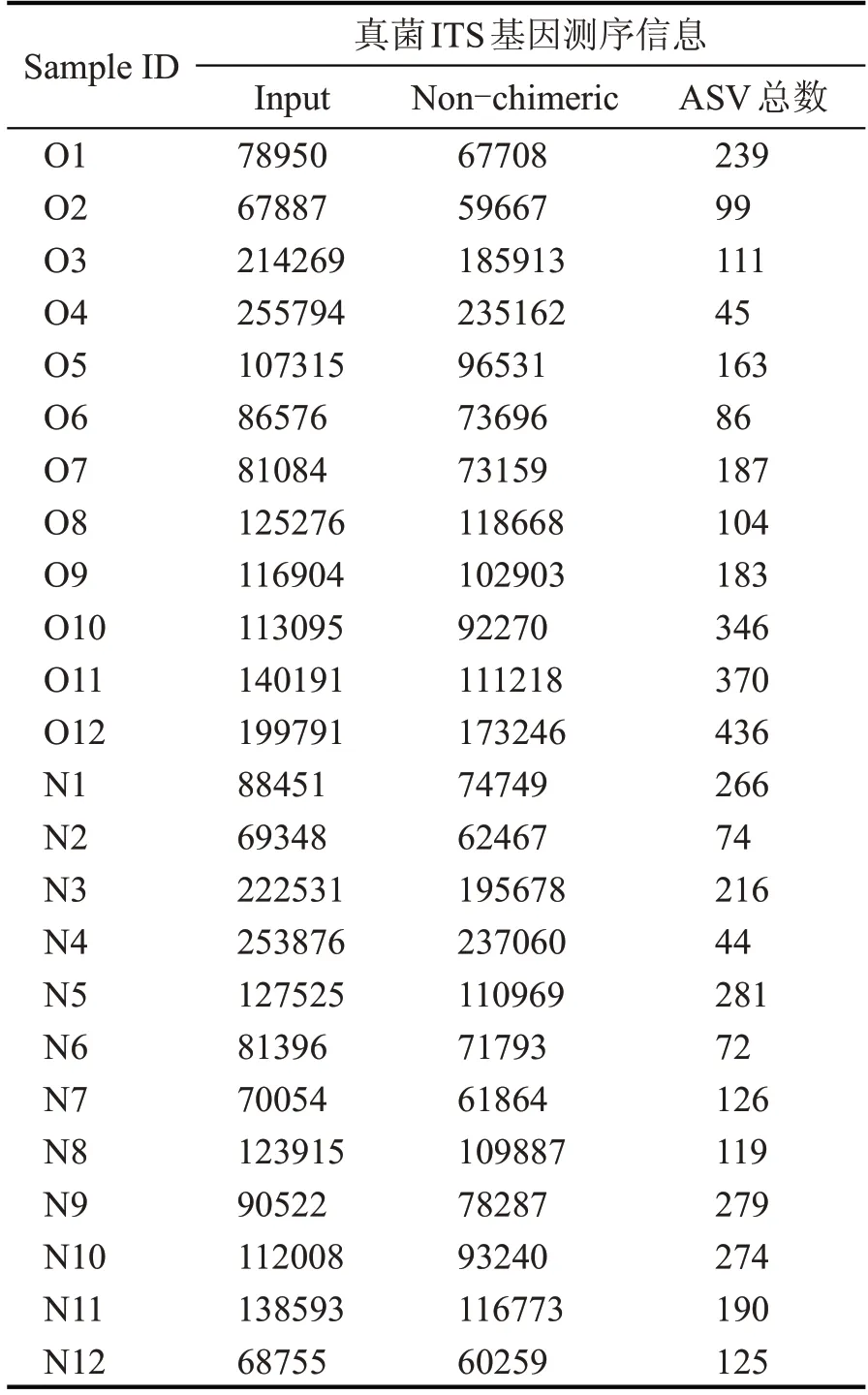
表1 高通量测序信息汇总
本研究通过丰富度指数(Chao1 和Observed species)、覆盖度指数(Good’s coverage)和多样性指数(Shannon 和Simpson)评价空气样品的真菌种群多样性(图2)。由图2a 和2b 可以看出,1—9 月两个车间空气微生物的真菌丰富度变化趋势基本一致,9 月—12 月变化趋势不同且差异显著,老车间空气样品的真菌丰富度是12 月最高,新车间是5月最高,两个车间均为4 月最低。由图2c 可以看出所有样品的测序深度均大于0.99,表明测序深度基本覆盖样品中所有的物种。由Shannon 指数和Simpson指数图可以看出,两个车间变化趋势一致,但新车间的真菌多样性波动幅度较大,表明老车间环境较为稳定,新车间更易受季节影响。
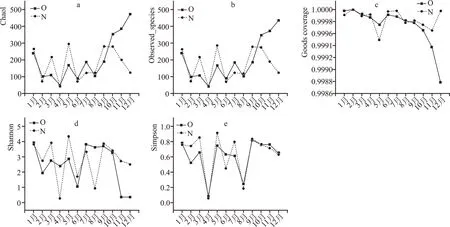
图2 真菌Alpha多样性指数
2.2 新老车间不同月份空气真菌种群结构差异
所有空气样品中的真菌种群可归属于10 个门,老车间和新车间的样品中均检测到7 个真菌门。由图3 可知,相对丰度较高且在所有样品中均有分布的是子囊菌门(Ascomycota)和担子菌门(Basidiomycota),每个样品中这两类菌的丰度和为91.48%~99.97%;样品中占主导地位的真菌种群均为子囊菌门,相对丰度高达79.99 %~99.94%,其余菌门的占比都很小。相关研究表明,子囊菌门是凤香型酒醅中的优势真菌种群[8-9],同时也是凤香型白酒制酒车间可培养空气真菌的主要种群[10]。

图3 新车间(A)和老车间(B)的空气样品在门水平的真菌种群结构
新车间的空气样品中检测到263 个真菌属,通过筛选新车间空气样品的优势种群(平均相对丰度大于1 %的属)得到属水平下真菌种群结构见图4A。由图4A 可知,新车间空气样品相对丰度大于1%的真菌属有10 个,分别是热子囊菌属(Thermoascus)、Phialemoniopsis、链格孢属(Alternaria)、毕赤酵母属(Pichia)、曲霉属(Aspergillus)、Neosetophoma、球腔菌属(Mycosphaerella)、Cutaneotrichosporon、赤壳科未培养真菌属(unclassified_Nectriaceae)、绿核菌属(Ustilaginoidea)。结合各样品相对丰度单独排序结果发现,9 月、11 月和12 月的优势真菌属均为热子囊菌属、曲霉属和毕赤酵母属。9月空气样品中这3 种菌的丰度为36.23%、13.38%、34.6 %;11 月为44.99 %、8.61 %、11.42 %;12 月为61.96%、13.8%、17.84%。以热子囊菌属为第一优势菌属的还有1 月和2 月,丰度分别为48.84 %和48.38%,其中,1 月样品的第二、第三优势菌属为曲霉菌属(8.34 %)和绿核菌属(7.33 %),2 月样品的第二、第三优势菌属为毕赤酵母属(33.73 %)和曲霉属(6.9%)。主要真菌属包括热子囊菌属但不是第一优势菌属的样品有3 月和5 月,3 月样品的主要真菌属有Phialemoniopsis(27.09%)、热子囊菌属(12.3%)和毕赤酵母属(10.43%),5 月样品的优势菌属为球腔菌属(20.37 %)、Cutaneotrichosporon(16.12 %)、热子囊菌属(15.86 %)、曲霉菌属(15.35 %)和毕赤酵母属(12.74 %)。10 月样品的主要真菌属为曲霉菌属(26.61 %)和毕赤酵母属(14.45 %)。值得注意的是,虽然样品的优势菌属都包括嗜热子囊菌属、曲霉菌属、毕赤酵母属,但丰度差异显著,且个别样品中存在丰度高于这3 种菌的特有菌属,例如5 月样品的第一优势细菌属为球腔菌属;4 月和6 月样品的优势细菌属均为Phialemoniopsis,其相对丰度分别为97.32 %、74.03 %;7月样品的主要菌属为链格孢属(41.76%)和Neosetophoma(42.67 %);8 月样品的优势真菌属为链格孢属(90.9%)。3 月、10 月和11 月的样品中均有占比很高的未知真菌属。

图4 新车间(A)和老车间(B)的空气样品在属水平的真菌种群结构
老车间的空气样品中检测到277 个真菌属,通过筛选各样品的优势种群(平均相对丰度大于1 %)得到属水平下真菌种群结构见图4B。由图4B 可知,老车间空气样品相对丰度大于1%的真菌属分别为热子囊菌属、链格孢属、Phialemoniopsis、毕赤酵母属、曲霉属、篮状菌属(Talaromyces)、Neosetophoma、球腔菌属。结合各样品相对丰度单独排序结果发现,1 月、5 月、11 月和12 月样品的优势真菌属均为热子囊菌属、曲霉属和毕赤酵母属。1月样品中这3 种菌属的相对丰度分别为46.17 %、8.64 %、8.07 %;5 月样品中为25.05 %、15.79 %、12.82%;11 月样品中为48.07%、12.98%、11.62%;12 月样品中为63.04%、10.6%、7.02%。以热子囊菌属为第一优势菌属的还有3 月,其丰度为26.52%,该月样品第二、第三优势菌属为毕赤酵母属(7.1 %)和Phialemoniopsis(3.95 %)。主要真菌属包括热子囊菌属但不是第一优势菌属的样品有2月和10 月,2 月样品中第一、第二优势真菌属分别为篮状菌属(67.84%)和热子囊菌属(15.93%);10月样品的主要真菌属有链格孢属(23.26 %)、毕赤酵母属(9.32%)和热子囊菌属(6.04%)。同样,虽然样品的优势菌属都包括嗜热子囊菌属、曲霉菌属、毕赤酵母属这3 种菌,但丰度差异显著,且个别样品中存在丰度高于这3 种菌的特有菌属,例如2月样品的第一优势菌属是篮状菌属;4 月和6 月的优势菌属均为Phialemoniopsis,其相对丰度分别为96.46%、60.12%;7 月样品的主要菌属为链格孢属(62.83 %)和Neosetophoma(18.77 %);8 月样品的优势真菌属为链格孢属(86.99%);9 月样品中毕赤酵母属占据绝对优势,其相对丰度为65.04 %。3月、5月和10月中均有占比很高的未知真菌属。
综上可以看出每个月的真菌属组成及丰度均存在显著差异,表明空气微生物组成受季节影响较大,差异显著的原因也可能是不同月份所对应的生产时期不同,其环境微生物组成发生了变化。虽然每个月差异很大,但整体来看,新老车间的优势真菌属较为一致,优势真菌属(平均相对丰度大于1 %)中有7 种为两个车间共有,分别是热子囊菌属、Phialemoniopsis、链格孢属、毕赤酵母属、曲霉属、Neosetophoma和球腔菌属。老车间特有的优势真菌属为篮状菌属,新车间特有的真菌属有Cutaneotrichosporon、赤壳科未培养真菌属(unclassified_Nectriaceae)、绿核菌属。两个车间的空气样品中检测到352 个真菌属,两个车间共有的真菌属有212 个,在所有样品中都存在的只有7 个,按平均相对丰度高低依次是热子囊菌属(21.45 %)、链格孢属(13.09 %)、毕赤酵母属(11.82 %)、曲霉属(7.67 %)、球腔菌属(1.92 %)、unclassified_Fungi(0.86 %)和亚隔孢壳科未归类真菌属(unclassified_Didymellaceae,0.78%)。曹苗文等[11]在研究清香型大曲白酒酿造中发酵微生物的来源时发现发酵材料中的嗜热子囊菌属、曲霉属在大曲中很少或几乎没有,但却在环境中存在。嗜热子囊菌属具有良好的酶分泌特性,产纤维素酶、蛋白酶、淀粉酶、脂肪酶等酶类,并具有良好的热稳定性,能够在白酒发酵过程中温度较高的条件下保持稳定的催化效率[12];链格孢菌属具有突出的产蛋白酶的能力[13];毕赤酵母属具有较强产酯功能,能够利用发酵环境中的糖类、氨基酸、蛋白质等物质[14];曲霉属可以代谢产生多种蛋白酶和水解酶类[15];Phialemoniopsis是浓香型大曲生产环境空气中的优势真菌[16];篮状菌属的有些种是条件致病菌,但其许多种是重要酶类的产生菌[17],有产淀粉酶、蛋白酶和纤维素酶活性[18];球腔菌属是多种农林植物的病原菌,该属的不少种侵染植物后会引起植物组织坏死,产生病斑[19],但该菌只在空气中发现,在酒醅和大曲中并未发现。在酿酒区域空气中的热子囊菌属、Phialemoniopsis、毕赤酵母属、曲霉属等是凤香型白酒入池酒醅中的优势菌属,表明环境中真菌种群结构可能会影响酿酒过程中的真菌种群结构。
2.3 新老车间空气真菌Beta多样性差异
通过对样品真菌Beta 多样性距离矩阵进行层级聚类分析,构建样品层级聚类树研究不同样品的相似性和差异性。如图5,空气样品可分为5 类,O1、O2、N1、N2、O3、N3、O5、N5、N9、O10、N10、O11、N11、O12、N12 的真菌属聚为一类,O4、N4、O6 和N6 的真菌属聚为一类,O7 和N7 的真菌属聚为一类,O8 和N8 的真菌属聚为一类,O9 的真菌属单独为一类,结果表明,新老车间的微生物并没有明显有规律的聚类。

图5 真菌种群层次聚类分析(HCA)
3 结论
利用高通量测序技术对新老车间不同空气样品的真菌群落以及物种多样性之间的差异进行分析,共检测出10 个真菌门和352 个真菌属。老车间的样品中检测到7 个真菌门和277 个真菌属,新车间的样品中检测到7 个真菌门和263 个真菌属。两个车间共有的真菌属有212 个,至少在15 个样品中都存在的真菌属有41 个,在所有样品中都存在的有7 个,老车间和新车间空气样品中相对丰度大于1%的真菌属分别有9 和10 个,其中两个车间共有的有7 个。根据各菌门、属的相对丰度,子囊菌门是凤香型白酒新老制酒车间所有空气样品的优势菌门,新老车间共有的优势真菌属为热子囊菌属、Phialemoniopsis、链格孢属、毕赤酵母属、曲霉属、Neosetophoma、球腔菌属,老车间特有的有篮状菌属,新车间特有的为Cutaneotrichosporon、赤壳科未培养真菌属和绿核菌属。一年四季稳定存在的真菌属有热子囊菌属、链格孢属、毕赤酵母属、曲霉属、球腔菌属和两种未归类的真菌属。通过对真菌属水平分布差异分析,发现随着季节的变化,新老车间不同月份的真菌属组成差异较大,但全年共有的微生物数量较多,优势真菌属组成相似,这表明车间投产时间长短虽然有差异,但同属凤香型白酒产区,空气微生物差异不大。通过研究凤香型白酒制酒车间空气中真菌群落结构特征及优势菌属,为揭示凤香型白酒酿造环境微生物与酿造过程中微生物间的关系提供了理论基础,从环境微生物角度为凤香型白酒酿造的季节调控提供了科学依据。

