刺梨多糖提取物对小鼠Ⅱ型糖尿病的干预研究
伍 勇, 韦艾骥, 杨 堃, 李金桂, 董思思, 刘大利, 侯春兰, 刘红玲, 程 驰, 薛飞龙, 刘松青*
( 1. 成都师范学院 化学与生命科学学院, 成都 611130; 2. 特色园艺生物资源开发与利用四川省高校重点实验室, 成都 611130 )
Ⅱ型糖尿病作为现代人群高发的代谢性疾病,严重威胁着人类的生命健康。常用降糖药物虽有较好效果,但存在副作用(刘涛等,2021)。近年来,随着研究的深入,来源于天然植物且具备降血糖活性的多糖与膳食纤维,因其毒性小、活性高等优点而备受人们的关注(杨江涛,2008)。
刺梨(Rosaroxburghii)作为药食同源的优质材料,富含多糖、膳食纤维等天然营养成分。刺梨多糖提取物具有显著的体外抗氧化活性和降血糖活性,可防止餐后血糖水平升高(王振伟等,2021);刺梨多糖(RosaroxbunghiiTratt. polysaccharide,RRTP)在体外表现出一定的抗氧化活性,能对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)自由基起到明显的清除作用,具备一定的Fe3+还原力(付阳洋等,2021);RRTP还能够显著抑制α-葡萄糖苷酶和α-淀粉酶活性,从而调节血糖水平(陈庆等,2019;周笑犁等,2020);通过动物实验发现,RRTP可显著降低糖尿病小鼠的体重,也可显著提高小鼠抗疲劳能力、增强小鼠的免疫能力(汪磊,2019);张潘等(2023)研究发现,RRTP可显著降低NAFLD诱导小鼠的回肠炎症因子和氧化应激水平,改善脂质代谢紊乱状况,使回肠结构形态趋向于正常水平,减少隐窝病变、保护肠道屏障。此外,刺梨不溶性膳食纤维(RosaroxbunghiiTratt. insoluble dietary fiber,RTIDF)也被证实具有多种功能特性,在体外具有葡萄糖吸附能力和α-淀粉酶抑制能力(郑佳欣,2020);张想等(2021)研究发现,经过平菇发酵刺梨果渣所得膳食纤维的持水力、持油力和膨胀力有所提高且具有良好的润肠通便作用。但在动物体内RTIDF的降血糖功能还需要进一步的研究。目前对RRTP和RTIDF的生理功能已有较多研究,而对RRTP与RTIDF在降血糖功能上是否具有协同作用,还有待研究证实。
因此,本研究通过体外降糖模拟实验和体内动物干预实验,以Ⅱ型糖尿病模型小鼠为实验对象,从体重变化、血糖水平、血清中过氧化氢酶(catalase, CAT)含量等生理指标和小鼠肠道菌群特征的变化角度,拟探讨:(1)RRTP和RTIDF在降血糖功能上是否具有协同作用;(2)刺梨多糖提取物干预对糖尿病小鼠肠道菌群的影响;(3)RRTP和RTIDF是否能共同作为血糖调节的干预剂。
1 材料与方法
1.1 材料
刺梨干果,购自贵州贵定敏子食品有限公司;昆明种小鼠,体重18~22 g,SPF级,购自四川达硕科技有限公司,生产许可证号为SCXK(川)2020-030;乙醇、氯仿、正丁醇、PBS缓冲液、抗坏血酸(vitamin C, VC,购自国药集团化学试剂有限公司;AB-8大孔树脂,购自苏州凯胜仪器有限公司。
1.2 实验方法
1.2.1 刺梨多糖的制备 采用传统水提法。料液比为1∶30 (g∶mL),提取温度为95 ℃,搅拌提取2 h,重复提取1次,得到刺梨粗多糖液。采用Sevage试剂脱蛋白10次后,通过AB-8大孔树脂对多糖液进行脱色,抽滤,收集滤液。加入无水乙醇至乙醇体积分数为40%,过夜醇沉(4 ℃)后离心得到40%多糖组分;继续向上清液中添加无水乙醇至体积分数为60%,过夜醇沉离心得到60%多糖组分,冷冻干燥后即得到两种组分多糖,分别命名为多糖-A(RSPs-60)、多糖-B(RSPs-40)。
1.2.2 刺梨不溶性膳食纤维的制备 采用酶提取法(王曦璠等,2019)。向刺梨样品粉末中加入85%乙醇500 mL,进行脱糖处理,冷冻干燥后备用。取刺梨样品粉末,加入MES-TRIS缓冲液[料液比为1∶40(g∶mL),pH 8.2],加入α-淀粉酶、蛋白酶、淀粉葡萄糖苷酶去除刺梨中的非膳食纤维物质。用石油醚进行脱脂处理后,多次离心得到残渣,干燥即得到刺梨不溶性膳食纤维(RTIDF)。
1.2.3 α-淀粉酶、α-葡萄糖苷酶抑制活性测定 取制得的RRTP和RTIDF样品,用PBS缓冲液进行稀释,分别配置系列浓度的多糖样品溶液(屠洁,2015)。
α-淀粉酶抑制活性测定:样品管(样品+α-淀粉酶溶液)、样品对照管(样品+PBS缓冲液)、空白对照管(PBS缓冲液+α-淀粉酶溶液)。取上述各样品150 μL加入试管中,先后加入150 μL的α-淀粉酶溶液、150 μL 1%淀粉溶液充分反应(37 ℃恒温水浴30 min),反应完全后加入蒸馏水进行稀释,于520 nm处测定吸光度。样品对照管用PBS缓冲液代替酶溶液,空白对照管用PBS缓冲液代替多糖溶液,空白管为PBS缓冲溶液。
α-葡萄糖苷酶抑制活性测定:与上述实验相同,取不同质量浓度的样品150 μL加入试管中,先后分别加入150 μL的α-葡萄糖苷酶溶液、100 μL pNPG溶液充分反应(37 ℃恒温水浴30 min)后于400 nm处测定吸光度。以上两者的抑制率计算公式如下:

式中:Bi为样品溶液+酶溶液的吸光度值;Bj为样品溶液+PBS缓冲溶液的吸光度值;B1为PBS缓冲溶液+酶溶液的吸光度值;B0为PBS缓冲溶液吸光度值。
1.2.4 糖尿病小鼠的体内实验 40只昆明种小鼠(全为雄性),随机取10只作为正常组,剩余30只作为模型组(通过高脂饮食和腹腔注射STZ诱导糖尿病糖代紊乱模型,诱导6周)。测得小鼠空腹血糖水平持续高于正常血糖范围(3.9~6.1 mmol·L-1)且出现明显糖脂代谢紊乱症状(如活动减少、多食、多尿等)则建模成功(潘秋等,2010),将模型小鼠分为3组,每组10只。A组按600 mg·kg-1的剂量灌胃RTIDF颗粒混悬液、B组按600 mg·kg-1的剂量灌胃RRTP-RTIDF复合液(RRTP∶RTIDF=1∶2,V/V)作为干预组,CK组(模型小鼠)灌胃等剂量的生理盐水作为对照组,连续灌胃30 d。记录建模过程中的小鼠日摄食量及体重体征变化;观测给药前后各组小鼠血糖、血清中CAT酶活力水平情况;之后解剖取出各组小鼠肝脏、盲肠进行组织病理学观察和肠道菌群结构测定。
1.2.5 其他指标测定
1.2.5.1 DPPH自由基清除率的测定 两种不同浓度梯度的多糖样液,分别取0.1 mL于试管中,加入3.9 mL 3.0×10-2mg·mL-1的DPPH-甲醇液,混匀后避光静置20 min,于517 nm处测定其吸光值(Ai);以甲醇为空白对照组(A0);以VC作为参照组(冯燕茹等,2019)。计算公式如下:
式中:Ai为多糖样液吸光值;A0为空白对照液吸光值。
1.2.5.2 Fe3+还原力的测定 两种不同浓度梯度的多糖样液,分别加入2.5 mL 0.2 mol·L-1PBS缓冲液(pH 6.6)、2.5 mL铁氰化钾溶液(1%)混合均匀,50 ℃水浴20 min。加入三氯乙酸溶液(10%)终止反应。加入蒸馏水和氯化铁(0.1%)混合均匀,在700 nm下测吸光值,并以VC作为参照组(宋珅等,2014)。
1.2.5.3 血糖、血清中的CAT酶活力测定 灌胃第30天,将各组小鼠禁食12 h,剪尾取血,空腹血糖、血清中的CAT均参考试剂盒方法测定。
1.2.5.4 组织病理学观察 解剖取出各组小鼠肝脏、盲肠进行石蜡包埋,于切片机上切片,将切下的石蜡切片固定在载玻片上,于37 ℃下烘干,用苏木精-伊红染色(H &E染色)。染色完成后分别用乙醇、二甲苯进行脱水和透明切片,用中性树胶封片后进行显微观察和图像信息采集。
1.2.5.5 肠道菌群分析 小鼠粪便中DNA的提取和肠道菌群的检测参考汪磊(2019)的方法。委托上海欧易生物医学科技有限公司完成建库。
1.2.6 数据分析 各待测样品进行多次重复检测,用Excel软件进行数据统计,采用SPSS数据分析软件进行显著性方差分析以及多重比较,分析结果图形采用GraphPad Prism 8软件制作。
2 结果与分析
2.1 RRTP抗氧化活性测定结果
以VC作为对照(陈庆等,2019),两种多糖化合物的抗氧化活性分析(图1),在样品浓度为0.05~0.75 mg·mL-1范围内,随着样品浓度的升高, DPPH自由基清除率逐渐增强,多糖-A(RSPs-60)的自由基清除率略高于多糖-B(RSPs-40)的;在样品浓度为0.1~0.5 mg·mL-1范围内,多糖-A(RSPs-60)和多糖-B(RSPs-40)表现出一定的还原能力,但随着浓度的增加,还原能力上升趋势较小,远低于VC对Fe3+的还原能力(付阳洋等,2021),基于此结果,选择多糖-A(RSPs-60)进行后续小鼠体内实验。

图 1 样品浓度与自由基清除、还原性的关系Fig. 1 Relationship between sample concentration and free radical scavenging and reducibility
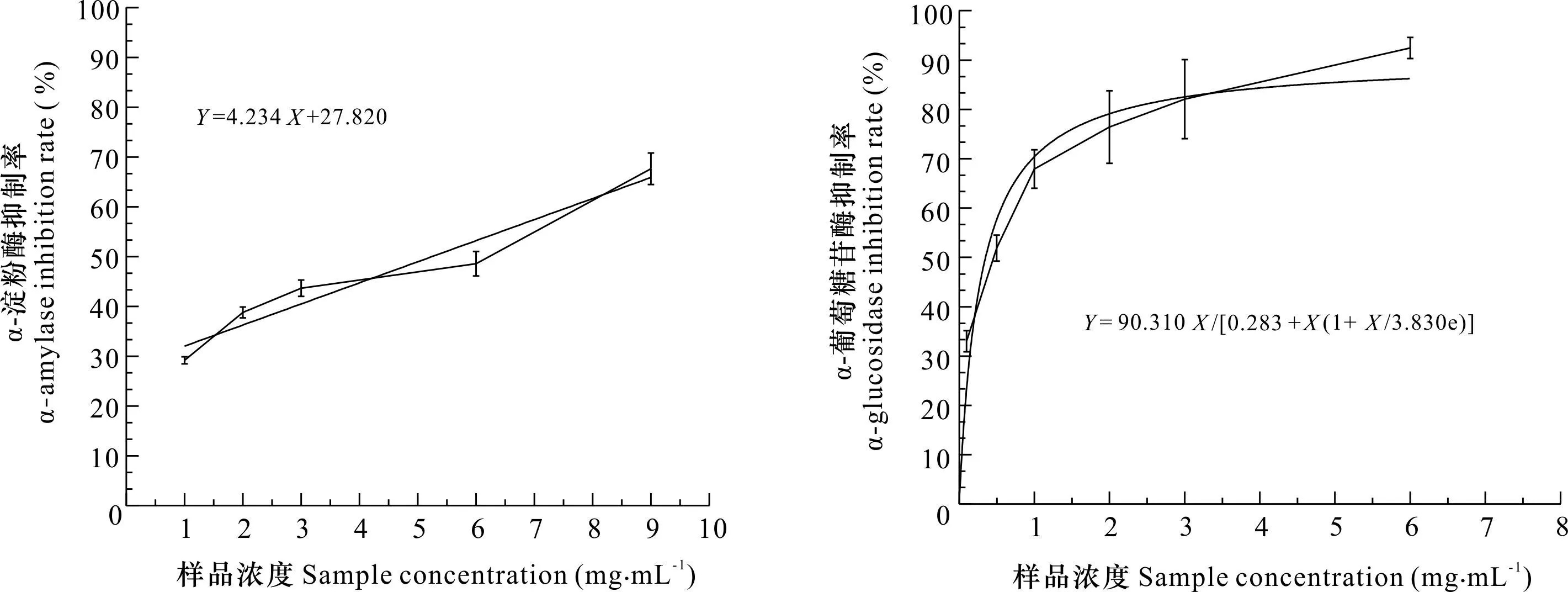
图 2 RRTP对α-淀粉酶和α-葡萄糖苷酶的抑制率Fig. 2 Inhibition rate of RRTP on α-amylase and α-glucosidase
2.2 体外降血糖实验结果
2.2.1 RRTP体外降血糖实验 由图2可知,RRTP对α-淀粉酶和α-葡萄糖苷酶的抑制作用随着浓度的升高而增加,IC50值分别为4.251、0.293 mg·mL-1。
2.2.2 RTIDF体外降血糖实验 由图3可知,RTIDF对α-淀粉酶的抑制作用在一定浓度区域随着浓度的升高而增加。当浓度达到1.5~2.0 mg·mL-1时,抑制效果逐渐趋于稳定,但RTIDF对α-葡萄糖苷酶的抑制未有显著效果。
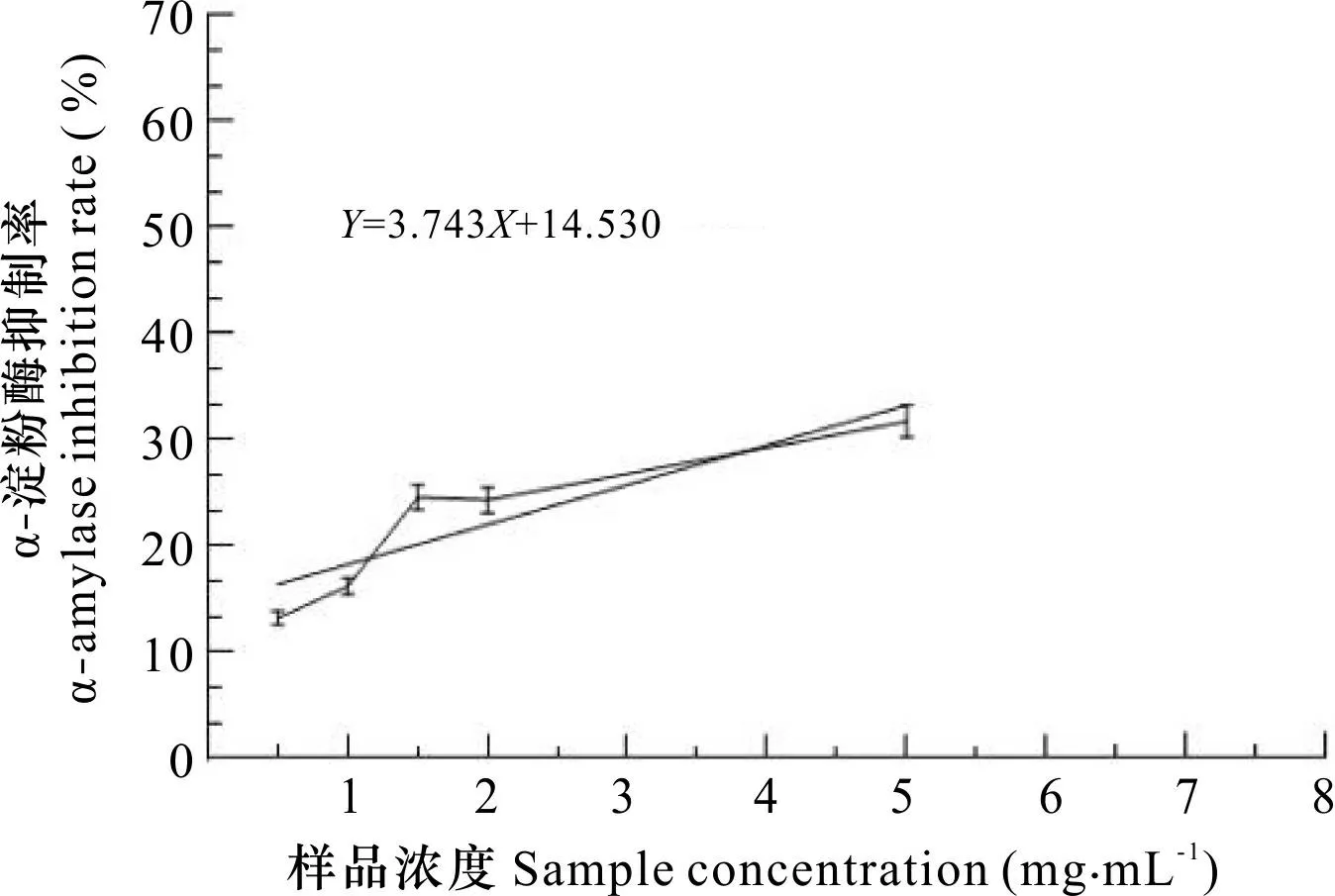
图 3 RTIDF对α-淀粉酶的抑制率Fig. 3 Inhibition rate of RTIDF on α-amylase
2.3 糖尿病小鼠的营养干预
2.3.1 干预前后小鼠体重体征的变化情况 在建模过程中,与正常组相比,模型组小鼠日平均摄食量呈现递增趋势(图4:a),其体重在15~30 d时显著高于正常组,但在31~46 d时,模型组小鼠逐渐消瘦,较正常组体重下降约16.67%,并开始出现活动减少、毛色泛黄、大便黏稠松软、抓力弱等症状,最终体重低于正常组(图4:b);RRTP和RTIDF干预后,与CK组(模型小鼠)相比,A组(RTIDF)、B组(RRTP+RTIDF)小鼠体重逐渐恢复,接近正常组小鼠体重水平,行为表现正常(图4:c),这表明RTIDF和RRTP的干预能改善小鼠对糖的代谢,逆转小鼠向糖尿病发展的趋势。
2.3.2 RRTP和RTIDF对小鼠血糖、CAT酶活力的调节 实验期间CK组(模型小鼠)血糖水平显著上升,持续处在高水平,血清中CAT酶活力低,表现出糖尿病小鼠特征;而刺梨提取物干预后,与CK组相比,A组(RTIDF)和B组(RRTP+RTIDF)小鼠的血糖水平显著下调,血清中CAT酶活力明显增强,B组优于A组(图5)。这表明RRTP和RTIDF的干预能够有效抑制糖尿病小鼠的血糖升高,起到降血糖的作用,逆转小鼠继续向糖尿病发展的趋势;还可降低过氧化氢对脏器的毒害,改善糖尿病小鼠对糖的代谢功能。
2.3.3 RRTP和RTIDF对糖尿病小鼠肝脏、盲肠功能的影响 灌胃8周后,对各组小鼠的肝脏和盲肠进行组织切片观察,与CK组(模型小鼠)相比,A组(RTIDF)和B组(RRTP+RTIDF)的小鼠肝脏细胞肿胀现象下降,细胞间隙增大,炎症因子减少,肝细胞结构相对清晰;盲肠黏膜层更为完整,吸收细胞增多,A组优于B组(图6)。这表明RRTP和RTIDF的干预能够缓解糖尿病小鼠肝脏和盲肠的病变情况,恢复其正常生理功能。
2.4 RRTP和RTIDF对糖尿病小鼠肠道菌群的影响
2.4.1 测序序列和OTU聚类结果 本研究通过OTU的Venn分析对不同处理组间OTU的组成相似性以及重叠性进行研究(图7), CK组(模型小鼠)与A组(RTIDF)和B组(RRTP+RTIDF)分别共享了887个和1 196个OTU,CK组、A组和B组分别独有75个、134个和61个OTU,表明刺梨多糖粗提物的干预显著影响了小鼠原有肠道菌群的组成,相比较而言,A组与CK组的差异更大。
2.4.2 RRTP和RTIDF对小鼠肠道微生物群落组成的影响
2.4.2.1 群落结构分析 在门水平上(图8:a),与CK组(模型小鼠)相比,A组(RTIDF)厚壁杆菌门(Firmicutes)相对丰度明显降低,Epsilonbacteraeota相对丰度显著升高,拟杆菌门(Bacteroidetes)相对丰度降低极为显著;B组(RRTP+RTIDF)厚壁杆菌门和拟杆菌门的相对丰度比值也显著降低。在属水平上(图8:b),与CK组相比,A组螺旋杆菌属(Helicobacter)、Mucispirillum和嗜冷杆菌属(Psychrobacter)相对丰度显著升高,而毛螺菌属(Lachnospira)、普雷沃氏菌属(Prevotella)相对丰度显著降低;B组螺旋杆菌属、普雷沃氏菌属相对丰度显著升高,而毛螺菌属和普雷沃氏菌属的相对丰度显著降低。
2.4.2.2 差异物种分析 在属水平上(图9),与CK组(模型小鼠)相比,RRTP和RTIDF的干预使小鼠肠道菌群物种发生极大差异变化, 表现为假单胞菌属(Pseudomonas)、醋酸杆菌属(Acetobacter)、韧皮部杆菌属(Candidatus)的相对丰度明显升高,但瘤胃菌属(Ruminiclostridium、Ruminiclostridium_9、Ruminiclostridium_NK4A214_group)、颤螺旋菌属(Oscillibacter)、真杆菌属(Eubacterium)的相对丰度显著降低。这表明RRTP和RTIDF干预可以调节糖尿病小鼠的肠道菌群组成,改善菌群结构。
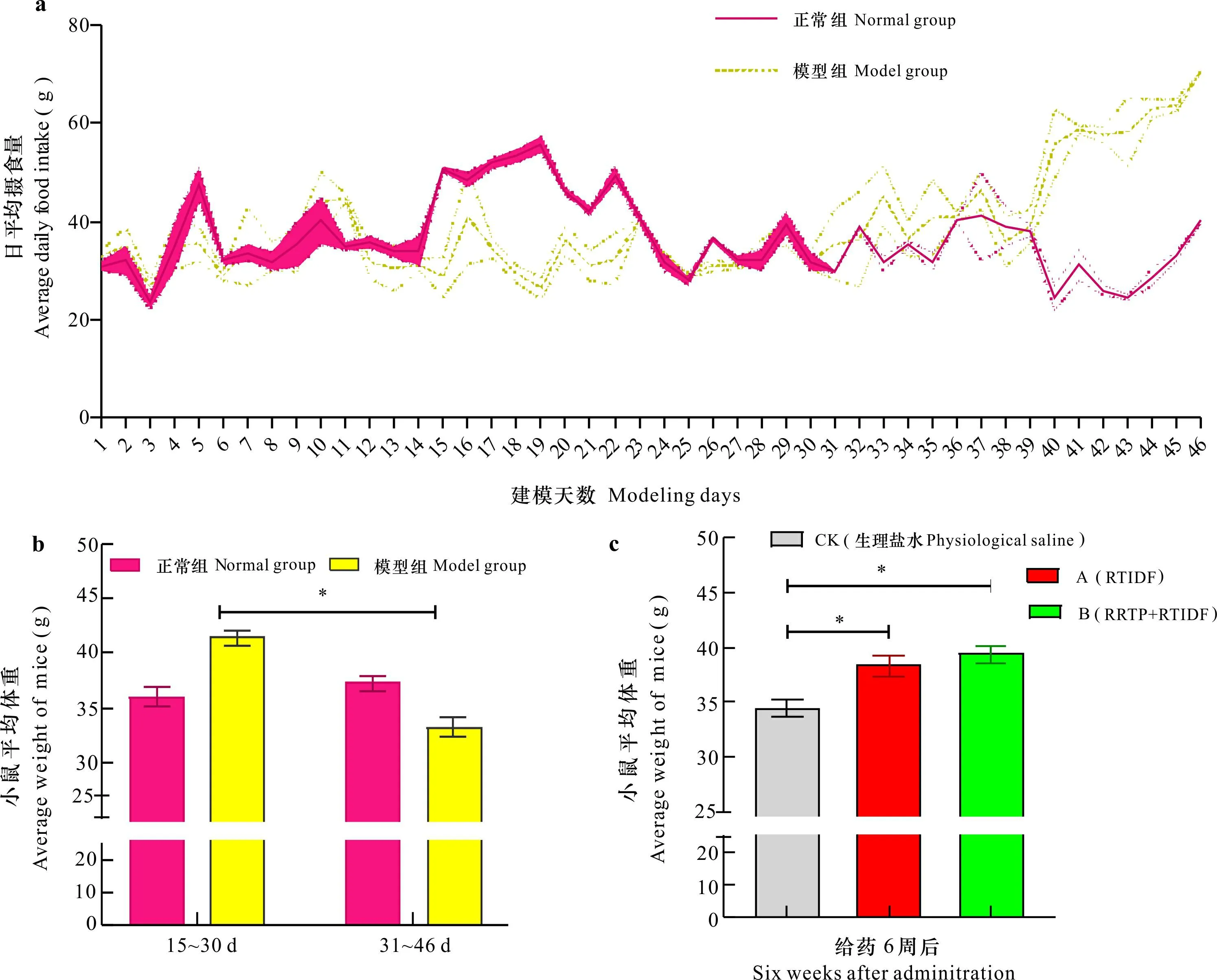
a. 建模过程小鼠日平均摄食量变化; b. 建模过程小鼠体重变化; c. 给药6周后小鼠体重变化。 *代表小组间的差异达到显著水平 (P<0.05) 。a. Changes in average daily food intake of mice during the modeling; b. Changes in body weight of mice during the modeling; c. Changes in body weight of mice six weeks after administration. * means significant differences between groups (P<0.05).图 4 实验过程小鼠体重变化Fig. 4 Changes in body weight of mice during the experiment

a. 给药前后小鼠血糖的变化; b. 给药前后小鼠血清中CAT酶活力的变化。 * 代表小组间的差异达到显著水平 (P<0.05), ns则表示差异不显著。a. Changes of blood glucose in mice before and after administration; b. Changes of CAT enzyme activity in serum of mice before and after administration. * means significant differences between groups (P<0.05), and ns means no significant difference.图 5 给药前后小鼠血糖、血清中CAT酶活力的变化Fig. 5 Changes of blood glucose and CAT enzyme activity in serum of mice before and after administration
与CK组(模型小鼠)相比,RRTP和RTIDF的干预显著提高了糖尿病小鼠肠道微生物组成中Lactobacillaceae、普雷沃氏菌属等有益菌的丰度,从而提高肠道免疫力并改善肥胖导致的组织炎症和氧化应激状态;RRTP和RTIDF的干预还降低了Enterocaccaceae、Desulfovibrionaceae等有害菌的丰度,发挥降血糖和抗炎作用。这些结果表明刺梨多糖提取物的降血糖作用可能与其对糖尿病小鼠肠道微生物的调控有关。
3 讨论
RRTP在体外表现出一定的抗氧化活性,能对DPPH自由基起到明显的清除作用,具备一定的Fe3+还原力(陈庆等,2019;付阳洋等,2021)。在本研究中,随着RRTP样品浓度的升高,RRTP对DPPH自由基的清除率逐渐增强,同样表现出一定的还原能力,与他们的研究结果一致。
α-葡萄糖苷酶和α-淀粉酶是促进淀粉消化吸收的关键酶,天然多糖提取物可通过抑制其活性而抑制糖尿病人餐后血糖的迅速上升(潘玥等,2022)。在本研究中,体外实验发现RRTP具有较好的自由基清除力,能对α-葡萄糖苷酶和α-淀粉酶起显著抑制作用,IC50值分别为0.293、4.251 mg·mL-1,而RTIDF仅对α-淀粉酶活性具有一定的抑制作用,这可能是由于RRTP与RTIDF降血糖的机理不同,RRTP可能主要是通过抑制血糖调节有关酶的活性从而降低血糖水平,而RTIDF可能通过调节肠道菌群结构等方式进行血糖干预(夏洁,2020)。
通过糖尿病小鼠的体内干预实验发现,RRTP和RTIDF干预后,与CK组(模型小鼠)相比,A组(RTIDF)和B组(RRTP+RTIDF)小鼠体重逐渐恢复,接近正常组小鼠体重水平,并且B组优于A组,这表明RRTP和RTIDF的干预能改善小鼠对糖的代谢,逆转小鼠向糖尿病发展的趋势,RRTP和RTIDF之间存在一定的协同调节作用(汪磊, 2019);分析血糖与血清中的CAT酶活力发现,实验期间CK组(模型小鼠)血糖水平显著上升,持续处在高水平,血清中CAT酶活力低,表现出糖尿病小鼠特征,而RRTP和RTIDF干预后,与CK组相比,A组(RTIDF)和B组(RRTP+RTIDF)小鼠的血糖水平显著下调,血糖平衡能力显著升高,血清中CAT酶活力明显增强,B组优于A组,同样表明RRTP和RTIDF的干预能够有效抑制糖尿病小鼠的血糖升高,起到降血糖的作用,逆转小鼠继续向糖尿病发展的趋势(杨江涛,2008),还可降低过氧化氢对脏器的毒害,改善糖尿病小鼠对糖的代谢功能,RRTP和RTIDF之间表现出明显的协同作用。进一步分析肠道菌群发现,RRTP+RTIDF可降低拟杆菌门与厚壁菌门的比例,增加醋酸杆菌等有益菌的种群丰度,而RTIDF对于种群的调节作用更加显著,但没有表现出良好的协同作用,这可能是因为RRTP在小鼠肠道中不能发挥全部活性,有部分多糖失活,而RTIDF却能表现出较强活性。

CK. 生理盐水; A. RTIDF; B. RRTP+RTIDF。 黄色箭头表示肝脏炎症因子数量变化; 蓝色箭头表示肝脏细胞肿胀程度变化; 红色箭头表示盲肠黏膜完整度变化; 绿色箭头表示盲肠吸收细胞数目的变化。CK. Physiological saline; A. RTIDF; B. RRTP+RTIDF. Yellow arrows represent changes in the number of inflammatory factors in the liver; blue arrows represent the changes of swelling degree of liver cells; red arrows represent changes in cecal mucosa integrity; green arrows represent changes in the number of absorbing cells in the cecum.图 6 小鼠肝脏、盲肠组织切片观察Fig. 6 Observation of liver and cecum tissue sections of mice
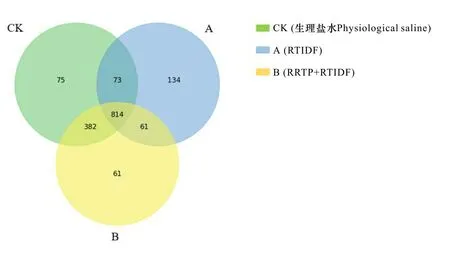
图 7 不同处理组样本 OTU 的 Venn 分析图Fig. 7 Venn analysis diagram of OTU in different treatment groups
4 结论
RRTP和RTIDF可以改善糖尿病小鼠对糖的代谢功能,显著降低糖尿病小鼠血糖血脂水平,提高糖尿病小鼠血清中CAT的活性,还可以降低肝脏的炎症因子水平,缓解细胞肿胀程度,增加盲肠的吸收细胞数目,使黏膜更加完整,从而改善机体的消化吸收和代谢功能;RRTP和RTIDF降低了小鼠肠道中拟杆菌门和厚壁菌门的比值,提高了小鼠肠道中Bacteroidaceae、Bacteroidaceae_S24-7_group和Lactobacillaceae等有益菌的丰度,降低了Enterocaccaceae、Desulfovibrionaceae等有害菌的丰度。综合体外降糖模拟与体内干预实验结果, RRTP与RTIDF在糖尿病小鼠的血糖干预中具有一定的协同作用,或可共同作为改善Ⅱ型糖尿病的干预剂。
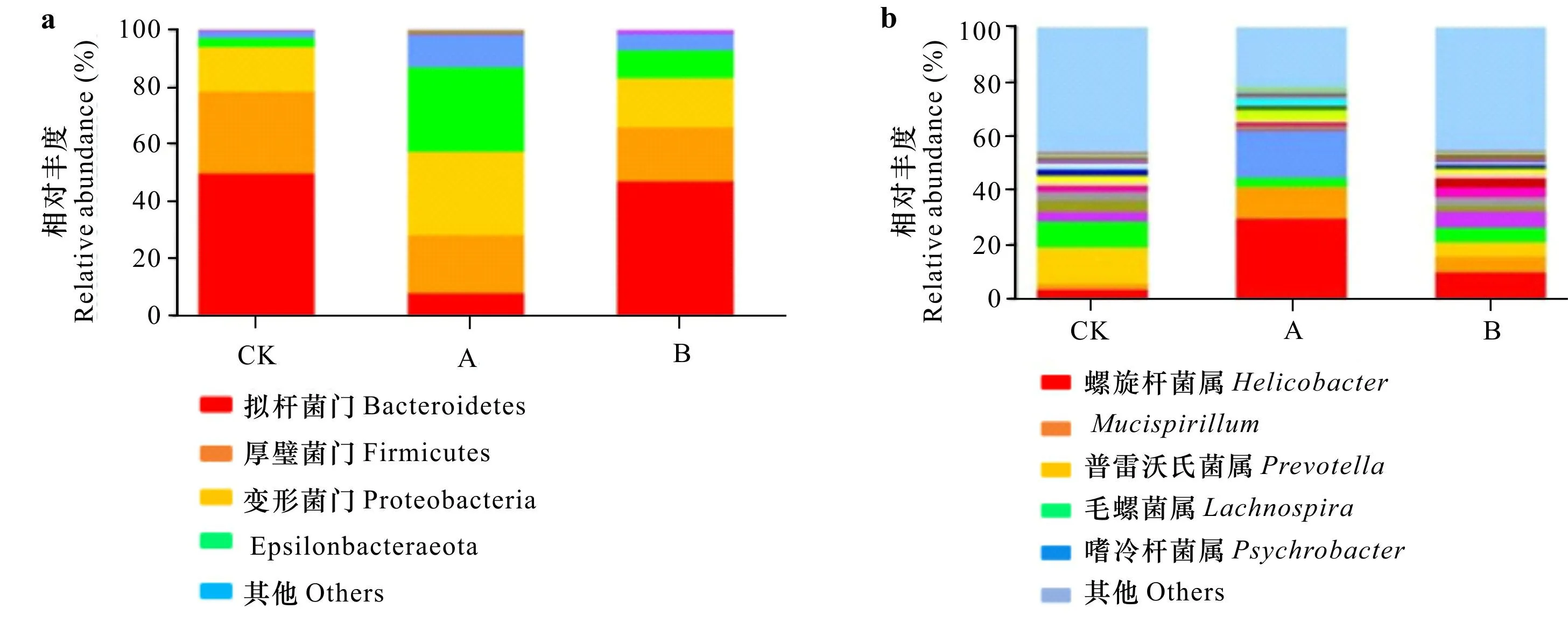
CK. 生理盐水; A. RTIDF; B. RRTP+RTIDF; a. 门水平上的微生物群落结构分析; b. 属水平上的微生物群落结构分析。CK. Physiological saline; A. RTIDF; B. RRTP+RTIDF; a. Analysis of microbial community structure at phylum level; b. Analysis of microbial community structure at genus level.图 8 小鼠肠道微生物群落结构分析Fig. 8 Analysis of intestinal microbial community structure in mice

M1. 瘤胃菌属; M2. 瘤胃菌属; M3. 颤螺旋菌属; M4. 假单胞菌属; M5. 醋酸杆菌属; M6. 瘤胃菌属; M7. 真杆菌属; M8. 韧皮部杆菌属。M1. Ruminclostridium; M2. Ruminclostridium_9; M3. Qscillibacter; M4. Pseudomonas; M5. Acetobacter; M6. Ruminclostridium_NK4A214_group; M7. Eubacterrium; M8. Candidans.图 9 小鼠肠道微生物差异物种分析Fig. 9 Analysis of different species of intestinal microbes in mice

