大花地不容块根生物碱成分的研究
孙国峰, 陈封政, 田 冲, 成 英, 李书华
( 乐山师范学院 新能源材料与化学学院/乐山特色农产品药用成分研发工程中心, 四川 乐山 614000 )
大花地不容(Stephaniamacrantha)是1988年报道的一个新种(罗献瑞,1988),该种归属于千金藤属山乌龟亚属山乌龟组,主要分布于云南,由于其花形特殊,在云南漾濞县的部分家庭将大花地不容作为观赏植物栽培(谢道涛,2014)。《中国植物志》记载防己科千金藤属植物约60种,分布于亚洲和非洲的热带和亚热带地区,少数产于大洋洲,分布于中国的千金藤属植物有39个种,分别属于3个亚属(千金藤亚属、粉防己亚属和山乌龟亚属),其中山乌龟亚属植物具有块根,生物碱含量较高,活性强(朱兆仪等,1983)。山乌龟亚属植物中广西地不容、云南地不容、小叶地不容研究比较充分,尤其对广西地不容的研究显得深入和全面,涉及其生物碱成分(闵知大和钟守明,1980;成桂仁等,1981;黄秋洁等,2018),内生真菌(卿朕等,2016;周秋艳等,2016;刘晓莹等,2017;汤夏安等,2019)和种子资源(覃艳,2006)等。大花地不容的基础研究非常薄弱,仅20世纪90年代有一篇关于生物碱成分的研究报道(陈嬿等,1994)。为了进一步详细研究该植物块根的化学成分及活性,我们对大花地不容块根的生物碱成分及主要成分的生物活性进行了研究,共得到了11个化合物,分别为青藤碱(1)、青风藤碱(2)、斯帝酚灵碱(3)、瑞枯灵(4)、异紫堇定(5)、紫堇单酚碱(6)、巴婆碱(7)、sukhodianine(8)、荷包牡丹碱(9)、7-氧代克班宁(10)和巴马汀(11),化合物1-11的结构见图1。其中,化合物2、3、4、7、8、9、10系首次从大花地不容中分离得到。
1 仪器与材料
旋转蒸发仪RE212BW-B(日本雅玛拓);冷却水循环装置CF810C(日本雅玛拓);隔膜真空泵LVS302Z(美国威尔奇);制备液相色谱SACID 100 mm (成都格莱精密仪器有限公司);Varian INOVA 400核磁共振谱仪。
大花地不容块根,2019年3月购自安国冷背药材有限公司,经乐山师范学院成英副教授鉴定为防己科千金藤属植物大花地不容(Stephaniamacrantha)的块根,样本保存于乐山师范学院乐山特色农产品药用成分研发工程中心(20190301)。
2 提取与分离
2.1 总生物碱的提取
取大花地不容块根3 kg,首先经60 ℃烘干后粉碎,过10目筛,将大花地不容块根小颗粒倒入100 L提取罐中,然后加入3.65×10-3g·mL-1的盐酸溶液30 L,搅拌6 h,转速20 r·min-1,放出提取液,最后再向提取罐中加入3.65×10-3g·mL-1的盐酸溶液20 L,搅拌3 h,转速20 r·min-1,放出提取液。合并2次提取液,首先用氢氧化钠水溶液调节提取液的pH至9左右,然后用30 L二氯甲烷萃取碱性提取液2次,合并2次二氯甲烷萃取液,接着用20 L蒸馏水洗涤二氯甲烷萃取液,最后50 ℃减压浓缩二氯甲烷后得到大花地不容块根的总生物碱95 g。
2.2 总生物碱的分离纯化
2.2.1 总生物碱的硅胶柱层析分离 称取200目层析硅胶800 g,以二氯甲烷湿法装柱。称取总生物碱80 g,拌样上样。以不同比例的二氯甲烷∶甲醇(50∶1→5∶1)为洗脱液,收集洗脱液,经薄层层析点板检测后,分成了8个部分。
2.2.2 生物碱的制备液相分离纯化 将上述经过硅胶柱层析分段得到的8个部分的生物碱,通过制备液相色谱分离纯化。制备方法:将样品用酸水溶解后吸入制备柱,然后以乙腈(20%)-水(80%)梯度洗脱,逐渐增加乙腈的比例,直至乙腈比例为80%。检测波长:254 nm。制备柱:C18,50 mm × 450 mm,5 μm。
按照峰收集洗脱液, 各洗脱液首先用氨水调至中性后浓缩除去乙腈,然后用氨水碱化后,最后用二氯甲烷萃取。
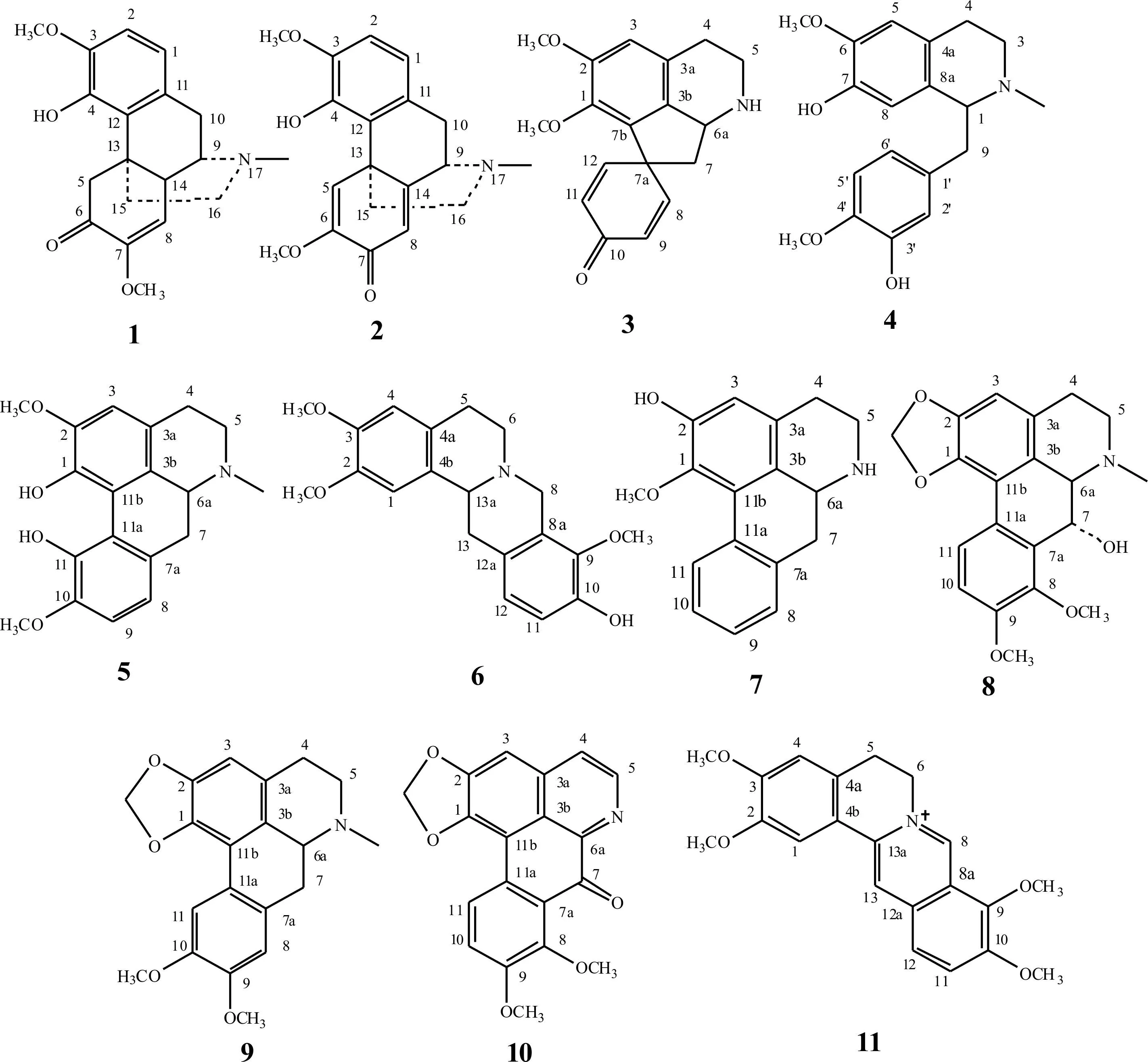
图 1 化合物1-11的结构Fig. 1 Structures of compounds 1-11
按照上述方法,经过多次制备液相制备纯化后,按照出峰顺序依次得到11个化合物,分别为化合物1(3 100 mg)、2(850 mg)、3(81 mg)、4(296 mg)、5(126 mg)、6(109 mg)、7(225 mg)、8(76 mg)、9(168 mg)、10(527 mg)、11(237 mg)。
3 化合物结构鉴定
化合物1白色无定形粉末,碘化铋钾显橘红色,推断该化合物可能为生物碱。ESI-MSm/z: 330 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 6.63 (1H, d,J=8 Hz, H-2), 6.54 (1H, d,J=8 Hz, H-1), 6.07 (1H, brs, HO-4), 5.47 (1H, s, H-8), 4.35 (1H, d, H-5e), 3.80 (3H, s, OCH3-3), 3.49 (3H, s, OCH3-7), 3.17 (1H, m, H-9), 2.43 (3H, s, NCH3-17)。13C-NMR (CDCl3, 100 MHz)δ: 194.1 (C-6), 152.3 (C-7), 145.0 (C-3), 144.7 (C-4), 130.4 (C-11), 122.6 (C-12), 118.2 (C-1), 115.1 (C-8), 108.9 (C-2), 56.7 (C-9), 56.1 (OCH3-3), 54.8 (OCH3-7), 49.2 (C-5), 47.1 (C-16), 45.9 (C-14), 42.8 (-NCH3), 40.5 (C-13), 36.0 (C-15), 24.2 (C-10)。上述核磁数据与文献(曾立和尹文清,2010)报道的青藤碱(sinomenine)基本一致,故鉴定该化合物为青藤碱。
化合物2白色无定形粉末,碘化铋钾显橘红色,推断该化合物可能为生物碱。ESI-MSm/z: 328 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 7.55 (1H, s, H-5), 6.75 (1H, d,J=8 Hz, H-2), 6.66 (1H, d,J=8 Hz, H-1), 6.33 (1H, s, H-8), 3.89 (3H, s, OCH3-3), 3.75 (3H, s, OCH3-6), 3.69 (1H, d,J=4 Hz, H-9), 3.33 (1H, d,J=16 Hz, H-10b), 2.98 (1H, m, H-10a), 2.60 (1H, m, H-16b), 2.47 (1H, m, H-16a), 2.45 (3H, s, NCH3), 2.37 (1H, m, H-15b), 1.75 (1H, m, H-15a)。13C-NMR (CDCl3, 100 MHz)δ: 181.5 (C-7), 161.7 (C-14), 151.0 (C-6), 145.4 (C-3), 143.3 (C-4), 129.8 (C-11), 124.0 (C-12), 120.5 (C-5), 118.8 (C-1), 109.5 (C-2), 61.0 (C-9), 56.3 (OCH3-3), 54.9 (OCH3-6), 47.0 (C-16), 43.7 (C-13), 41.7 (-NCH3), 37.8 (C-15), 32.6 (C-10)。上述核磁数据与文献(沈晓静等,2016)报道的青风藤碱(sinoactine)基本一致,故鉴定该化合物为青风藤碱。
化合物3褐色无定形粉末,碘化铋钾显橘红色,推断该化合物可能为生物碱。ESI-MSm/z: 298 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 7.03 (1H, d,J=8 Hz, H-12), 6.89 (1H, d,J=8 Hz, H-8), 6.64 (1H, s, H-3), 6.41 (1H, d,J=8 Hz, H-9), 6.29 (1H, d,J=8 Hz, H-11), 4.29 (1H, m, H-6a), 3.81 (3H, s, OCH3-1), 3.60 (3H, s, OCH3-2), 3.45 (1H, m, H-5), 3.15 (1H, m, H-5), 2.77 (2H, m, H-4), 2.40 (1H, m, H-7), 2.30 (1H, m, H-7)。13C-NMR (CDCl3, 100 MHz)δ: 186.2 (C-10), 153.5 (C-1), 150.0 (C-8, 12), 144.3 (C-2), 135.5 (C-7b), 132.5 (C-3b), 128.2 (C-9, 11), 127.4 (C-3a), 112.2 (C-3), 61.0 (OCH3-2), 57.7 (C-6a), 56.3 (OCH3-1), 51.2 (C-7a), 48.2 (C-5), 45.0 (C-4), 26.3 (C-7)。上述核磁数据与文献(龚运淮和丁立生,2006;张茂生,2009)报道的斯帝酚灵碱(stepharine)基本一致,故鉴定该化合物为斯帝酚灵碱。
化合物4浅黄色无定形粉末,ESI-MSm/z: 330 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 6.77 (1H, s, H-2′), 6.73 (1H, d,J=8 Hz, H-5′), 6.59 (1H, d,J=8 Hz, H-6′), 6.54 (1H, s, H-5), 6.37 (1H, s, H-8), 3.85 (6H, s, OCH3-6, OCH3-4′), 3.71 (1H, m, H-1), 3.19 (1H, m, H-3a), 3.05 (1H, m, H-9a), 2.80 (3H, m, H-3b, H-9b, H-4a,), 2.60 (1H, m, H-4b), 2.40 (3H, s, NCH3)。13C-NMR (CDCl3, 100 MHz)δ: 145.3 (C-6), 145.2 (C-4′), 145.0 (C-7), 143.4 (C-3′), 133.0 (C-8a), 130.1 (C-1′), 125.0 (C-4a), 120.9 (C-6′), 115.6 (C-2′), 113.7 (C-5′), 110.6 (C-8), 110.4 (C-5), 64.5 (C-1), 55.9 (OCH3-6), 55.8 (OCH3-4′), 46.6 (C-3), 42.2 (-NCH3), 40.9 (C-9), 24.8 (C-4)。以上核磁数据与文献(王恩军等,2008)报道的瑞枯灵(reticuline)基本一致,故鉴定该化合物为瑞枯灵。
化合物5浅黄色无定形粉末,ESI-MSm/z: 342 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 8.84 (1H, s, 11-OH), 6.86 (1H, d,J=8 Hz, H-8), 6.84 (1H, d,J=8 Hz, H-9), 6.70 (1H, s, H-3), 3.92 (3H, s, OCH3-10), 3.91 (3H, s, 2-OCH3), 3.71 (3H, s, OCH3-1), 3.18 (1H, m, H-6a), 3.05 (2H, m, H-4), 2.88 (1H, d,J=16Hz, H-7a), 2.71 (1H, d,J=16Hz, H-7b), 2.54 (3H, s, NCH3), 2.45 (2H, m, H-5)。13C-NMR (CDCl3, 100 MHz)δ: 151.3 (C-2), 149.5 (C-10), 144.0 (C-11), 142.2 (C-1), 130.2 (C-3a), 130.0 (C-7a), 129.2 (C-11b), 126.0 (C-3b), 120.2 (C-11a), 119.0 (C-8), 111.1 (C-3), 110.0 (C-9), 62.9 (C-6a), 62.1 (OCH3-1), 56.2 (OCH3-10), 55.9 (OCH3-2), 52.7 (C-5), 43.9 (-NCH3), 35.9 (C-7), 29.3 (C-4)。以上核磁数据与文献(张茂生,2009)报道的异紫堇定(isocorydine)基本一致,故鉴定该化合物为异紫堇定。
化合物6类白色无定形粉末,ESI-MSm/z: 342 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 6.80 (1H, d,J=8 Hz, H-11), 6.76 (1H, d,J=8 Hz, H-12), 6.73 (1H, s, H-1), 6.62 (1H, s, H-1), 4.22 (1H, d,J=16 Hz, H-8a), 3.89 (3H, s, OCH3-2), 3.87 (3H, s, OCH3-3), 3.81 (3H, s, OCH3-9), 3.59 (1H, m, H-13a), 3.57 (1H, m, H-8b), 3.24 (1H, m, H-6a), 3.20 (1H, m, H-13), 3.16 (1H, m, H-5a), 2.83 (1H, m, H-13), 2.69 (1H, m, H-5b), 2.66 (1H, m, H-6b)。13C-NMR (CDCl3, 100 MHz)δ: 147.5 (C-3), 147.4 (C-2), 146.6 (C-10), 143.3 (C-9), 129.6 (C-4b), 127.9 (C-12a), 127.2 (C-4a), 126.6 (C-8a), 124.9 (C-12), 114.4 (C-11), 111.3 (C-4), 108.5 (C-1), 60.6 (OCH3-9), 59.5 (C-13a), 56.1 (OCH3-2), 55.9 (OCH3-3), 53.9 (C-8), 51.6 (C-6), 36.2 (C-13), 29.0 (C-5)。以上核磁数据与文献(杨德兰,2010)报道的紫堇单酚碱(corydalmine)基本一致,故鉴定该化合物为紫堇单酚碱。
化合物7棕色无定形粉末,ESI-MSm/z: 268 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 8.29 (1H, d,J=8 Hz, H-11), 7.21~7.33 (3H, m, H-8, 9, 10), 6.71 (1H, s, H-3), 3.80 (1H, dd,J=16, 4Hz, H-8), 3.59 (3H, s, OCH3-1), 3.35 (1H, m, H-6a), 2.99 (2H, m, H-5), 2.77 (2H, m, H-4), 2.70 (2H, m, H-7)。13C-NMR (CDCl3, 100 MHz)δ: 148.2 (C-2), 142.8 (C-1), 136.2 (C-7a), 132.0 (C-11a), 130.0 (C-3b), 128.7 (C-8), 128.0 (C-9), 127.6 (C-10), 127.3 (C-3a), 127.2 (C-11), 125.3 (C-11b), 114.6 (C-3), 60.4 (OCH3-1), 53.6 (C-6a), 43.3 (C-5), 37.4 (C-7), 29.0 (C-4)。以上核磁数据与文献(龚运淮和丁立生,2006;钟圣海等,2016)报道的巴婆碱(asimilobine)基本一致,故鉴定该化合物为巴婆碱。
化合物8类白色无定形粉末,ESI-MSm/z: 355 [M]+。1H-NMR (CDCl3, 400 MHz)δ: 7.91 (1H, d,J=8 Hz, H-11), 7.08 (1H, d,J=8 Hz, H-10), 6.57 (1H, s, H-3), 6.08 (1H, s, -OCH2-), 5.95 (1H, s, -OCH2-), 5.43 (1H, brs, H-7), 3.92 (6H, s, OCH3-8, OCH3-9), 3.21 (1H, m, H-6a), 3.16 (2H, m, H-5), 2.71 (1H, m, H-4), 2.70 (3H, s, NCH3)。13C-NMR (CDCl3, 100 MHz)δ: 153.3 (C-8), 148.4 (C-9), 147.6 (C-2), 143.5 (C-1), 130.8 (C-7a), 129.4 (C-3a), 124.7 (C-10), 124.6 (C-3b), 122.7 (C-11a), 116.7 (C-11b), 113.6 (C-11), 107.8 (C-3), 101.9 (-OCH2-),67.7 (C-7), 61.8 (OCH3-8), 60.3 (OCH3-9), 56.1 (C-6a), 54.4 (C-5), 43.3 (-NCH3), 29.3 (C-4)。以上核磁数据与文献(石晓丽,2013)报道的sukhodianine基本一致,故鉴定该化合物为sukhodianine。
化合物9类白色无定形粉末,ESI-MSm/z: 340 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 7.67 (1H, s, H-11), 6.78 (1H, s, H-8), 6.52 (1H, s, H-3), 6.08 (1H, s, -OCH2-), 5.93(1H, s, -OCH2-), 3.92 (6H, s, OCH3-9, OCH3-10), 3.14 (1H, m, H-6a), 3.07 (2H, m, H-5), 2.65 (2H, m, H-4), 2.61 (1H, m,H-7), 2.60 (3H, s, NCH3), 2.52 (1H, m, H-7)。13C-NMR (CDCl3, 100 MHz)δ: 148.2 (C-10), 147.7 (C-9), 146.6 (C-2), 141.8 (C-1), 128.4 (C-7a), 126.7 (C-3a), 126.4 (C-3b), 123.6 (C-11a), 116.6 (C-11b), 111.3 (C-11), 110.5 (C-8), 106.8 (C-3), 100.6 (-OCH2-),62.4 (C-6a), 56.1 (OCH3-9), 55.9 (OCH3-10), 53.6 (C-5), 43.9 (-NCH3), 34.2 (C-7), 29.2 (C-4)。以上核磁数据与文献(彭扶云,2014)报道的荷包牡丹碱(dicentrine)基本一致,故鉴定该化合物为荷包牡丹碱。
化合物10类白色无定形粉末,ESI-MSm/z: 335 [M]+。1H-NMR (CDCl3, 400 MHz)δ: 8.78 (1H, d,J=4 Hz, H-5), 8.27 (1H, d,J=8 Hz, H-11), 7.63 (1H, d,J=4 Hz, H-4), 7.14 (1H, d,J=8 Hz, H-10), 7.01 (1H, s, H-3), 6.31 (2H, s, -OCH2-), 4.01 (3H, s, OCH3-8), 3.95 (3H, s, OCH3-9)。13C-NMR (CDCl3, 100 MHz)δ: 181.7 (C-7), 153.6 (C-1), 151.7 (C-2), 151.2 (C-6a), 146.4 (C-8), 146.2 (C-9), 144.6 (C-5), 135.3 (C-7a), 126.1 (C-3a), 125.6 (C-11a), 123.8 (C-11), 123.5 (C-10), 120.0 (C-11b), 117.0 (C-4), 108.4 (C-11b), 102.2 (C-3), 102.0 (-OCH2-), 62.5 (OCH3-8), 56.2 (OCH3-9)。以上核磁数据与文献(彭扶云,2014)报道的7-氧代克班宁(7-oxocrebanine)基本一致,故鉴定该化合物为7-氧代克班宁。
化合物11浅黄色无定形粉末,ESI-MSm/z: 353 [M+H]+。1H-NMR (CDCl3, 400 MHz)δ: 9.79 (1H, s, H-8), 8.82 (1H, s, H-13), 8.14 (1H, d,J=8 Hz, H-11), 8.03 (1H, d,J=8 Hz, H-12), 7.68 (1H, s, H-1), 7.07 (1H, s, H-4), 4.96 (2H, m, H-6), 4.23 (3H, s, OCH3-10), 4.13 (3H, s, OCH3-9), 4.01 (3H, s, OCH3-2), 3.96 (3H, s, OCH3-3), 3.31 (2H, m, H-5)。13C-NMR (CDCl3, 100 MHz)δ: 153.6 (C-9), 151.6 (C-3), 150.6 (C-2), 146.1 (C-8), 145.5 (C-10), 139.5 (C-13a), 135.0 (C-12a), 130.0 (C-4a), 127.8 (C-12), 124.1 (C-11), 123.0 (C-8a), 121.0 (C-4b), 111.9 (C-4), 109.6 (C-1), 62.2 (OCH3-9), 57.3 (OCH3-3), 57.0 (C-6), 56.7 (OCH3-2), 56.4 (OCH3-10), 27.2 (C-5)。以上核磁数据与文献(王恩军等,2008)报道的巴马汀(palmatine)基本一致,故鉴定该化合物为巴马汀。
4 活性测试
对大花地不容块根的总生物碱和主要成分青藤碱进行了细胞毒活性测试。参照文献(李书华等,2021)采用 CCK-8测定法检测。大花地不容块根的总生物碱对肺癌细胞A549的IC50值为7.5×10-4g·mL-1,青藤碱对肺癌细胞A549的IC50值为6.59×10-9g·mL-1,上述结果表明大花地不容块根总生物碱和青藤碱对肺癌细胞A549均有一定的细胞毒活性。
5 讨论与结论
山乌龟亚属植物中的云南地不容的主要生物碱成分为青风藤碱,其次为克班宁,分别属于吗啡烷型和阿朴啡型生物碱(彭扶云,2014);广西地不容的主要生物碱成分为L-四氢巴马汀碱,属于原小檗碱型生物碱(闵知大和钟守明,1980);小叶地不容的主要生物碱成分为青风藤碱(左爱学等,2013)和L-四氢巴马汀碱(何嘉泳等,2017)。本研究中大花地不容的主要生物碱成分为青藤碱,属于吗啡烷型生物碱。从植物化学分类学上看,分布于中国的千金藤属山乌龟亚属山乌龟组的几种植物的主要生物碱均有差异,分别属于吗啡烷型、阿朴啡型和原小檗碱型生物碱,这与杨鹤鸣和陈嬿(1994)的研究结果一致。
本文对大花地不容块根的生物碱成分进行了详细的研究,鉴定了11个生物碱,均属于异喹啉类生物碱,其中化合物1是该植物块根的主要生物碱类成分,化合物1和化合物2属于吗啡烷型生物碱,化合物3属于原阿朴啡型生物碱,化合物4属于苄基四氢异喹啉类生物碱,化合物5、7、8、9、10属于阿朴啡型生物碱,化合物6、11属于原小檗碱型生物碱。化合物2、3、4、7、8、9、10系首次从大花地不容中分离得到。此外对大花地不容块根的总生物碱和主要成分青藤碱进行了体外细胞测试,结果显示总生物碱和青藤碱对肺癌细胞A549均具有一定的细胞毒活性。

