西南地区野生刺梨的遗传多样性和遗传结构研究
吴诗琪, 潘 凤, 赵 财
( 贵州大学 生命科学学院/农业生物工程研究院, 山地植物资源保护与保护种质创新教育部重点实验室, 贵阳 550025 )
随着社会生活质量的不断提高,人们越来越重视食物的营养价值。不仅如此,人类对绿色生活和绿水青山的需求更加迫切,因此需要开发利用更多优质的野生植物资源。刺梨(Rosaroxburghii)为蔷薇科,蔷薇属重要植物资源。原产中国西南部,特别以贵州省资源最为丰富,湖南、湖北、甘肃、陕西和华东有零星分布,是我国特有的果树资源(李楠玉等,2021)。因含有极高的维生素C成分而备受关注,其维生素C的含量比猕猴桃高9倍,被称为 “维C之王”,因此深受消费者青睐。刺梨具有巨大的开发利用价值和经济价值。其果实肉质肥厚且具有浓烈的特殊香气,包含丰富的超氧化物歧化酶、过氧化物酶、多酚、刺梨黄酮、刺梨多糖、刺梨三萜、氨基酸以及微量元素等物质(张怀山等,2017)。同时,刺梨的药用价值高,其花、果、叶和籽均可入药,有清热降火、健胃、消食、滋养、润肺止咳和止泻等效果,尤其是刺梨含有丰富的超氧化物歧化酶,在心血管、消化系统和各种肿瘤疾病等防治方面的应用十分广泛(汪凯莎,2015)。因此,刺梨成为贵州省重点发展的果树行业。随着刺梨利用范围的不断扩展,相关研究也不断丰富,主要集中在化学成分以及药理作用等方面(饶浠锐等,2022)。但是,近年来,新型城市化进程加剧造成的土地侵占,以及土地开垦,农业耕种时的滥砍滥伐等造成的生态损坏和生境破碎化,野生刺梨的种群数量和分布面积呈现下降趋势(李楠玉等,2021)。这一绿色资源并没有得到很好的开发利用,当务之急就是对野生刺梨资源做好收集和遗传背景分析及保护性利用等方面的管理工作(鲁敏等,2020)。
目前,分子标记技术已广泛运用于研究植物的遗传多样性,但刺梨种质资源分子水平的研究起步较晚。文晓鹏和邓秀新(2003)通过形态学性状和RAPD标记探索了刺梨及部分近缘种的亲缘关系,并对不同自然分布区的30个野生刺梨进行遗传多样性分析,结果表明来自贵州的样品蕴藏有最丰富的遗传多样性;鄢秀芹(2015)通过转录组测序获得刺梨大量功能基因组信息,开发了其EST-SSR标记,并利用开发的引物进行刺梨及蔷薇属种质资源的遗传多样性分析;鲁敏等(2017)基于EST-SSR标记构建贵州刺梨核心种质;张怀山(2017)利用SSR标记、ITS序列以及5个叶绿体基因对野生刺梨居群进行遗传结构及遗传多样性分析;鲁敏等(2020)对西南地区12个居群构建刺梨核心种质。综上表明,刺梨起源于西南地区,但遗传背景研究存在所使用标记遗传信息量少,采集样本数量较少,地域性相对狭窄问题,未能详细阐明刺梨的遗传多样性,地理分布格局和起源问题等。
单拷贝基因(scnDNA)是双亲遗传,携带大量的遗传信息,属于直系同源,可以更好地反映物种的进化史(毕毓芳等,2019)。近年来叶绿体基因(cpDNA)逐渐受到广泛应用,其特点是分子量小、序列较为保守、进化迟缓、结构单一、单亲遗传,并且不易受外界环境影响(樊守金和郭秀秀,2022),可以用来揭示物种应对环境变化的进化潜力,对其遗传多样性的保护以及保护计划的制订实施都具有非常重要的价值(刘海瑞等,2018)。将二者结合分析可以更好地开展物种遗传多样性研究,使结果更加准确。
本研究采用2个单拷贝核基因(GAPDH和ncpGS)和进化速率较快的3个叶绿体基因间隔区atpF-trnH、trnL-trnF和trnG-trnS序列结合对分布西南地区的5个省市,27个居群共320个野生刺梨材料进行分析。采用群体遗传学和谱系地理学的研究方法,探讨野生刺梨居群遗传多样性和遗传格局,种群历史动态,并探究野生刺梨的起源演化历史进程,为刺梨的资源保护和遗传育种提供科学参考资料。同时,也为西南地区植物区系演化和物种形成机制研究奠定一定的基础。
1 材料与方法
1.1 实验材料
本研究的320个刺梨材料采自贵州省、四川省、云南省、重庆市和湖北省共5个省市,覆盖了整个西南地区的27个自然居群(表1)。根据当地的分布规模决定居群的样本数量,每个居群采样5~18个不等,单个样本间距离50 m以上(图1)。每株采取新鲜幼嫩的叶片10~20 g,将采集好的叶片就地迅速保存于采集袋中,加入硅胶进行干燥保存,后用于DNA提取。所采集的凭证标本存放于贵州大学生命科学学院中。
1.2 DNA提取、PCR扩增及测序
采用天根生化科技(北京)有限公司的植物基因组DNA试剂盒(DP305)提取刺梨DNA。利用2%琼脂糖凝胶电泳检测DNA是否提取成功。3段叶绿体基因序列(atpF-trnH、trnL-trnF和trnG-trnS)和2段单拷贝核基因(GAPDH和ncpGS)分别通过5段引物进行PCR扩增(表2)。PCR扩增反应为25 μL 体系:2×Taq PCR Master Mix 12.5 μL;上游引物、下游引物和DNA各1 μL;dd H20 9.5 μL。扩增后得到的PCR产物经2%的凝胶电泳检测后将凝胶成像系统上有清晰、明亮条带的样品送往北京擎科生物科技有限公司(重庆分公司)进行纯化及测序。
对于单拷贝核基因ncpGS序列所使用的反应程序:预变性94 ℃ 5 min,变性95 ℃ 45 s,退火51 ℃ 45 s,延伸72 ℃ 2 min,循环34次,最后延伸72 ℃ 10 min,12 ℃恒温保存。GAPDH序列所使用的反应条件:预变性94 ℃ 4 min,变性95 ℃ 50 s,退火57 ℃ 50 s,延伸72 ℃ 2 min,循环34次,最后延伸72 ℃ 10 min,12 ℃恒温保存。对于叶绿体基因atpF-trnH序列所使用的反应程序:预变性94 ℃ 5 min,变性94 ℃ 50 s,退火55 ℃ 50 s,延伸72 ℃ 1 min,循环34次,最后延伸72 ℃ 10 min,12 ℃恒温保存。trnL-trnF序列所使用的反应条件:预变性96 ℃ 5 min,变性94 ℃ 40 s,退火54 ℃ 40 s,延伸72 ℃ 1 min,循环35次,最后延伸72 ℃ 10 min,12 ℃恒温保存。trnG-trnS序列所使用的反应程序:预变性85 ℃ 5 min,变性95 ℃ 1 min,退火54 ℃ 1 min,延伸72 ℃ 2 min,循环34次,最后延伸72 ℃ 10 min,12 ℃恒温保存。
1.3 数据处理与分析
获得测序结果后,用Mega 6软件(Tamura et al., 2013)删掉序列两端不可靠的碱基序列后进行比对,使用BioEdit软件(Ahmed, 2011)查看测序峰图,将序列进行手工校正得到比对好的数据后,利用PhyloSuite软件(Zhang et al., 2020)将两个单拷贝核基因以及3个cpDNA片段分别拼接成一个整体的长片段。采用DnaSP 6软件(Rozas et al., 2017)对27个刺梨居群进行DNA多态性分析,得到相关所示数据,如单倍型数量(H)、单倍型多样性(Hd)、核苷酸多样性(π)、变异位点(Vs)、简约信息位点(Ps)。进行中性检验得到Tajima’sD值和Fu’sFs值,看结果是否符合中性进化模型,从而判断是否曾经发生过扩张现象;以及进行错配分析,观察曲线进一步分析居群是否经历过扩张或瓶颈效应(张晓芸等,2019)。用PERMUTCpSSR软件(Caraux & Pinloche, 2005)计算遗传分化系数NST和GST。利用Arlequin软件(Excoffier & Lischer, 2010)进行分子方差分析(AMOVA),计算刺梨居群内和居群间的遗传变异,并计算遗传分化系数(FST)揭示群体间遗传结构, 基因流(Nm)进一步表明居群的分化水平。利用Mega 6软件(Tamura et al., 2013)计算遗传距离矩阵,利用Network软件(Bandelt et al., 1999)基于简约性原则采用MJ法构建单倍型网络图(潘凤等,2021);用ArcGis软件(张智慧,2017)绘制单倍型在地理上的分布。

图 1 刺梨采样照片Fig. 1 Photos of collected Rosa roxburghii
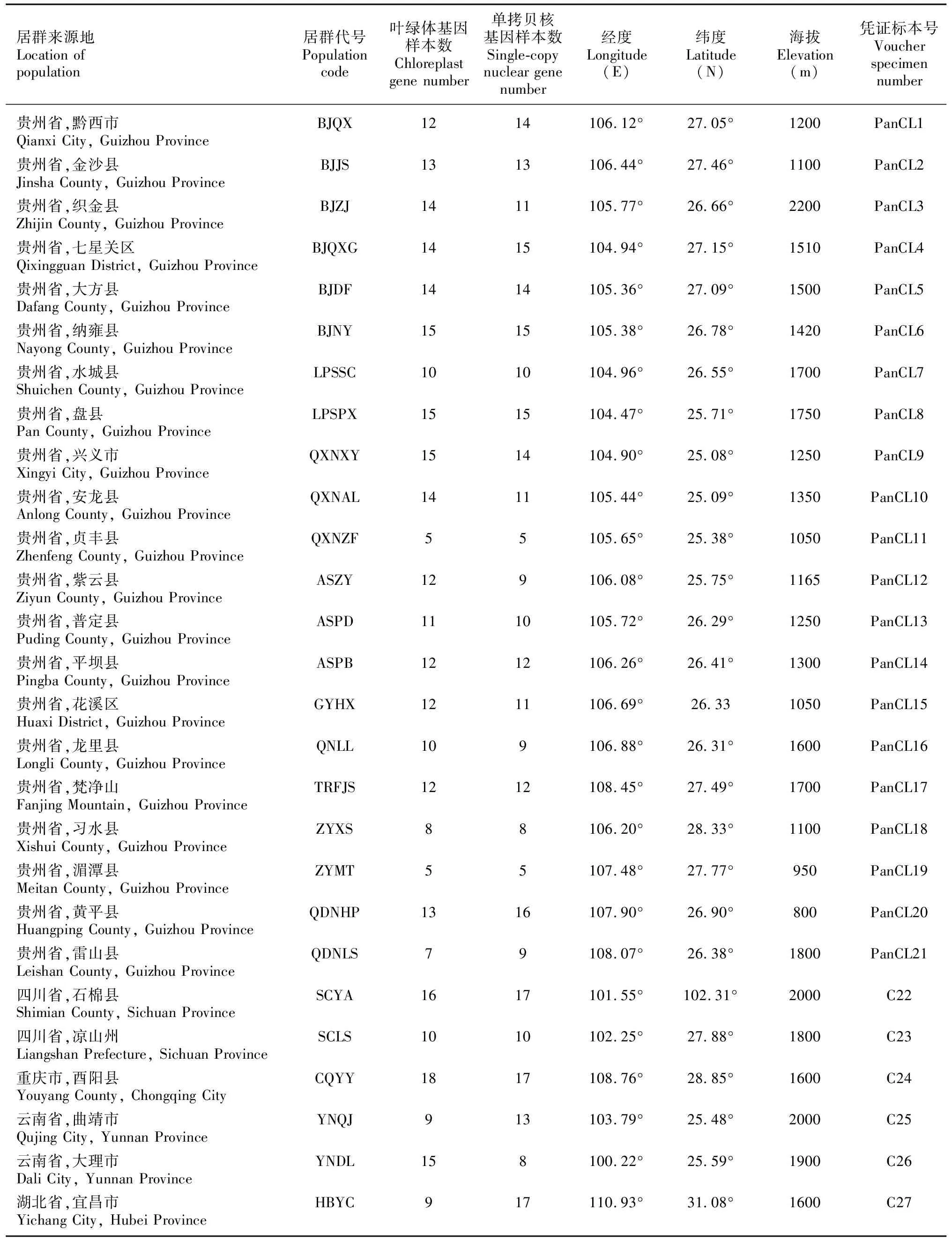
表 1 27个刺梨居群的采集信息Table 1 Collection information of 27 Rosa roxburghii populations

表 2 引物名称、序列及参考文献Table 2 Primer name, sequence and reference
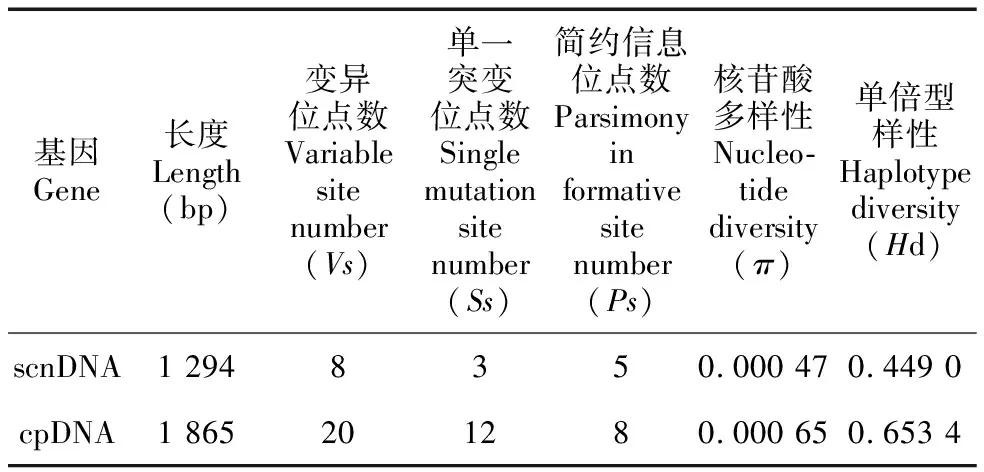
表 3 320个刺梨材料基于单拷贝核基因和叶绿体基因的多态分析Table 3 Polymorphic analysis of single-copy nuclear gene and chloroplast gene in 320 Rosa roxburghii samples
2 结果与分析
2.1 遗传多样性分析
如表3所示,2段单拷贝核基因GAPDH和ncpGS拼接后的总长度为1 294 bp。其中,AT含量为58.88%~59.12%,与GC含量相差不大。共检测到8个核苷酸变异位点,其中简约性的信息位点5个,单一突变位点3个。变异位点分别为107、154、592、1 096、1 131、1 180、1 182和1 225。将序列提交至GeneBank,序列号为OP526995~OP527024。拼接序列检测到15个单倍型。单拷贝核基因拼接序列的遗传多样性水平较低(Hd=0.449 0,π=0.000 47),但不同刺梨居群间存在较大差异(Hd=0~0.800 0,π=0~0.000 84),27个居群中,黔西南贞丰QXNZF居群(Hd=0.800 0,π=0.000 78)、毕节纳雍BJNY居群(Hd=0.714 3,π=0.000 84)和毕节黔西BJQX居群(Hd=0.670 3,π=0.000 84)表现出较高的遗传多样性。遗传多样性水平最低的是云南曲靖YNQJ居群和黔东南雷山QDNLS居群(Hd、π均为0)。
对3段叶绿体基因(atpF-trnH、trnL-trnF和trnG-trnS)序列进行拼接后的总长度为1 865 bp,AT含量为71.92%~72.22%,碱基组成具有明显的A/T偏好性,这与大多数叶绿体基因的碱基组成成分一致。其中,共检测到20个核苷酸变异位点,简约性的信息位点12个,单一突变位点8个。变异位点分别为55、88、142、175、209、344、415、423、430、545、556、573、590、591、656、696、967、1 227、1 592和1 740。将序列提交至GeneBank,序列号为OP526975~OP526994,OP545883~OP545922。拼接序列检测到单倍型数量(H)20个。总体的遗传多样性水平不高(Hd=0.653 4,π=0.000 65),但不同刺梨居群间存在较大差异(Hd=0~0.800 0,π=0~0.001 29),在所有居群中毕节纳雍BJNY居群(Hd=0.800 0,π=0.000 86)、毕节大方BJDF居群(Hd=0.736 3,π=0.000 74)和毕节七星关BJQXG居群(Hd=0.692 3,π=0.001 29)的遗传多样性水平较高。由此可见在西南地区中,毕节地区刺梨的遗传多样性较高,表明该地区野生刺梨的遗传信息较丰富。遗传多样性水平最低的是湖北宜昌HBYC居群和四川凉山SCLS居群(Hd、π均为0)。
2.2 单倍型多样性分析
基于单拷贝核基因的拼接序列,27个居群得到15个单倍型。其中,单倍型R-1分布最广,在所有居群中均有分布,意味着单倍型R-1是主要单倍型,推测R-1为古老单倍型,其次为单倍型R-3,分布在15个群体中,为优势单倍型。安顺平坝ASPB居群和毕节黔西BJQX居群共有单倍型R-7,单倍型R-9为分布在居群毕节纳雍BJNY和铜仁梵净山TRFJS中,毕节纳雍BJNY居群与黔东南黄平QDNHP居群共有单倍型R-12。单倍型R-5只分布在安顺普定ASPD居群中,单倍型R-11只分布在遵义湄潭ZYMT居群中,R-13只分布于黔东南黄平QDNHP居群中,R-15六盘水盘县LPSPX居群中。其余单倍型均分布在多个居群中(表4)。
基于叶绿体基因的拼接序列,在27个刺梨居群中得到20个单倍型,其中单倍型H-1分布最广,在26个居群中广泛分布,意味着单倍型H-1是群体遗传构成的最主要单倍型,推测H-1为古老单倍型;其次是单倍型H-6,在16个居群中广泛分布。单倍型H-4和单倍型H-5均是安顺普定ASPD居群和毕节织金BJZJ居群共有;单倍型H-3只分布在安顺紫云ASZY居群中,毕节七星关BJQXG拥有最多的特有单倍型(H-8、H-10、H-11和H-12,共4个特有单倍型),单倍型H-13分布在遵义湄潭ZYMT居群中,重庆酉阳CQYY居群存在特有单倍型H-14,单倍型H-15只分布在云南大理YNDL居群中,黔东南黄平QDNHP居群存在特有单倍型H-16,单倍型H-17分布在毕节金沙BJJS居群中,单倍型H-18分布在毕节大方BJDF居群中,毕节纳雍BJNY居群存在2个特有单倍型H-19和H-20。其余单倍型均分布在多个居群中(表4)。
基于单拷贝核基因检测到的15个单倍型构建单倍型网络图(图2,图3)。由图2可知,以单倍型R-1为中心向四周发散,与单倍型R-3、R-4、R-6、R-8、R-10和R-13以一种突变步的方式直接相连,又各自发生分化,构成一个四边形。单倍型R-10分化出R-12和R-15分别与R-3和R-8相连。单倍型R-7单独分化出R-2。同时,网状进化图出现多个环状结构,说明核基因重组事件的发生。
基于叶绿体基因所检测到的20个单倍型进行单倍型网络分析(图4,图5)。由图4可知,20个单倍型在单倍型网络构建图中呈散射分布,可分为H-1和H-9两个分支,每个分支又各自分化。一支以单倍型H-1为中心,与单倍型H-3、H-4、H-5、H-7、H-13、H-14和H-16以一种突变步的方式直接相连并聚为一类;另一支以H-9为中心,与H-2、H-6、H-8、H-10、H-11、H-12、H-14、H-15、H-18、H-19和H-20聚类在一起,包括毕节七星关BJQXG、毕节大方BJDF和毕节纳雍BJNY居群的特有单倍型,表明这一支主要以毕节地区为主。特有单倍型主要位于图的外侧,说明是最晚发生突变的单倍型,并且还存在缺失单倍型,可能是未收集到或在进化过程中丢失。
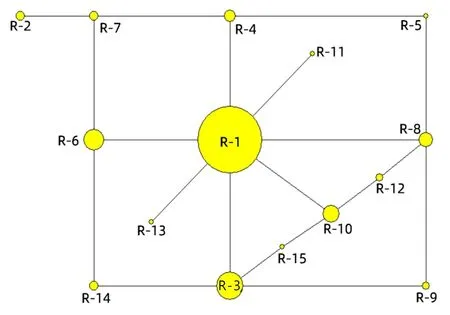
圆圈大小代表频率。下同。Circle size represents frequency. The same below.图 2 基于刺梨单拷贝核基因构建的单倍型网络图Fig.2 Network diagram of Rosa roxburghii single-copy nuclear gene haplotype
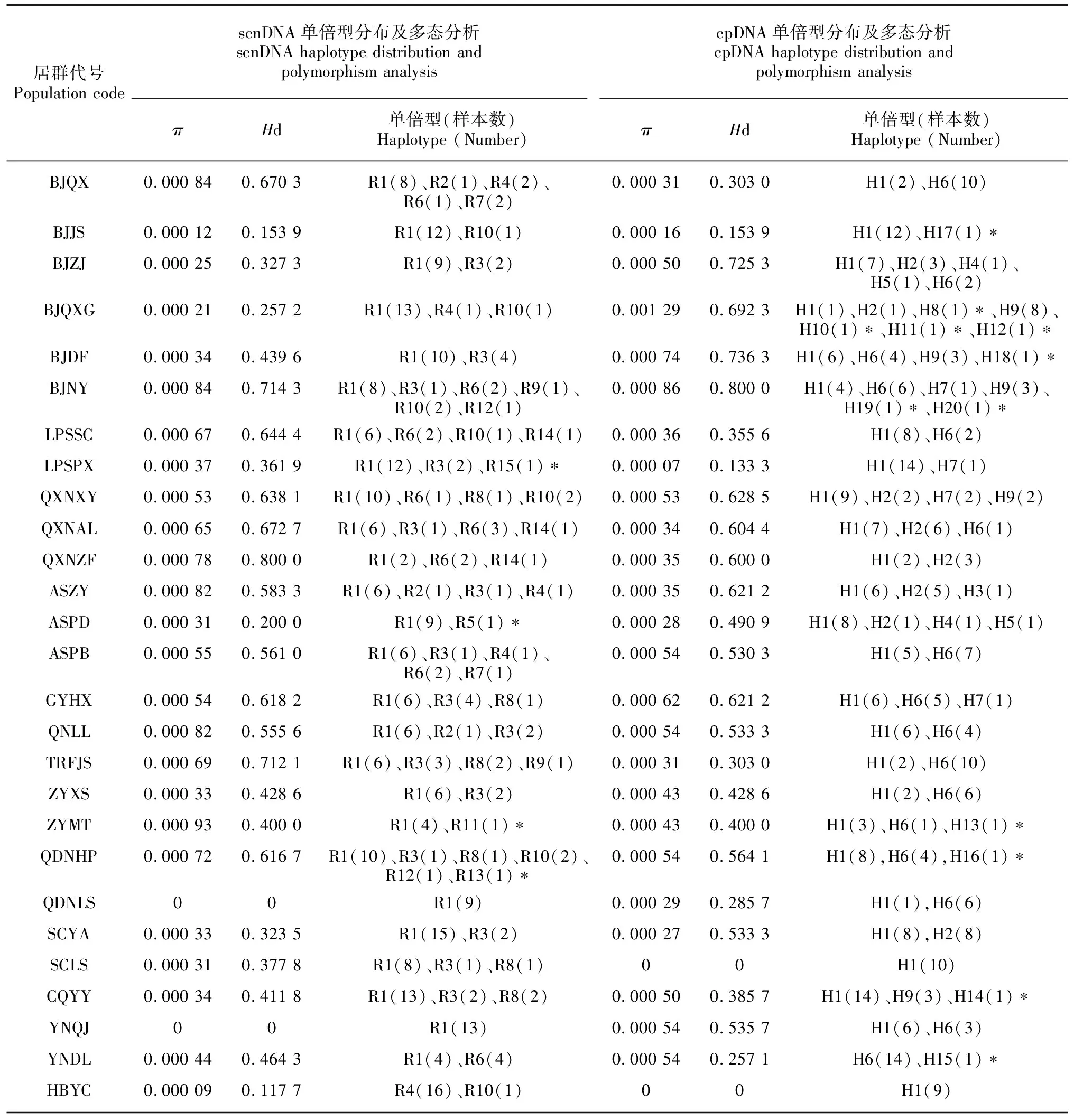
表 4 27个刺梨居群基于单拷贝核基因和叶绿体基因的样品信息、单倍型分布及多态分析Table 4 Collection information, haplotype distribution and polymorphism analysis of 27 Rosa roxburghii populations on single-copy nuclear gene and chloroplast gene
2.3 遗传结构分析
分子方差分析(AMOVA)结果显示(表5),基于单拷贝核基因的27个刺梨居群的遗传变异主要发在居群内(90.51% >>9.49%),遗传分化系数FST为0.094 87 ,基因流为2.44,遗传距离为0~0.004,群体间遗传分化系数为GST= 0.056
利用DnaSP 6软件分别基于单拷贝核基因和叶绿体基因的拼接序列对320个刺梨材料进行中性检测,结果显示,Tajima’sD统计值分别为-1.575 16 (0.01
3 讨论与结论
3.1 刺梨居群的遗传多样性分析
刺梨单拷贝核基因GAPDH和ncpGS联合序列(Hd=0.469 2,π=0.000 49)以及叶绿体基因atpF-trnH、trnL-trnF和trnG-trnS联合序列(Hd=0.653 4,π=0.000 65)的遗传多样性显著低于高源等(2020)采用4段叶绿体拼接序列对苹果属植物的结果(Hd=0.879,π=0.009 52),刘晶(2013)对蔷薇科豆梨(cpDNA:Hd =0.719,π=0.001 05)和川梨(cpDNA:Hd =0.718,π=0.000 85)的结果,同时还低于张怀山(2017)对刺梨cpDNA的研究结果(Hd=0.829,π=0.001 31),但高于其ITS序列的结果(Hd=0.247,π=0.000 40)。本研究结果表明,刺梨具有较低的遗传多样性。西南地区刺梨的遗传多样性偏低,可能与本研究所用3个cpDNA间隔区序列的进化速率有关,选用的叶绿体基因序列较为保守,需要更加精准的结果时则需要结合其他cpDNA间隔区序列(王崇等,2021);也可能是标记的基因、自身属性以及有效群体大小不同等因素所导致。因为野生刺梨在进化过程中由少数种群产生的建立者效应或者近期发生过瓶颈效应,造成遗传变异大量丢失,遗传多样性结果较低(何文等,2014)。刺梨每个居群间的单倍型多样性(Hd)表现不同,推测可能是西南地区的地形十分复杂,使各居群所在的环境条件具有差异,经过长期不同的生态环境和自然选择,会导致具有一定地理隔离的刺梨居群的遗传多样性存在差异。
3.2 刺梨居群的遗传结构分析
种群在进化过程中,遗传漂变、自然选择、种群历史和突变等因素的影响导致其遗传结构产生复杂的构成(任婧等,2019)。通过对单拷贝核基因的研究发现,遗传分化系数较低(FST=0.094 87),遗传系数为NST=0.076 >GST=0.056 (P>0.05),虽然P值显著,但是低于Petit等(2005)总结的基于核基因标记的22种植物的平均遗传分化程度(GST=0.15)。从两个基因的单倍型网络图可以看出,高频率的单倍型分布到多数种群中,存在明显网状结构,但同时各单倍型在种群中交织分布,与种群的地理分布没有明显联系,这也与种群间基因交流广泛,缺乏种群特有的高频率的单倍型有关。此外,刺梨种群的不同居群间出现了大量亲缘关系靠近的单倍型,表明刺梨群体间不存在明显的谱系地理结构。不同于叶绿体基因仅有的母系遗传,核基因还存在花粉流,导致刺梨种群间基因交流更频繁,基因流(Nm=2.44)较高。植物居群间遗传结构存在较大的差异性,主要是地理上的隔离、突变、动荡等环境因素以及基因流的隔离导致居群的遗传分化所致(莫忠妹等,2022)。
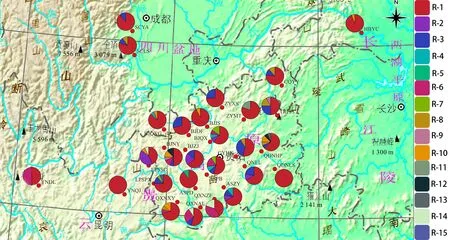
图 3 基于单拷贝核基因构建的单倍型地理分布图Fig. 3 Haplotype geographical distribution map based on single-copy nuclear gene construction of Rosa roxburghii
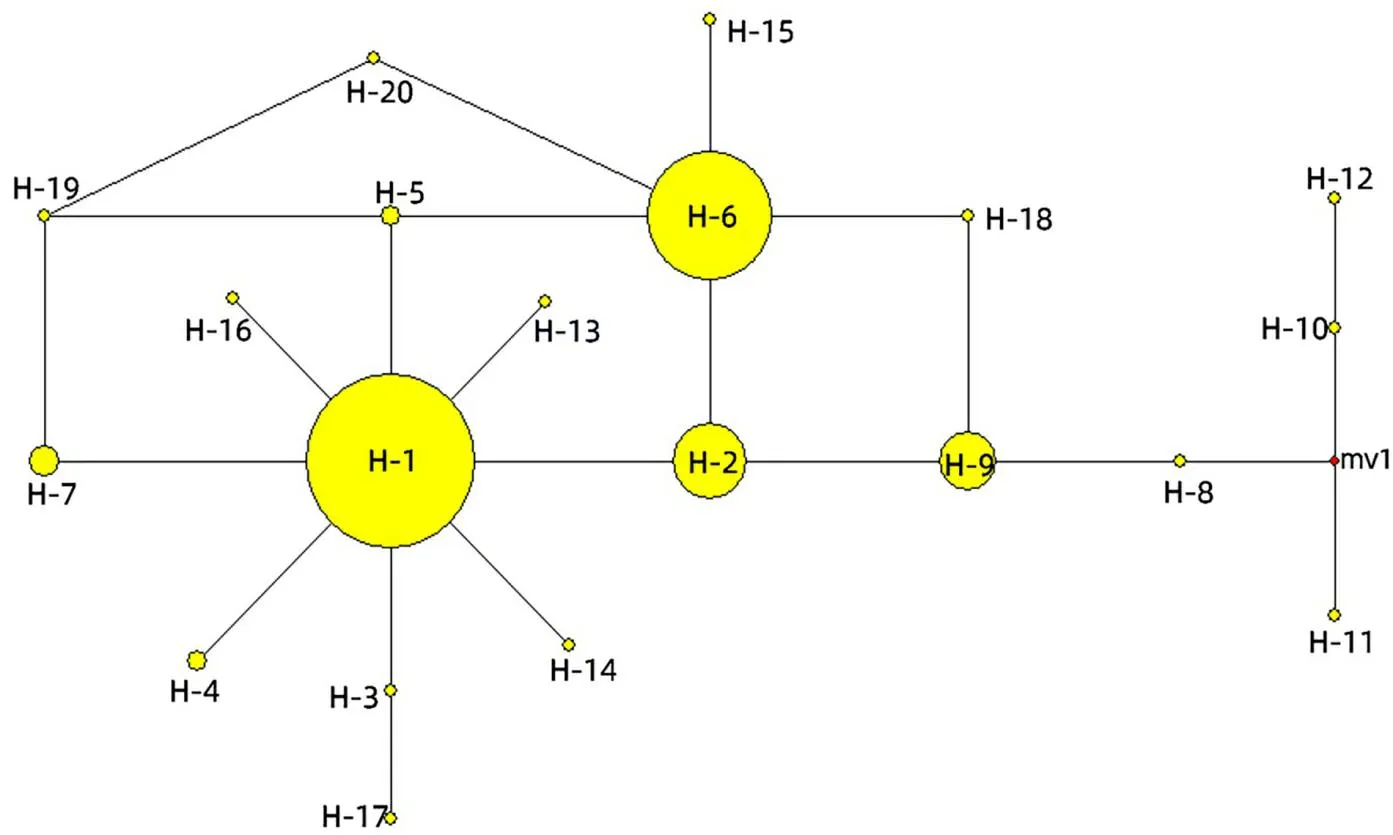
红点表示丢失单倍型; mv后的数字反映两两单倍型之间的突变步数。Red points indicate missing haplotypes; the number after mv reflects the number of mutation steps between haplotypes.图 4 基于刺梨叶绿体基因构建的单倍型网络图Fig. 4 Network diagram of Rosa roxburghii chloroplast gene haplotype
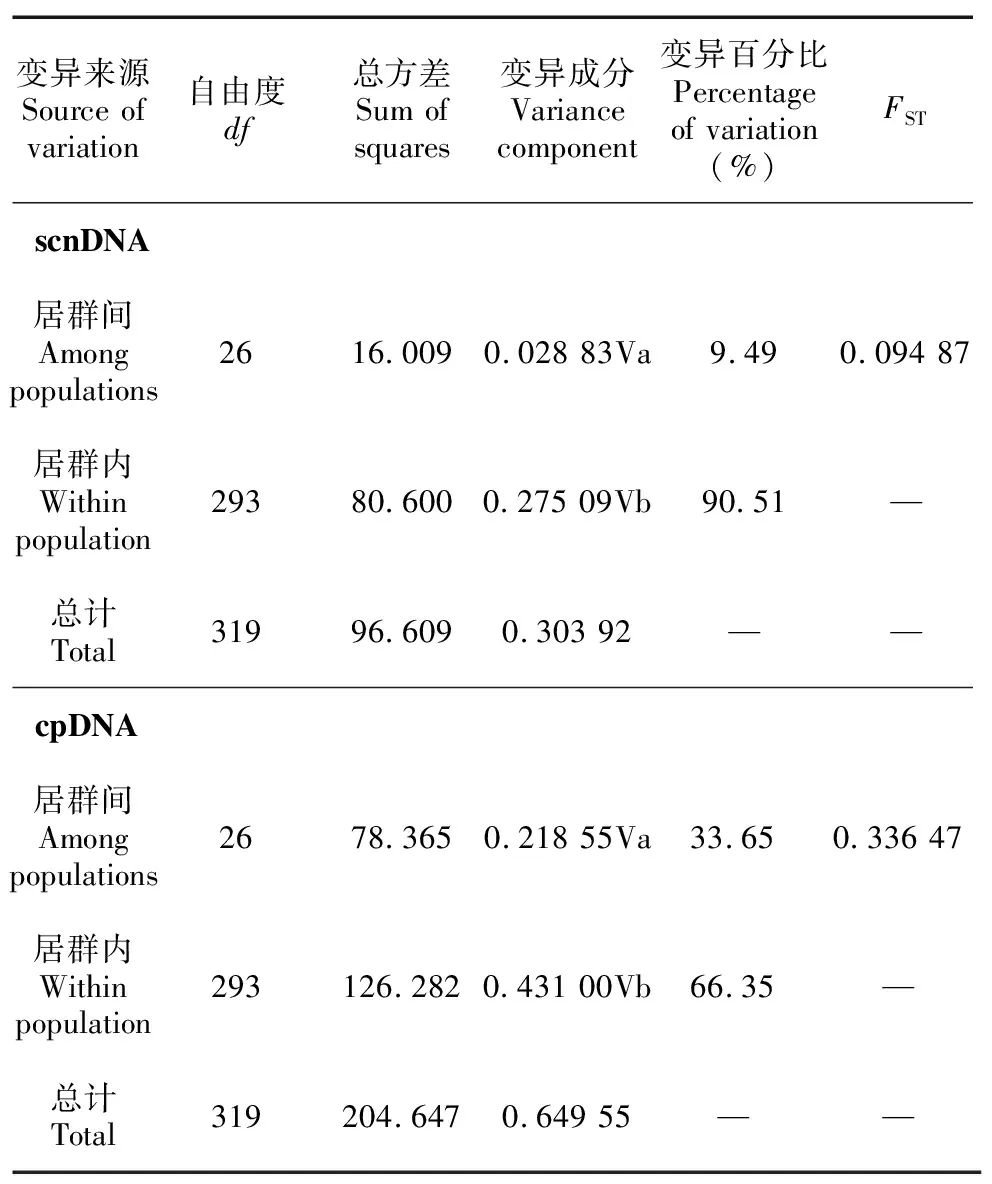
表 5 刺梨种群的分子方差分析Table 5 Analysis of molecular variance in Rosa roxburghii populations
叶绿体基因的居群遗传分化系数为GST= 0.273

图 5 基于刺梨叶绿体基因构建的单倍型地理分布图Fig. 5 Haplotype geographical distribution map based on chloroplast gene construction of Rosa roxburghii
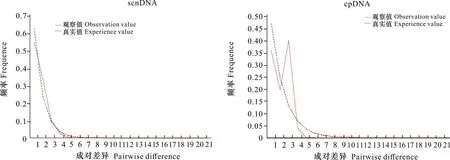
图 6 刺梨种群单拷贝核基因(左)和叶绿体基因(右)的失配分析Fig. 6 Mismatch analysis of Rosa roxburghii single-copy nuclear gene (left) and chloroplast gene (right)
通过AMOVA 分析,结果均显示刺梨种群主要的遗传变异发生于居群内,居群间遗传差异较小,可能是受到奠基者效应的影响。本研究发现核基因的居群内遗传变异(90.51%)高于叶绿体基因的居群内遗传变异(66.35%),推测此结果可能的原因如下:(1)刺梨有自交繁育系统,而叶绿体基因仅有母系遗传;(2)个体间花期不重叠导致居群间的花粉流有限制;(3)地理隔离和人为因素的影响,使刺梨呈现片段化分布;(4)在刺梨历史基因流中,种子流起到最主要的作用。刘慎谔(1985)在河流流向对植物分布的影响中提到,刺梨多分布于四川、贵州,而云南仅大理有分布,推测该物种沿着金沙江古道扩散至大理,表明河流为刺梨物种分布和基因流提供地理便利或通道,而西南地区的高山阻隔在一定程度上阻碍了风媒和虫媒等介导的花粉流,只能在有限范围内进行基因交流。这与张怀山(2017)得到刺梨种子流大于花粉流的结果一致。本研究得出野生刺梨居群遗传结构的主要特点是遗传变异主要发生在居群内,居群间具有基因交流较频繁、遗传距离小等特点,与张怀山(2017)、鲁敏等(2020)以及李楠玉等(2021)的结果一致。
中性检验结果表明,Tajima’sD值均为不显著负值,符合中性进化模型。Fu’sFs值均为显著负值,再结合两个单倍型网络图与错配分布曲线考虑,存在缺失单倍型,说明刺梨居群发生过小范围扩张,但总体上维持稳定状态。根据叶绿体基因和单拷贝核基因的单倍型网络图表示,H-1和R-1的分布范围最广,推测其为古老单倍型。溯祖理论认为在居群中遗传多样性水平最高的区域极有可能是物种的起源中心或冰期避难所(潘凤等,2021)。我们在野外调查时发现西南地区的野生刺梨以贵州省分布最多,其他省市分布较少。在本研究中贵州省内的居群遗传多样性普遍较高,推测刺梨在西南地区的冰期避难所为贵州省,以贵州省为主向四周扩散,扩张时可能由于云贵高原阻断,只能在周围发生小距离扩张,与张怀山(2017)的结论一致。贵州省内遗传多样性较高的居群有毕节地区的居群,黔西南地区的居群和安顺地区的居群,推测在第四纪冰期时期贵州省为主要避难所且贵州省内还存在多个避难所。
3.3 刺梨的保护策略
随着城镇化进程加剧以及自然环境被破坏,为避免刺梨种质资源的大规模遗失,对刺梨资源的收集和保护等方面的工作刻不容缓(鲁敏等,2020)。在西南地区的27个居群中,毕节地区不仅是贵州省的主产地之一,有丰富的刺梨资源,而且遗传多样性水平高,还拥有多个特有单倍型,应进行优先保护,在就地保护的基础上进行种子保存,还可采集特有单倍型居群中的少数个体以及有特殊性状的植株,将其移至资源圃中进行保护(何文等,2014)。研究认为,对种群数量很多且遗传多样性水平较高的居群,特别是毕节地区、安顺平坝ASPB和黔西南贞丰QXNZF等居群,应实施就地保护的策略(鲁敏等,2020),对于拥有独特单倍型的居群,如安顺紫云ASZY、遵义湄潭ZYMT、毕节七星关BJQXG、毕节金沙BJJS、毕节大方BJDF、毕节纳雍BJNY、重庆酉阳CQYY和黔东南黄平QDNHP居群,进行优先保护。由于刺梨主要的遗传变异发生在居群内,而个体维持遗传变异有着重要作用,因此在制定迁地保护策略的同时,应当尽量多保存所收集到的刺梨样品(李楠玉等,2021)。

