甲烷菌甲基辅酶M还原酶非组分蛋白McrD性质初探
高 凤,言 行,王士岩,王殿龙,谭中标,时 号
(淮阴工学院 生命科学与食品工程学院,江苏 淮安 223003)
沼气的成分主要是甲烷(50%~75%)和二氧化碳(25%~50%),在一定的温度、湿度和厌氧条件下,经甲烷菌等厌氧微生物的协同发酵,可以通过畜禽粪便、秸秆和有机废物等产生[1]。沼气既可作为天然气的替代和用于发电,又可作为车用燃料,是一种可再生的清洁能源[2]。此外,沼气是以有机废弃物进行发酵,原料和生产过程均对环境友好[3],同时生产的有机肥料还能降低生产成本[4],因此具有多种环境效益。提高沼气产量的关键因素在于控制沼气生产的原料和影响因素,高产沼气需要丰富的有机物及适宜pH、温度以及足量的菌种等[5-6]。Sygula等[7]用厨余垃圾作为原料厌氧发酵,沼气产量达到了672 mL∕g-vs。Singkhala等[8]将棕榈油厂废水的pH调整为7.5,甲烷产量达到440 mL∕g-vs,是原始的2 倍。Liu 等[9]使用稻草作为底物研究不同温度对甲烷的产量的研究,55 ℃消化的甲烷产量为133.3 L∕kg-vs,比35 ℃的甲烷产量高约20%。此外,使用工业和农业生产的废水厌氧发酵生产沼气仍是世界上最具经济效益且正在使用的一种成熟工艺[10]。Allah 等[11]提出了一种牛粪与碾碎的玉米秸秆厌氧共消化的浮顶式沼气池,甲烷的日产量和累积产量增加了40.3%和42.4%。传统的甲烷升级方法是将二氧化碳去除来提高甲烷的纯度,而通过生物甲基化可以将氢气与二氧化碳进一步处理产生甲烷,因此不去除二氧化碳直接进行沼气升级是一种更有效的沼气利用方法。Stangeland 等[12]发现双金属Ni-Ru∕Al2O3在350 ℃时二氧化碳转化率为82%,甲烷的选择性为100%,添加少量的Ru 具有促进作用。Jonson[13]通过研究直接在滴流床系统中接种富含产氢产甲烷菌和生物膜固定化的方法,发现在高温下甲烷的纯度可以达到98%。
随着生物技术和生物信息学的发展,研究人员逐步解析了甲烷的代谢通路,它是由产甲烷古菌通过代谢将乙酸、甲基化合物和CO2∕H2等转化为甲烷[14]。甲烷的厌氧氧化在100 多年前首次发现[15],截至目前,产甲烷有关的许多酶已被鉴定和进行了生理生化表征[16]。甲烷菌的甲基辅酶M还原酶(Methyl-coenzyme M reductase,MCR)分别催化了甲烷化的最后一步和甲烷厌氧氧化的第一步,是甲烷产生和氧化的关键酶[17]。mcr操纵子是由mcrA、mcrB、mcrC、mcrD、mcrG 五个基因组成的基因簇,产物MCR 是一种(αβγ)2多酶复合体,其催化中心含有镍卟啉F430辅酶因子[18]。MCR的α-、β-和γ-亚基分别由mcrA、mcrB和mcrG基因编码[19],而mcrC和mcrD功能未知[20]。Prakash等[21]通过研究A3a 蛋白发现mcrC 基因产物可能在MCR 的激活中发挥作用。目前,科研人员推测mcrD基因产物有可能以类似于伴侣蛋白参与MCR组装,或者可以直接或间接调节MCR 活性[22-23]。但是,McrD如何发挥作用,其作用机制有待解析。借助X 射线技术对McrD 与相关复合物的三维结构进行研究,有望解析McrD结构和功能[24]。但是,X射线技术获取蛋白晶体结构的制约因子在于高质量的蛋白质晶体,只有获得高质量蛋白质晶体才能得到理想的衍射数据,进而通过软件解析蛋白结构和分析蛋白质功能。
本研究借助生物信息学相关知识,选择了11个不同来源甲烷菌的mcrD 基因在E.coli BL21(DE3)中进行异源表达、纯化并进行结晶,并通过生物信息学分析其潜在的关系和功能,旨在获得McrD 的蛋白质晶体,为McrD 结构和功能的解析提供理论依据进而提高畜禽粪便、农林废弃物、有机废水等资源转化制备甲烷的效率。
1 材料与方法
1.1 实验菌株与培养基
借助NCBI网站确定需要研究的McrD蛋白质氨基酸序列,由金斯瑞生物科技有限公司合成且连接至pET-20b载体。E.coli BL21(DE3)、E.coli DH5α 感受态细胞均为实验室保存。
Luria-Bertani(LB)液体培养基:氯化钠10 g∕L,胰蛋白胨10 g∕L,酵母提取物5 g∕L。LB固体培养基:氯化钠10 g∕L,胰蛋白胨10 g∕L,酵母提取物5 g∕L,琼脂粉15 g∕L,灭菌后冷却至50 ℃时加入氨苄青霉素,混匀后倒入培养皿于4 ℃冰箱保存。
1.2 实验试剂
咪唑、过硫酸铵、三羟甲基氨基甲烷、无水乙醇、盐酸、冰醋酸、氯化钠、氯化镁、考马斯亮蓝R-250 均购自国药集团。氨苄青霉素、二硫苏糖醇、四甲基乙二胺、isopropylβ-D-thiogalactoside(IPTG)、硫代半乳糖苷、30%丙烯酰胺、dithiothreitol(DTT)、蛋白质浓度试剂盒购自生工生物工程上海有限公司。蛋白质晶体生长试剂盒:Index1-96、Crystal Screen(Ⅰ、Ⅱ)、PEG∕ION(Ⅰ、Ⅱ)均购自Hampton Research公司。
1.3 生物信息学分析
首先,借助XtalPred-RF 在线网站初步推测McrD 相关理化性质,进行初步筛选。然后使用SnapGene 软件对氨基酸序列分析和比对,排除一些相似度过高的序列,筛选出11 个不同来源的McrD 蛋白质氨基酸序列(见表1)。通过MEGA7对11 种氨基酸序列进行比对和系统发育分析,并通过AlphaFold 2对McrD的结构进行同源建模。
表1 11个来源不同的McrD氨基酸序列号
1.4 McrD表达、纯化和纯度测定
将合成的11 种mcrD 基因重组载体转化至E.coli BL21(DE3)感受态细胞,用氨苄青霉素筛选阳性转化子,在含氨苄青霉素的液体LB中培养筛选出的阳性转化子。将种子液转至大锥形瓶培养4 h 后使用冰浴快速降温至16 ℃,加入终浓度为0.1 mmol∕L 的IPTG 诱导培养16 h。因为McrD 来源于厌氧古细菌,为了防止氨基酸氧化,加入终浓度为1 mmol∕L的DTT维持还原性环境。培养结束后,取适量菌液,于4 ℃、5 000 r∕min 离心10 min,然后倒弃上清液,使用裂解缓冲液洗涤沉淀的菌体3次,然后将菌体重悬于裂解缓冲液中。接着冰浴超声波225 W破碎40 min,超声2 s间隔8 s。破碎后的溶液于4 ℃、10 000 r∕min离心40 min,缓慢倒出上清后使用镍柱亲和层析法进行纯化。
通过镍柱亲和层析法得到的蛋白质,其纯净度达不到结晶所需的程度,需要进一步纯化。选择阴离子交换层析是因为在pH 7.4的缓冲液中等电点为5.4 的蛋白质表面带负电荷[25]。为探究McrD蛋白质在天然状态下的聚集情况,本研究通过Superdex 200 increase 10∕300 GL凝胶排阻色谱测定McrD实际分子量。最后,使用SDS-PAGE来鉴定McrD蛋白纯度。
1.5 蛋白质结晶
本研究选用Pre-Crystallization Test试剂盒进行蛋白质浓度初步筛选。依次将200 μL蛋白质晶体生长试剂Index 1-96、Crystal Screen(Ⅰ、Ⅱ)、PEG∕ION(Ⅰ、Ⅱ)加入16孔结晶板内,然后取1 μL的蛋白质溶液与1 μL池液在盖板上充分混合,在孔边缘涂上真空硅脂,之后在结晶池上方放置倒扣的结晶板并检查密封性。48 h后检查晶体生长情况。若生长情况未达到预期目标,可以适当延长晶体培养时间。
2 结果与分析
2.1 11种来源的McrD蛋白质序列分析
如图1 所示,McrDform与McrDcat隶属于MCR I,McrDfor、McrDign和McrDthm隶 属 于MCR II,McrDmar、McrDoki、McrDkep和McrDthe隶属于MCR Ⅲ。其中,McrDthm与McrDkep和McrDthe虽为邻近分支但属于不同类型的同工酶,McrDhar与其他不同属来源的蛋白质相比差异较大。图2 为11 个McrD 蛋白质氨基酸序列对比图,从图2 中颜色深浅可以看出McrD蛋白保守程度比较高,只是在部分片段存在不同。

图1 使用NJ法制作11个McrD蛋白质的系统进化树

图2 不同来源的11个McrD蛋白质氨基酸比对图
2.2 McrD的氨基酸分布与二级结构
借助在线网站(https:∕∕www.expasy.org∕resources∕protparam)预测蛋白质的基本性质作为蛋白质提纯过程的重要依据。以McrDign为例,图3为在线网 站(https:∕∕www.novopro.cn∕tools∕secondary-structure-prediction.html)预测的蛋白质二级结构,McrDign蛋 白 质 由7 个Helix,11 个Strand 和18 个Coil 构成。与其他McrD 相比,虽然部分结构存在有所伸长或缩短的差异,但二级结构框架是相同的,其数量与组合方式也基本不变,再次证明McrD在进化上的保守性。

图3 McrDign的二级结构示意图
2.3 McrD的三维结构模拟
图4为借助AlphaFold 2模拟的蛋白质三级结构示意图,其中,图4(A)为单体结构示意图,图4(B)为二聚体结构示意图。从图4(B)中可以看出McrDign的二聚体是由两个单体互相交叉连接形成了一个形似瓶塞的结构,推测可能与McrD亚基功能相关[26]。
2.4 不同来源的11个McrD蛋白质的表达、纯化与结晶
本研究对11个McrD蛋白进行表达,结果如图5 所示,因McrDthe、McrDthm、McrDsmi蛋白形成包涵体,不论是优化表达条件还是优化密码子都无法得到可溶性蛋白,所以在上清中几乎不存在目的蛋白质,因此相应泳道几乎没有条带。在对McrD蛋白质进行第二次纯化时,选择在洗脱曲线最高峰及两侧对称区间的蛋白质溶液可以确保收集到的蛋白质的性质稳定且均一。分子筛测定分子量结果表明,McrDmar和McrDign蛋白质在天然状态下均以二聚体形式存在。

图5 McrD 蛋白质镍柱纯化SDS-PAGE电泳图
由于McrDthm、McrDsmi和McrDthe蛋白质为包涵体,因此放弃对这3 个蛋白进行晶体培养,只对剩余8 个蛋白质进行初步结晶。蛋白质筛选的初筛结果与推荐操作具体见表2。最后获得了McrDign、McrDform两个蛋白质晶体(见图6),得到的两个蛋白晶体主要为针状以及少量片状晶体,晶体培养条件需要进一步优化。
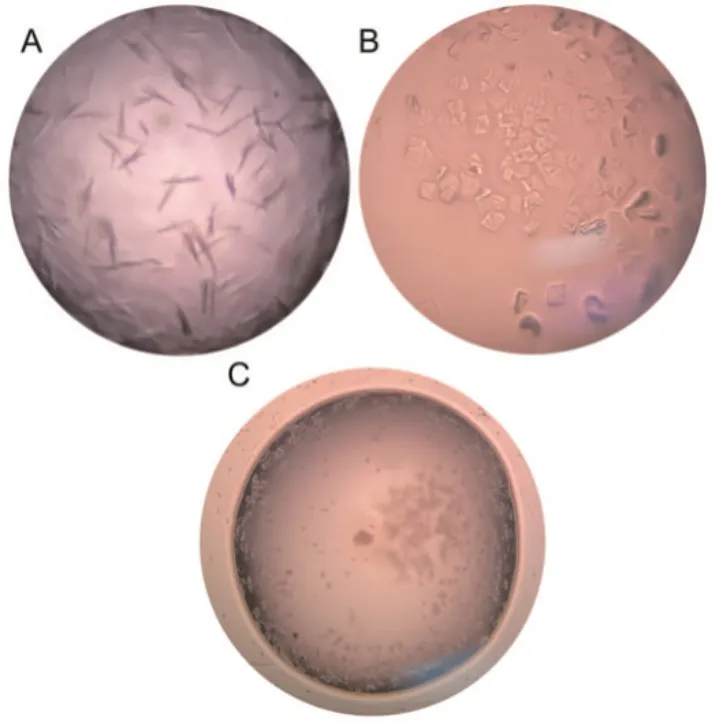
图6 McrDign(A、B)与McrDform的晶体图片(C)

表2 蛋白浓度筛选与推荐操作
2.5 McrD结晶条件优化
上述得到的晶体未能达到预期目标,因此选用PEG∕ION Screen 13、PEG∕ION Screen 7、PEG∕ION Screen 22、Index 38、Index 61 对上述McrDign进行进一步晶体培养条件优化,得到优化的培养条件为:27%PEG 3350、0.29 mol∕L CaCl2和4.4 mg∕mL初始蛋白质浓度。与图6结果相比,蛋白质液滴内的沉淀变少,晶体质量明显得到提升(图7A)。
随后,用4:1(v∕v)PEG∕ION Screen 7进行进一步优化,培养14 d后得到如图7B的质量更好的片状晶体,该片状晶体已达到X 衍射所要求的质量标准。
3 讨论
MCR 可分为MCR Ⅰ、MCR Ⅱ和MCR Ⅲ三类同工酶[18,27],三者来自同一祖先,故整体结构高度相似,但蛋白质表面存在明显的差异。部分产甲烷菌含有MCR Ⅰ和MCR Ⅱ两种同工酶,如来源于M.formicicum Mb9的McrDfor和McrDform分别隶属于MCR Ⅱ和MCR Ⅰ,其结构具有60%~70%的相似性[25]。 MCR I和MCR III大多含有mcrBDCGA 完整的基因簇,部分MCR II 在进化过程中丢失了mcrC 基因,可推测在进化过程中MCR I分化形成MCR III且部分MCR III在分化为MCR II进化过程中丢失了mcrC 基因,该推测与进化树表观一致。McrD在进化上高度保守,与Rospert等[28]发现McrD旁系同源基因保守的结果相符,推测McrD蛋白质具有重要的功能。此外,现有的研究表明因其所处的高度厌氧的生理环境使McrD 具备了较高的还原性[29]。Lyu 等[26]的研究表明MCR 各亚基是按一定顺序进行组装。在此基础上,本研究认为McrD 的二聚体中的瓶塞结构可以防止McrA折叠并促进McrA、McrB和McrG结合,此功能与分子伴侣的性质相似。MCR作为(αβγ)2杂合六聚体蛋白复合物,含有两个活性位点通道,每个活性位点都含有辅酶F430[30]。本研究推测McrD 二聚体可以与游离的F430暂时结合并将F430运输至MCR中心位置,使F430嵌入通道底部。最后,McrD 脱离杂合六聚体蛋白复合物[31]。Sherf等[32]发现在Methanococcus vannielii 中的McrD 基因产物不存在基于酶活性纯化的MCR 和通过天然凝胶电泳分离的MCR 全酶中,但没有活性的MCR 存在McrD 的基因产物,这与Lyu等[27]推测McrD在参与MCR组装完成后丢失的结论相符。本研究暂未获得高质量的用于X衍射的蛋白质晶体,然而国际上目前还没有该蛋白结构的任何相关报道。因此,本研究为获得高质量McrD蛋白晶体以及McrD的结构和功能解析提供了重要的实践基础。
综上所述,本研究通过生物学信息学分析McrD 序列,发现McrD 在进化过程中高度保守且具有重要功能,三维结构模型显示McrD可能具有分子伴侣的功能。本研究异源表达了11个不同来源的表达McrD,得到其中8种可溶性重组蛋白,并用亲和层析和阴离子交换柱进行了纯化,结果表明McrD 天然状态下以二聚体形式存在。McrDign和McrDfor两种蛋白质结晶是通过晶体培养试剂盒优化培养条件后初步获得的,经过进一步的条件优化后得到的McrDign蛋白质晶体达到了X晶体衍射所需,该研究成果为探索McrD的功能作用提供了重要的理论和实践基础。此外,本研究在提倡绿色低碳生产的大背景下对碳中和、节能减排等方面都具有重要现实意义。

