裸燕麦中非淀粉多糖对淀粉体外消化特性的影响
秦 琳, 李 曦, 赵 珊, 黄世群, 雷欣宇,郑幸果, 靳可婷, 刘龙龙, 仲伶俐
(四川省农业科学院农业质量标准与检测技术研究所1,成都 610066)
(山西农业大学农业基因资源研究中心2,太原 030031)
裸燕麦(Avenanuda)属禾本科燕麦属,是我国主要种植的燕麦类型[1]。裸燕麦富含膳食纤维、蛋白质和不饱和脂肪酸等,其中膳食纤维质量分数为13.6%~30.2%[2],主要组成成分是其胚乳和糊粉层细胞壁中的非淀粉多糖(NSP),此外还有少量的木质素和抗性淀粉(RS)等,具有调节血脂、降低餐后血糖及促进肠道蠕动等重要的生理功效[3,4]。裸燕麦胚乳细胞壁中的NSP是由若干单糖通过糖苷键连接形成的多聚糖[5],主要包括果胶、半纤维素、纤维素及少量β-葡聚糖[6,7]等。还有大部分β-葡聚糖和部分半纤维素(阿拉伯木聚糖)集中在裸燕麦籽粒的糊粉层和种皮,是构成糊粉层和种皮细胞壁的结构多糖[8]。
根据非淀粉多糖组分溶解于水的能力可将其分为可溶性和不溶性型[9]。相比较而言,可溶性非淀粉多糖具有更强的生理活性和保健功能[10]。营养学研究表明,血糖与肥胖、心血管疾病及Ⅱ型糖尿病的发病机理密切相关[11-13]。血糖反应很大程度上取决于淀粉的消化速率,而非淀粉多糖是影响淀粉消化速率的重要内在因素[14]。淀粉是裸燕麦籽粒中最主要的碳水化合物,其中,快消化淀粉(RDS)含量高会导致血糖水平迅速升高,而RS能稳定葡萄糖的代谢[15]。已有研究表明,摄入非淀粉多糖可通过体系黏度效应抑制葡萄糖吸收或物理屏障来抑制淀粉酶消化降低淀粉消化速率,使餐后血糖降低24%[16-19]。膳食干预实验[20]和体内实验[17,21,22]表明,摄入β-葡聚糖、果胶和RS可增加胃内容物的黏度,使得胃排空时间延长,淀粉消化和葡萄糖吸收速率降低,从而使得血糖和胆固醇浓度发生改变。目前,非淀粉多糖对裸燕麦淀粉消化特性影响的研究多是通过外源添加来实现的,鲜有对比裸燕麦内源非淀粉多糖对其消化特征的影响的报道。研究拟选取8个主栽裸燕麦品种为研究对象,对其淀粉组成和非淀粉多糖组分含量进行分析,通过体外消化模拟实验研究非淀粉多糖组分对不同品种裸燕麦淀粉消化特性的影响,为选育优质燕麦品种和杂交组以及燕麦进一步的深加工提供参考。
1 材料与方法
1.1 材料与试剂
实验材料为白燕2号、晋燕8号、晋燕17号、晋燕18号、吕燕4号、魏都莜5号、张莜9号、坝莜13号裸燕麦品种,由山西农业大学农业基因资源研究中心提供。裸燕麦籽粒经除杂、清洗和晾晒后粉碎,过60目筛,所得燕麦粉密封4 ℃保存。
Megazyme β-葡聚糖、Megazyme抗性淀粉和Megazyme膳食纤维测定试剂盒;半纤维素酶(3 000 U/g)、纤维素酶(≥1 000 U/g)、果胶酶(4 209U/mL)、2-(N-吗啉代)乙烷磺酸、三羟甲基氨基甲烷、顺丁烯二酸钠、咔唑、醋酸钠、氢氧化钾、乙醇、苯酚、硫酸,均为分析纯。半乳糖、棉籽糖和水苏糖标准品,纯度≥97%。
1.2 仪器与设备
FSJ-Ⅱ型锤片式粮食粉碎机,D3204R型高速离心机,Neofuge 18R型多功能冷冻离心机,数显水浴锅,SHA-CA型水浴恒温振荡器,SX2-5-12Z型箱式电阻炉,SFG型电热恒温鼓风干燥箱,Waters e2695高效液相色谱仪,Varioskan Flash型多功能酶标仪,rapid MAX N EXCEED型元素分析仪,FOSS 8200半自动凯氏定氮仪,消化炉。
1.3 实验方法
1.3.1 总淀粉(TS)、抗性淀粉(RS)和直链淀粉含量的测定
总淀粉含量测定参考García-Alonso等[23]的方法。淀粉质量分数=葡萄糖含量×0.9×100%。分别按照NY/T 2638—2014和NY/T 55—1987标准方法测定燕麦粉中抗性淀粉和直链淀粉含量。按NY/T 2638—2014标准方法进行酶解和消化,消化16 h后去除缓冲液,用80%乙醇洗净残渣,50 ℃烘干后,4 ℃密封保存作为消化后残渣备用。干燥残渣/燕麦粉干重得消化残渣质量分数。
1.3.2 总膳食纤维(TDF)和β-葡聚糖含量测定
按照GB 5009.88—2014标准方法测定燕麦粉中DF含量,总膳食纤维含量TDF=DF+单体成分(RS)。按照NY/T 2006—2011标准方法测定燕麦粉中β-葡聚糖含量。
1.3.3 果胶、半纤维素和纤维素含量的测定
参考孙健[24]的方法测定果胶、半纤维素和纤维素含量。称取10 mg消化残渣,加入草酸缓冲液(0.25%,pH 4.6),85 ℃水浴1 h,10 000 r/min离心5 min,取出适量上清液,加入浓硫酸和咔唑甲醇溶液,沸水浴20 min后,于525 nm处比色,以半乳糖醛酸含量计算果胶含量。
用草酸缓冲溶液(0.25%,pH 4.6)和乙醇将提取果胶后的沉淀洗净后低温烘干。加入4 mL KOH(含质量分数1% NaBH4,4 mol/L)溶液,室温下避光反应18 h,8 000 r/min离心10 min。取出适量上清液,加入浓硫酸和苯酚,反应30 min后,于480 nm处比色,以葡萄糖醛酸含量计算半纤维素含量。将测过半纤维素的沉淀洗净干燥,同样用硫酸苯酚法测定纤维素含量。
1.3.4 燕麦粉离体动态消化
称取50 mg的燕麦粉,置于50 mL离心管中,分别加入2 mL 含220 UI果胶酶(A)、2 UI半纤维素酶(B)和20 UI纤维素酶(C)的醋酸缓冲溶液(pH 5.2,0.1 mol/L)对样品进行酶解,另外用2 mL醋酸缓冲溶液(pH 5.2,0.1 mol/L)作对照,于37 ℃、160 r/min水浴摇床反应40 min后,沸水浴20 min停止反应。而后参考Gońi等[25]的方法测定燕麦粉离体动态消化特征。每隔30 min取1 mL酶解液置于试管中(至180 min时结束),用GOPOD试剂检测葡萄糖含量(Gt),按Gt×0.9表示淀粉含量。水解率=葡萄糖含量×0.9×100%/总淀粉含量。分别以淀粉水解率和时间为纵坐标和横坐标绘制水解曲线。
1.3.5 快消化淀粉(RDS)、慢消化淀粉(SDS)和抗性淀粉(RS)的测定
称取50 mg的燕麦粉于50 mL离心管中,分别加入2 mL 含220 UI果胶酶(A)、2 UI半纤维素酶(B)和20 UI纤维素酶(C)的醋酸缓冲液(pH 5.2,0.1 mol/L)对样品进行酶解,另外用2 mL醋酸缓冲液(pH 5.2,0.1 mol/L)作对照,于37 ℃、160 r/min水浴摇床反应40 min后,沸水浴20 min停止反应。样品快消化淀粉参考Ao等[26]方法测定,分别于20、120 min取2×0.5 mL 酶解液于试管中,用GOPOD试剂检测葡萄糖含量(Gt),按Gt×0.9表示淀粉含量。总淀粉含量测定见1.3.1,均为干基结果。RDS、SDS和RS计算公式为:
RDS=(G20-FG)×0.9TS×100%
SDS=(G120-G20)×0.9TS×100%
RS=100%-RDS-SDS
式中:FG指游离的葡萄糖质量;G20是指酶解20 min后水解出的葡萄糖质量;G120指酶解120 min后水解出的葡萄糖质量。
1.4 数据处理
每个样品平行测定3次,数据采用SPSS 22.0进行方差分析,结果以平均值±标准差表示,不同小写字母表示差异显著(P<0.05);用Origin 2021对数据作图分析。
2 结果与分析
2.1 裸燕麦籽粒的淀粉组成分析
由表1可知,不同品种间裸燕麦总淀粉、抗性淀粉和直链淀粉含量存在显著性差异(P<0.05)。8个裸燕麦品种总淀粉质量分数为56.78%~64.81%,吕燕4号淀粉最高,坝莜13号最低,略高于采用GB 5009.5—2016标准方法测定的结果(51.83%~60.31%)[27];总淀粉质量分数平均值为60.13%,略高于郑建梅等[28]研究中裸燕麦的淀粉质量分数平均值(55.23%)。抗性淀粉质量分数平均值为0.13%,低于郑建梅等[28]的研究结果(0.16%),这可能是因为抗性淀粉含量过低,实验室间相同方法存在测定误差;抗性淀粉质量分数高于0.20%的品种有2个,分别为晋燕8号和魏都莜5号,且晋燕8号抗性淀粉占总淀粉的比例最高(0.45%)。直链淀粉质量分数变幅为14.94%~17.62%,魏都莜5号直链淀粉占总淀粉的比例最高(27.99%)。8个品种燕麦的淀粉水解率有显著性差异(P<0.05),由高到低依次是晋燕8号>吕燕4号>晋燕18号>张莜9号>白燕2号>晋燕17号>魏都莜5号>坝莜13号。
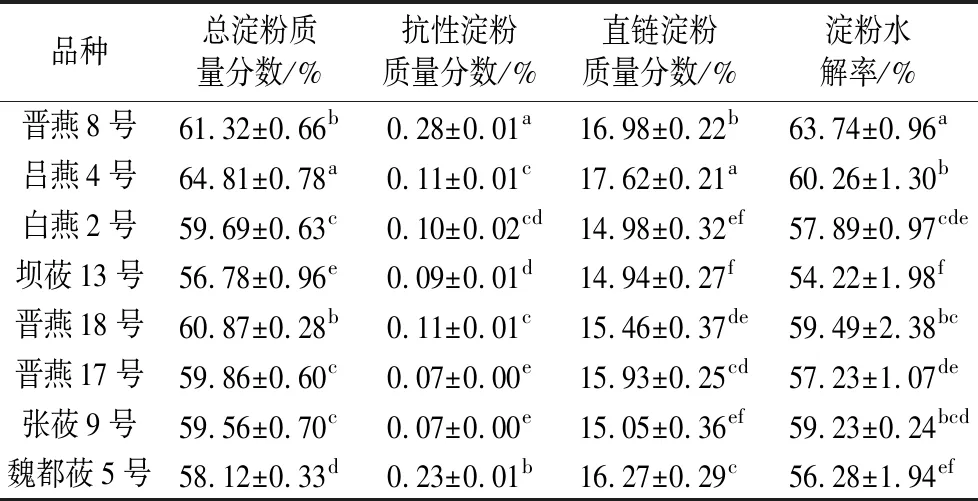
表1 不同品种裸燕麦淀粉组分质量分数(n=3,干基)
2.2 裸燕麦籽粒的非淀粉多糖组成含量分析
由表2可知,不同品种间裸燕麦非淀粉多糖组成含量均存在显著性差异(P<0.05)。总膳食纤维质量分数范围为8.65%~13.02%,魏都莜5号含量最高,吕燕4号含量最低。β-葡聚糖质量分数在3.43%~5.78%之间,与以往的研究结果(3.64%~5.49%)[29]基本一致;平均值为4.81%,占非淀粉多糖(β-葡聚糖、半纤维素、纤维素和果胶之和)的比例为46.3%,高于水稻(20%)[30,31]和小麦(22%)[32,33]。半纤维素质量分数平均值为4.55%,占非淀粉多糖的比例为43.3%,低于小麦(78%)[32,33],高于藜麦(41%)[34]。果胶和纤维素质量分数平均值分别为0.80%和0.28%。半纤维素和β-葡聚糖是裸燕麦非淀粉多糖的主要组成部分,与大多数谷物的结论一致。
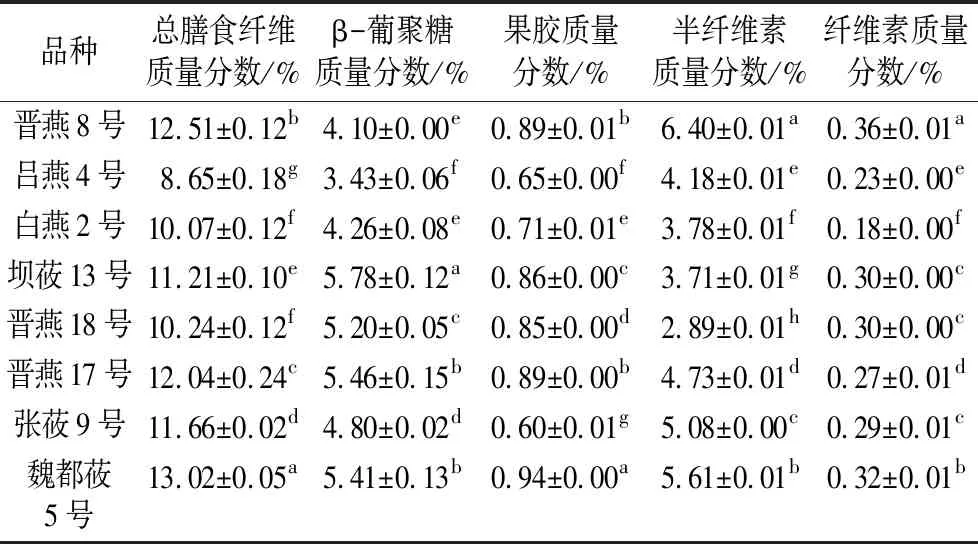
表2 不同品种裸燕麦非淀粉多糖组分含量(n=3)
2.3 各指标间的相关性分析
由表3可知,总淀粉含量与直链淀粉含量呈显著正相关(P<0.05),与β-葡聚糖含量呈显著负相关(P<0.05)。淀粉水解率与总淀粉含量呈显著正相关,与β-葡聚糖含量呈显著负相关,与直链淀粉、抗性淀粉、半纤维素和纤维素含量呈正相关,与果胶含量呈负相关。与以往研究中非淀粉多糖和抗性淀粉两者均与淀粉水解率呈负相关这一规律存在差异,分析原因可能是抗性淀粉含量高的水稻品种,其淀粉离体消化速率显著低于野生型品种[35,36]。但本研究中裸燕麦抗性淀粉质量分数过低(0.133%),对于淀粉的离体消化的影响较小,再加之测定存在误差,最终表现出正相关。影响淀粉水解率的内在因素较多,如淀粉颗粒的形状大小和结构特点、直链淀粉-支链淀粉的比率、自身淀粉酶抑制剂和非淀粉多糖组分含量等,仅靠指标间的相关性无法说明非淀粉多糖对淀粉消化率的影响作用。
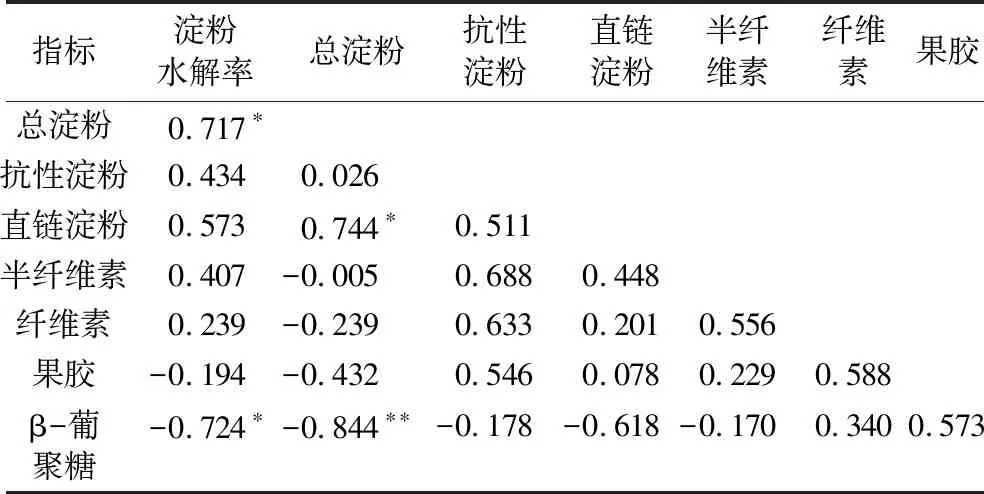
表3 各指标间的相关系数
2.4 果胶、半纤维素和纤维素酶解后裸燕麦淀粉的体外消化率比较分析
有研究报道,外源添加非淀粉多糖时,可不同程度地延缓淀粉的消化速率,且添加比例不同,淀粉的消化速率也不同[37,38]。类比于外源添加,内源去除非淀粉多糖后,各处理间淀粉离体消化速率不同(图1),相比于对照组,所有样品经果胶(A)、半纤维素(B)和纤维素(C)3种酶处理后,前期(30 min和60 min)的淀粉水解速率均不同程度升高,90 min后消化基本完成,最终淀粉消化速率(180 min)表现为半纤维素酶解>纤维素酶解>果胶酶解>对照。这说明燕麦非淀粉多糖会影响淀粉的消化特性,且不同组分对淀粉离体消化速率的影响不同。经半纤维素酶解处理后,坝莜13号的淀粉水解速率最高;晋燕8号的淀粉水解速率变化相对较小。经果胶和纤维素酶解处理后,淀粉水解速率最高的是魏都莜5号,变化较小的分别是吕燕4号。孙健[24]研究了非淀粉多糖酶解处理对稻米淀粉体外消化特性的影响,发现半纤维素酶解处理后淀粉体外消化升高最为显著,与本研究结论相似。
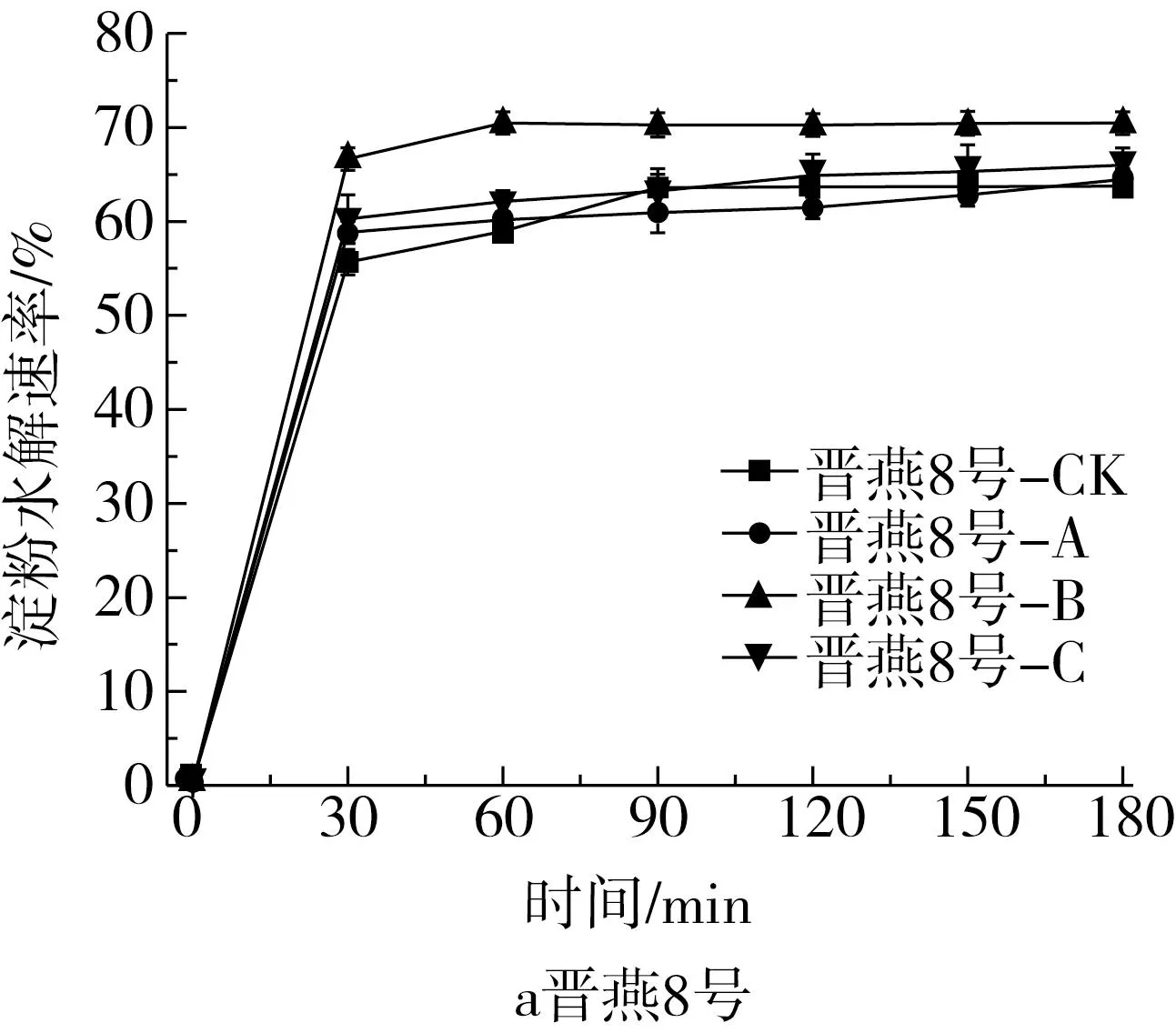
图1 不同NSP酶解处理不同品种裸燕麦的淀粉水解曲线
经酶解处理的燕麦粉的快消化淀粉、慢消化淀粉和抗性淀粉占总淀粉的百分含量如表4所示。结果表明,相比于对照组(CK),所有样品经果胶(A)、半纤维素(B)和纤维素(C)3种酶处理后,RDS含量均有显著升高(P<0.05),SDS含量均有显著降低(P<0.05),其中半纤维素酶解后RDS含量最高,其次为纤维素和果胶酶解处理。除魏都莜5号和晋燕8号外,其余品种的燕麦样品经半纤维素和纤维素酶处理后,RS含量均有显著降低。这是由于燕麦淀粉水解糊化时,非淀粉多糖可以通过包裹淀粉颗粒,或与淀粉分子互作增加米粉体系黏度和凝胶强度来抑制淀粉的水解[37-41]。此外,消化后残留的较完整的细胞壁结构也可以阻碍消化酶与胚乳中淀粉的接触[42]。燕麦粉经非淀粉多糖酶解处理后,胚乳细胞壁和淀粉体膜水解,加热糊化过程中淀粉颗粒更易于崩解,淀粉分子更容易析出,米粉胶体黏度下降,导致RDS含量升高,淀粉水解速率加快,SDS含量下降,最终淀粉水解速率升高。
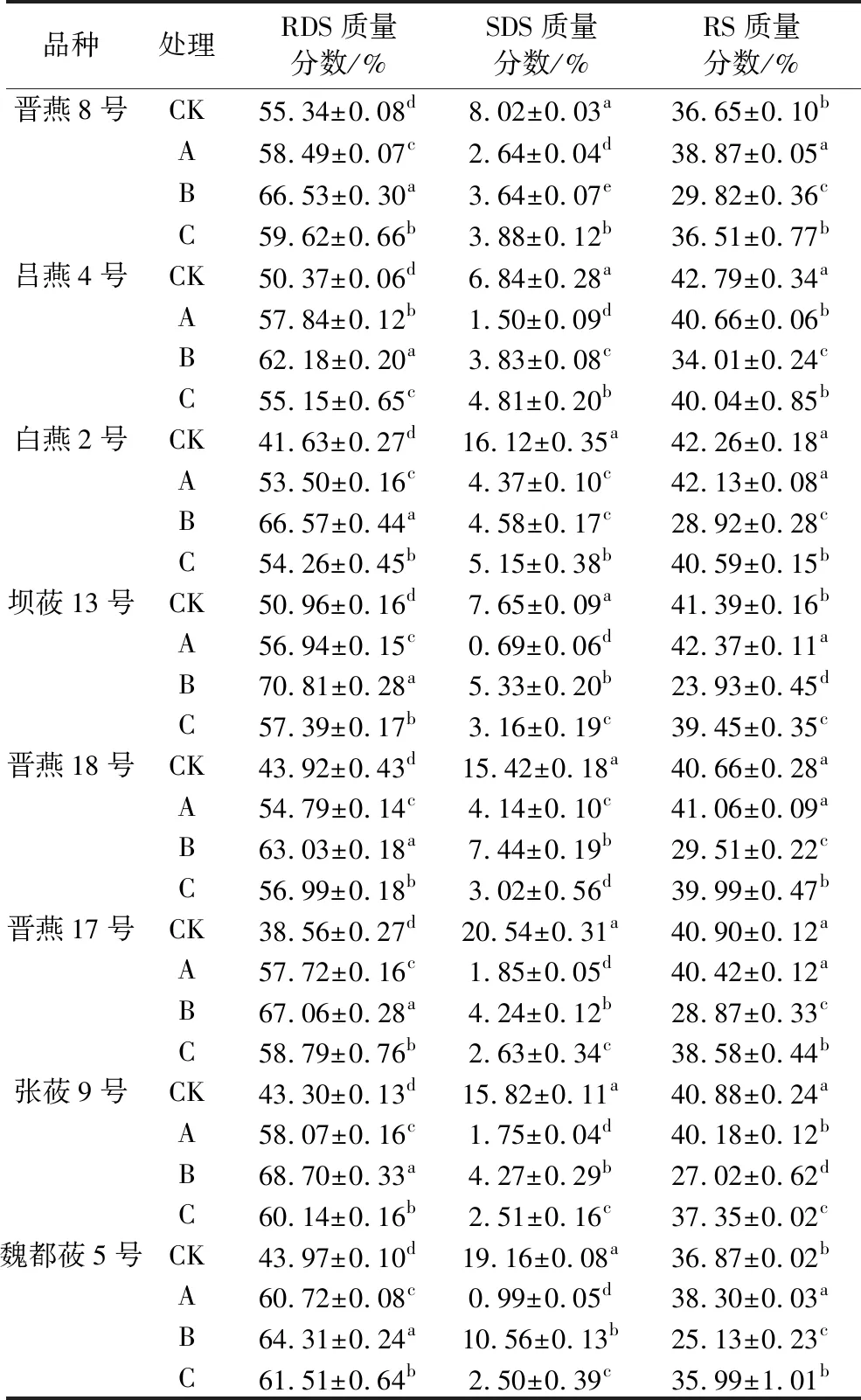
表4 不同类群燕麦经NSP酶解处理的RDS、SDS和RS含量(n=3)
3 结论
裸燕麦中β-葡聚糖和半纤维素是其非淀粉多糖的主要组成成分,淀粉水解率与β-葡聚糖含量呈显著负相关(P<0.05),经非淀粉多糖酶解后,淀粉耐消化能力减弱,尤其是半纤维素酶解后淀粉离体消化速率和快消化淀粉含量升高最为显著(P<0.05),其次为纤维素酶处理,果胶酶处理。因此,裸燕麦中非淀粉多糖均可降低其淀粉体外消化能力,提高β-葡聚糖和半纤维素含量有利于提高裸燕麦淀粉耐消化能力。

