磁性聚合物微球固定化发酵液中脂肪酶
郭俊宏,王添誉,孙西同,李佥*,陈晓艺,李苗,曾祥冰,黄帆,李宪臻*
1(大连工业大学 生物工程学院,辽宁 大连,116034)2(大连工业大学 轻工与化学工程学院,辽宁 大连,116034)
脂肪酶(lipase, EC 3.1.1.3)是一类能催化酯分解、酯合成、酯交换等反应的酶[1],在食品加工、药物合成、生物燃料生产、污染物去除等领域都有着重要的作用[2-5]。由于游离酶稳定性差,酶活性易受外界环境和条件影响,难以分离回收再利用,不适合实际应用。酶固定化是克服上述缺点的一种简单有效的方法。
目前,酶固定化载体种类多样,其中磁性材料由于具有独特的超顺磁性,可以通过外加磁场实现快速分离,达到有效回收利用而备受关注。然而,由于缺乏有效的修饰方法,造成Fe3O4表面的官能团数量有限,直接影响了固定化酶的性能,并且Fe3O4在空气中容易被氧化[6],应用受到限制。树枝状大分子是一种有规则且结构明确的有机聚合物,具有高度分支的分子结构和丰富的表面基团,因此树枝状大分子修饰是提高表面官能团数量的有效策略。聚酰胺-胺(polyamidoamine,PAMAM)树枝状大分子是目前研究最广泛的树枝状大分子之一。PAMAM的外部功能基团的密度和刚性取决于它的接枝代数,树枝状大分子的接枝代数越高,灵活性越低,外部官能团的数量则呈指数增长,可以为酶提供更多的连接位点。因此,PAMAM接枝代数的增长在一定程度上是有益的,其良好的生物相容性,使之成为酶固定化的理想载体,但存在难以分离回收等问题[7-9]。
为了解决实际应用中游离脂肪酶的稳定性和重复使用性较差的问题,本研究首先使用近平滑假丝酵母发酵生产脂肪酶,在采用共沉淀法制备油酸修饰的Fe3O4基础上,使用悬浮聚合法合成了聚甲基丙烯酸甲酯磁性微球[Fe3O4@Poly(methyl methacrylate),Fe3O4@PMMA]。进而通过发散合成法合成了树枝状大分子接枝的磁性聚合物微球(Fe3O4@PMMA/PAMAM),并通过多种方法进行表征,进一步将Fe3O4@PMMA/PAMAM用于脂肪酶的固定化,并进行了固定化工艺的优化和酶学性质研究。
1 材料与方法
1.1 实验材料
1.1.1 实验菌种
近平滑假丝酵母(Candidaparapsilosis) CICC 33470,中国工业微生物菌种保藏管理中心。
1.1.2 实验试剂
FeCl3(化学纯)、FeCl2·4H2O、油酸、N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)(均为分析纯),国药集团化学试剂有限公司;二乙烯苯(55%)、PVA-1788、曲拉通X-100、阿拉伯树胶、棕榈酸对硝基苯酯(p-nitrophenyl palmitate,p-NPP,98%),上海阿拉丁生化科技股份有限公司;异丙醇、葡萄糖、可溶性淀粉,均为分析纯,天津市科密欧化学试剂有限公司;蛋白胨,北京奥博星生物技术有限责任公司;麦芽汁琼脂培养基,青岛高科技工业园海博生物技术有限公司;其余试剂均为分析纯,天津市大茂化学试剂厂。
1.1.3 仪器与设备
Tecan酶标仪,勒菲生物科技(上海)有限公司;JSM-7800F热场发射扫描电子显微镜(scanning electron microscope,SEM),日本电子株式会社;Zetasizer 3000HSA激光粒度仪(dynamic light scattering,DLS),英国MALVERN仪器公司;X-Max50能量色散光谱仪(energy dispersive spectrometer,EDS),英国牛津仪器公司;vario EL cube元素分析仪(element analyzer, EA),德国Elementar仪器公司;Spectrum two傅立叶变换红外光谱仪(Fourier transform infrared spectroscopy,FT-IR),铂金埃尔默仪器有限公司;Lake Shore 8600振动样品磁强计(vibrating sample magnetometer,VSM),美国Lake Shore仪器公司;岛津XRD-7000S X射线衍射仪(X-ray diffraction sepectrum,XRD),日本岛津株式会社;DSC Q2000热重分析仪(thermal gravimetric analyzer,TGA),美国TA仪器公司。
1.2 实验方法
1.2.1 发酵液的制备
1.2.1.1 近平滑假丝酵母的传代
将适量的假丝酵母接种到麦芽汁琼脂培养基上。30 ℃培养3 d[10],然后重复此过程,直至假丝酵母传代3次。
1.2.1.2 近平滑假丝酵母的种子培养
按葡萄糖10 g/L、蛋白胨5 g/L、(NH4)2SO41 g/L、K2HPO42 g/L、MgSO41 g/L配制适量的种子培养基,使用PBS调其pH值至8.0。再将假丝酵母接种到种子培养基上。于30 ℃、180 r/min培养36 h,制成种子液[11]。
1.2.1.3 近平滑假丝酵母的发酵培养
按可溶性淀粉20 g/L、蛋白胨10 g/L、(NH4)2SO41 g/L、K2HPO42 g/L、MgSO41 g/L配制适量的发酵培养基[12],使用PBS将其pH值调至8.0。再按5%(体积分数)的接种量,将种子液接种到发酵培养基中。于30 ℃、180 r/min下培养48 h,即可获得发酵液[13]。
1.2.2 材料的合成和固定化酶的制备
首先通过共沉淀法制备油酸修饰的Fe3O4,然后使用悬浮聚合法合成Fe3O4@PMMA,再采用发散合成法合成Fe3O4@PMMA/PAMAM,最后以戊二醛为交联剂制备Fe3O4@PMMA/PAMAM固定化脂肪酶。制备及固定化脂肪酶的工艺流程见图1。

图1 Fe3O4@PMMA/PAMAM的制备及固定化脂肪酶的工艺流程
1.2.2.1 油酸修饰的Fe3O4的制备
将3.33 g FeCl2·4H2O、5.47 g FeCl3和200 mL去离子水加入三颈烧瓶中,在N2保护下开始搅拌,升温至85 ℃。然后,向反应体系中迅速倒入20 mL NH3·H2O,再向其中滴加7.5 mL油酸。恒温反应30 min后,将产物用磁铁进行分离,再用去离子水洗涤数次,即可获得油酸修饰的Fe3O4。经真空干燥后,室温下保存备用[14]。
1.2.2.2 Fe3O4@PMMA的合成
采用悬浮聚合法合成Fe3O4@PMMA[14]。
1.2.2.3 Fe3O4@PMMA/PAMAM的合成
酰胺化反应。将一定量的Fe3O4@PMMA、150 mL DMF和75 mL乙二胺(ethylenediamine,EDA)加入三颈烧瓶中,在N2保护下开始搅拌,升温至80 ℃。恒温反应8 h后,将产物在外加磁场下进行磁分离,再用去离子水和乙醇洗涤数次。经真空冷冻干燥后,室温下保存。将所得的氨基化的磁性聚合物微球命名为G-0。
迈克尔加成反应。将一定量的G-0、150 mL DMF和50 mL丙烯酸甲酯(methyl acrylate,MA)加入三颈烧瓶中并在N2保护下开始搅拌,升温至80 ℃,恒温反应8 h后,将产物在外加磁场下进行磁分离,再用去离子水和乙醇洗涤数次。经真空冷冻干燥后,室温下保存备用。
将迈克尔加成反应得到的产物再进行一次酰胺化反应,得到的第1代树枝状大分子接枝的磁性聚合物微球,命名为G-1。与此类似,制备第2代和第3代微球材料,分别命名为G-2和G-3。
1.2.2.4 Fe3O4@PMMA/PAMAM固定化脂肪酶
a)载体的活化。将20 mg载体、5 mL pH值为8.0的PBS和0.4 mL戊二醛加入锥形瓶中。在30 ℃,180 r/min培养10 h后,将活化的载体在外加磁场下进行磁分离并用去离子水洗涤数次后保存。
b)脂肪酶的固定化。将10 mL发酵液、5 mL pH值为8.0的PBS及活化的载体加入锥形瓶中。在25 ℃,180 r/min培养4 h后,将固定化脂肪酶在外加磁场下进行磁分离并用去离子水洗涤数次后保存在4 ℃冰箱中。
1.2.3 脂肪酶活力和酶活力回收率的测定
使用p-NPP水解产生对硝基苯酚(p-nitrophenol,p-NP)的反应测定脂肪酶活力。检测405 nm处的吸光度,采用标准曲线法测定p-NP的浓度[15]。酶活力单位(U)定义:在一定条件下每分钟水解p-NPP产生1 μmolp-NP所需的酶量。具体过程如下:
将0.8 g曲拉通X-100、0.2 g阿拉伯树胶和100 mL pH值为8.0的PBS加入烧杯中,搅拌至完全溶解,即为A液。将p-NPP溶解到异丙醇中,配制成均匀的溶液,即为B液。将A液和B液按体积比3∶1混合均匀,配制成p-NPP质量浓度为5 mg/mL的底物溶液。
将一定量的脂肪酶与3 mL底物溶液共同加入离心管中,50 ℃下水浴反应10 min后,加入2 mL 0.25 mol/L 的Na2CO3溶液终止反应,离心取上清液,在405 nm下测定吸光度。脂肪酶活力、酶活力回收率分别按公式(1)、公式(2)计算:

(1)
式中:c,p-NP的浓度,μmol/mL;V,溶液的总体积,mL;t,反应时间,min;m,载体质量,g。
(2)
式中:X,固定化脂肪酶的酶活力,U/g;Y,固定化前游离脂肪酶的酶活力,U/g;Z,固定化后上清液中的酶活力,U/g。
1.2.4 材料的表征
使用SEM、DLS、EDS、EA、FT-IR、VSM、XRD、TGA对材料进行表征。
2 结果与分析
2.1 Fe3O4@PMMA/PAMAM的表征
Fe3O4@PMMA/PAMAM的SEM图像如图2-a所示,G-3大致具有球形形貌,平均直径在2~3 μm,这可以为固定化脂肪酶提供较大的比表面积。Fe3O4@PMMA/PAMAM的粒径分布如图2-b所示,G-3的平均粒径为2.6 μm,这与SEM观测的结果一致。

a-扫描电镜图像;b-粒径分布
Fe3O4@PMMA/PAMAM的EDS分析结果如图3所示,G-1、G-2和G-3的N元素含量百分比分别为0.995%、1.175%和1.360%。Fe3O4@PMMA/PAMAM上的N元素的主要来源是酰胺和氨基。N元素的含量随着接枝代数的增加而增加,说明G-1、G-2和G-3均被成功合成。

图3 Fe3O4@PMMA/PAMAM的N元素能谱结果
Fe3O4@PMMA/PAMAM的EA分析如表1所示,G-1、G-2和G-3的C元素、N元素和H元素的比例均随着接枝代数的增加而增加,说明了Fe3O4@PMMA/PAMAM被成功制备。同时,G-1、G-2和G-3的N元素含量分别为0.99%、1.13%和1.26%,这与EDS分析的结果相似。

表1 Fe3O4@PMMA/PAMAM的元素分析结果 单位:%
Fe3O4@PMMA/PAMAM的FT-IR图如图4所示,G-1、G-2和G-3均在590 cm-1处有着Fe—O键伸缩振动的特征吸收峰[16]。

图4 Fe3O4@PMMA/PAMAM的红外光谱图
G-1、G-2和G-3还在1 690、1 565、1 410 cm-1处具有特征吸收峰,这与—CO—NH—键的伸缩振动有关[8,16-17]。G-1、G-2和G-3的C—H键和N—H键的伸缩振动特征吸收峰则分别出现在2 950、3 430 cm-1处[8,16]。从FT-IR图中可以看出,G-1、G-2和G-3均被成功合成。
Fe3O4@PMMA/PAMAM的磁化曲线如图5所示,G-3具有极低的剩磁和矫顽力,呈现典型的s型磁滞回线,证明了其拥有超顺磁性[18]。G-3的最大饱和磁化强度值为24.65 emu/g。结果表明Fe3O4@PMMA/PAMAM不仅具有超顺磁性和较高的最大饱和磁化强度值,还有着良好的磁响应性。

图5 Fe3O4@PMMA/PAMAM的磁滞回线
Fe3O4@PMMA/PAMAM的XRD谱图如图6所示,G-1、G-2和G-3都在2θ=30.25°,35.55°,43.10°,53.88°,57.24°和62.93°处有6个衍射峰,与标准Fe3O4的(220,311,400,422,511和440)XRD峰相比(JCPDS card No.65-3107),峰的位置基本相同[19]。结果表明Fe3O4@PMMA/PAMAM的晶体结构在修饰过程中没有发生明显变化。

图6 Fe3O4@PMMA/PAMAM的X射线衍射谱图
G-3和使用G-3作为载体的固定化脂肪酶(G-3-lipase)的热重分析曲线如图7所示,G-3和G-3-lipase的质量在300 ℃以下发生了轻微地下降,分别为6.53%和6.26%,这主要归因于结合的水的蒸发[16]。而G-3和G-3-lipase的质量在300 ℃以上则迅速损失,分别为47.48%和56.79%,这主要是由有机层的热分解引起的[20]。相较于G-3,G-3-lipase的重量损失更多,这与固定在载体上的脂肪酶的部分分解有关,证明了脂肪酶被成功固定化到载体上。

图7 G-3和G-3-lipase的热重分析曲线
2.2 固定化脂肪酶的工艺优化
不同固定化条件对固定化脂肪酶相对酶活力的影响如图8所示。当戊二醛用量为0.6 mL时,固定化脂肪酶有着最高的酶活力(图8-a)。当戊二醛用量小于或大于0.6 mL时,固定化脂肪酶活力均降低。这是因为当戊二醛用量较少时,仅有一小部分脂肪酶可以被连接到载体上[21],而当戊二醛用量较多时,会导致部分活化的载体发生过度偶联,使其连接脂肪酶的能力降低,并且引起脂肪酶活力的损失[22]。因此,选择0.6 mL作为最优的戊二醛用量。

a-戊二醛体积;b-固定化时间;c-缓冲液pH值;d-固定化温度
如图8-b所示,当固定化时间为5 h时,固定化脂肪酶的活力达到最大值。在较短或较长的固定化时间下,固定化脂肪酶活力均降低。主要原因是较短的固定化时间导致载体与脂肪酶无法充分接触,载体上固定化的脂肪酶量较少,而脂肪酶与活化的载体的长时间接触引起了脂肪酶活力的损失[23]。因此,选择5 h作为最优的固定化时间。
如图8-c所示,当固定化pH值为8.0时,固定化脂肪酶具有最高的活力。当固定化pH值小于或大于8.0时,固定化脂肪酶活力均降低。由于脂肪酶的构象特性,固定化脂肪酶在固定化pH较低或较高的情况下活力较差[24]。因此,选择8.0作为最优的固定化pH值。
如图8-d所示,当固定化温度为35 ℃时,固定化脂肪酶活力最高。在较低或较高的固定化温度下,固定化脂肪酶活力均降低。这是因为,在较低的固定化温度下,固定化温度的升高促进了脂肪酶与载体的接触[21]。在较高的固定化温度下,由于热变性,脂肪酶的构象发生改变[25]。因此,选择35 ℃作为最优的固定化温度。
2.3 发酵生产的游离脂肪酶和固定化脂肪酶的酶学性质研究
不同反应条件下发酵生产的游离脂肪酶和固定化脂肪酶的相对酶活力如图9所示。发酵液中的游离脂肪酶和固定化脂肪酶的最适反应温度均为50 ℃(图9-a)。当反应温度小于或大于50 ℃时,游离脂肪酶和固定化脂肪酶活力均降低,但固定化脂肪酶的下降幅度较小。

a-温度;b-pH值
如图9-b所示,发酵液中的游离脂肪酶的最适反应pH值为8.0,而固定化脂肪酶的最适反应pH值为9.0。脂肪酶固定化到Fe3O4@PMMA/PAMAM上后,最适反应pH发生了明显变化,主要原因是脂肪酶所处的微环境发生了改变[26]。当反应pH小于或大于最适条件时,游离脂肪酶和固定化脂肪酶活力均降低,但固定化脂肪酶的下降幅度较小。
结果表明发酵液中的游离脂肪酶对反应温度和反应pH敏感,仅能在50 ℃和8.0左右的较小的反应温度和反应pH范围内具有较高的酶活力,而固定化脂肪酶可以在更大的反应温度和反应pH范围内保持较高的酶活力。这是因为通过在固定化过程中形成大量的共价键,增加了脂肪酶构象的刚性,降低了脂肪酶活力损失[27]。
发酵生产的游离脂肪酶和固定化脂肪酶的热稳定性和pH稳定性如图10所示。随着处理时间的增长,发酵液中的游离脂肪酶和固定化脂肪酶活力均逐渐降低,但固定化脂肪酶的下降幅度较低(图10-a)。在50 ℃下热处理5 h后,发酵液中的游离脂肪酶的剩余酶活力仅为15.48%,相比之下,固定化脂肪酶的相对酶活力明显高于游离脂肪酶,为50.97%。
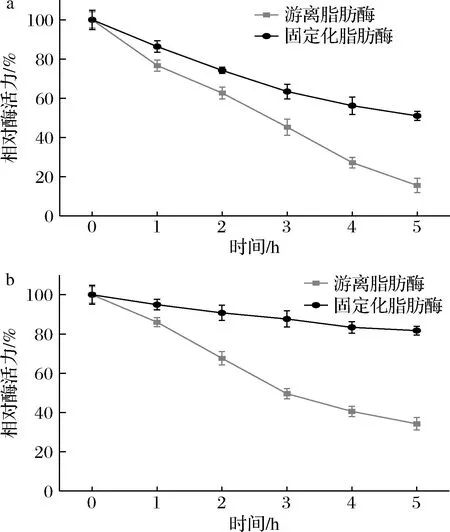
a-脂肪酶在50 ℃下的热稳定性;b-脂肪酶在pH 9.0下的热稳定性
如图10-b所示,随着处理时间的增长,发酵液中的游离脂肪酶和固定化脂肪酶活力均逐渐降低,但固定化脂肪酶的下降幅度较低。在pH值为9.0的PBS中处理5 h后,发酵液中的游离脂肪酶的剩余酶活力仅为34.25%,与之相比,固定化脂肪酶的相对酶活力明显高于游离脂肪酶,为81.74%。
结果表明脂肪酶固定化到Fe3O4@PMMA/PAMAM上后,热稳定性和pH稳定性均明显增强。稳定性增强的主要原因是脂肪酶与Fe3O4@PMMA/PAMAM间形成的共价键限制了脂肪酶构象的变化,使其在较为恶劣的条件下保持稳定[28]。
固定化脂肪酶的重复使用性和贮存稳定性如图11所示。随着循环次数的增加,固定化脂肪酶活力逐渐降低,重复使用10次后,固定化脂肪酶仍能维持72.23%的酶活性(图11-a)。结果表明固定化脂肪酶具有良好的重复使用性,这是因为Fe3O4@PMMA/PAMAM与脂肪酶的相互作用减少了脂肪酶从载体上的脱落,也降低了脂肪酶在重复使用的过程中因构象变化而引起的酶活性损失[29]。
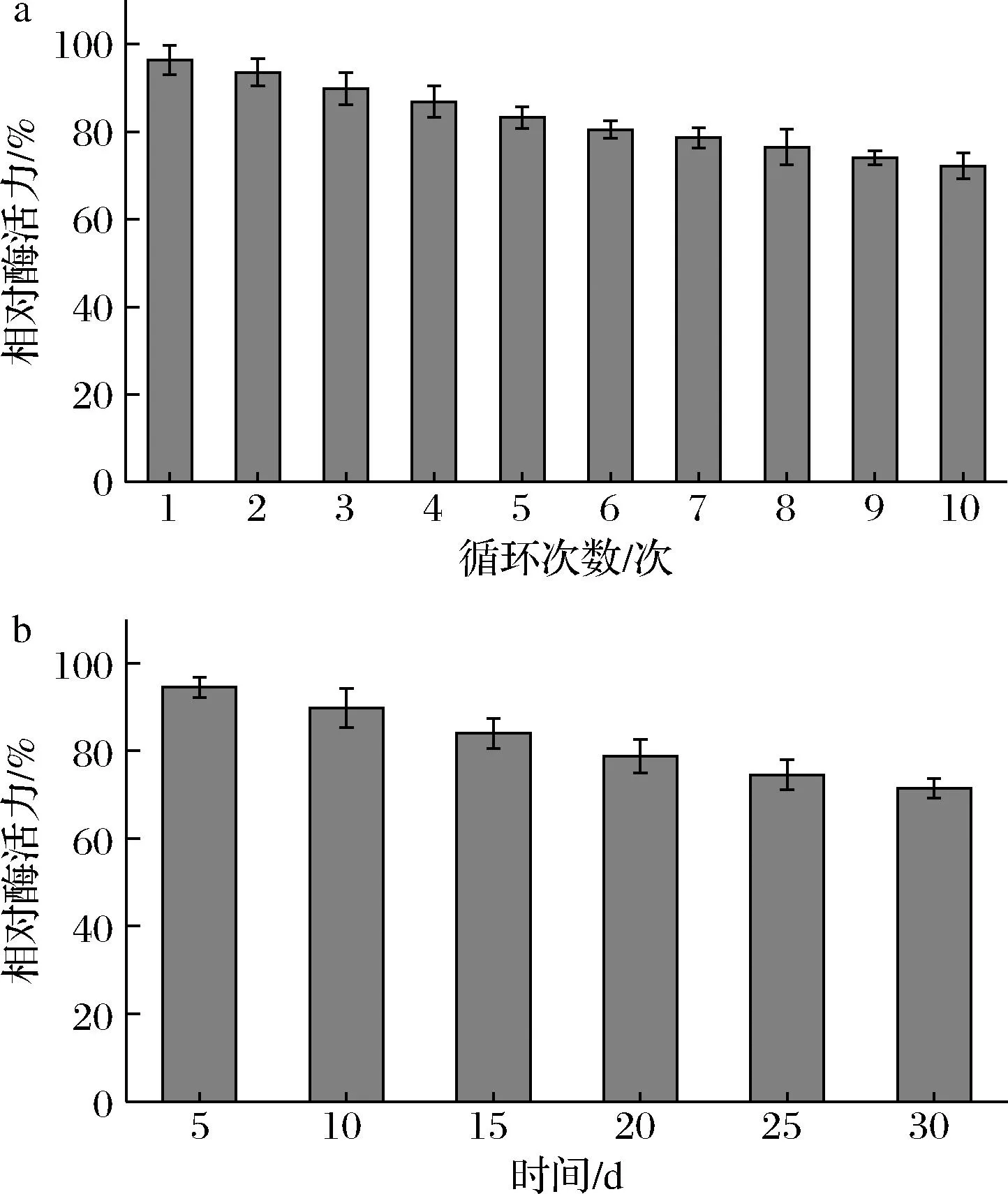
a-重复使用性;b-贮存稳定性
如图11-b所示,随着贮存时间的增长,固定化脂肪酶活力逐渐降低。在4 ℃下贮存30 d后,固定化脂肪酶仍能保留71.44%的酶活力。结果表明固定化脂肪酶有着良好的贮存稳定性,主要原因是Fe3O4@PMMA/PAMAM与脂肪酶的相互作用增强了脂肪酶对构象变化的抵抗能力,降低了脂肪酶因长时间贮存而引起的酶活性损失[30]。
Fe3O4@PMMA/PAMAM固定化脂肪酶活力为864 U/g,酶活力回收率为74.29%。将Fe3O4@PMMA/PAMAM用于固定化假丝酵母发酵生产的游离脂肪酶,所得的固定化脂肪酶具有良好的酶活力、稳定性和重复使用性。Fe3O4@PMMA/PAMAM固定化脂肪酶的这些优点对于脂肪酶的广泛实际应用具有非常重要的意义,可以满足各种行业的需求,如染料的去除、生物柴油的生产、动力学拆分、酯类的合成等。
3 结论与讨论
本文合成了树枝状大分子接枝的磁性聚合物微球Fe3O4@PMMA/PAMAM并用多种方式对其进行表征,然后将Fe3O4@PMMA/PAMAM用于固定化发酵液中脂肪酶的研究,确定了最佳固定化工艺条件,即戊二醛用量为0.6 mL、固定化时间为5 h、固定化pH值为8.0、固定化温度为35 ℃,固定化脂肪酶活力为864 U/g,酶活力回收率为74.29%。发酵液中的游离脂肪酶和固定化脂肪酶的最适反应温度均为50 ℃,最适反应pH值则分别为8.0和9.0,Fe3O4@PMMA/PAMAM固定化脂肪酶能在更宽的反应温度和反应pH范围内保持较高的酶活性。在50 ℃下热处理5 h后,发酵液中的游离脂肪酶的剩余酶活力仅为15.48%,而固定化脂肪酶则保持了50.97%的酶活力。在pH值为9.0的PBS中处理5 h后,发酵液中的游离脂肪酶的剩余酶活性仅为34.25%,而固定化脂肪酶则保持了81.74%的酶活性。脂肪酶固定化到Fe3O4@PMMA/PAMAM上后,热稳定性和pH稳定性均显著提高。重复使用10次后,固定化脂肪酶仍能维持72.23%的酶活力。在4 ℃下贮存30 d后,固定化脂肪酶仍能保留71.44%的酶活力。实验结果表明,Fe3O4@PMMA/PAMAM固定化脂肪酶有着较高的酶活性、良好的稳定性和重复使用性。因此,Fe3O4@PMMA/PAMAM将在未来生物催化领域有着广阔的应用前景和巨大的发展潜力。