水稻锌稳态调控基因和分子机制的研究进展
李荣田,李双语燕,,孟丽君,刘长华,3,詹俊辉
(1黑龙江大学生命科学学院农业微生物技术教育部工程研究中心/黑龙江省寒区植物基因与生物发酵重点实验室/黑龙江省普通高校分子生物学重点实验室,哈尔滨 150080;2中国农业科学院深圳农业基因组研究所,广东深圳 518120;3黑龙江大学现代农业与生态环境学院,哈尔滨 150080)
0 引言
锌是植物、动物和人体所必须的微量元素之一,主要参与生物大分子的合成、能量和其他物质代谢以及氧化还原等过程[1-2]。缺锌会影响水稻中酶和激素的合成,还会影响光合作用,甚至会降低水稻的产量和品质。过量的锌也会对水稻造成毒害,干扰光合作用,影响植物生长,最终导致植株死亡。另一方面,在人体中缺锌会导致生长发育迟缓、免疫功能受损和智力发育受阻等症状[2]。而锌在人体内无法自行合成,须通过日常饮食中获取,如主要粮食作物之一的水稻。因此,提高水稻籽粒中锌的含量对于以稻米为主食的人口的锌营养至关重要[3]。然而,近年来少有研究对水稻体内锌稳态的调控基因和分子调控机制进行阐述、归纳和总结。因此,本研究基于水稻体内锌稳态的调控研究,对参与锌吸收、转运、分配和累积的转运蛋白以及分子调控途径进行分类和总结,以期为水稻锌稳态调控基因的挖掘、分子机制的研究和富锌水稻种质的创制提供理论参考。
1 锌对植物的重要性
1.1 缺锌对植物的影响
锌是植物必不可少的微量元素,缺锌和锌过量都会影响植物的生长[4]。锌与蛋白质的合成有关,作为RNA 聚合酶的组分之一参与蛋白质的合成。缺锌会导致植物RNA 聚合酶活性的下降,影响蛋白质的合成。同时,锌还是维持核糖体蛋白结构完整必不可少的微量元素,缺锌也会导致蛋白合成受阻和蛋白质的含量下降[5]。核糖核酸酶(RNase)活性也受水稻锌供应状况影响,缺锌会导致RNase 活性提高,使RNA 含量降低[6]。锌和光合作用密切相关。锌可提高植物中光合过程的强度,锌既影响光合作用催化过程中碳酸酐酶CA 活性,还能提高植物体内叶绿素的含量[7-8]。锌指蛋白对基因调控起着重要作用,而锌是锌指蛋白的主要成分,与植物相关的锌指蛋白可以调控种子、幼苗、雄蕊和花的发育[9]。锌直接参与色氨酸合成,色氨酸又是生长素的主要原料,因此锌间接影响生长素的合成[10]。锌参与作物对病害的抗性。缺锌时,根系生物膜的结构和功能受到破坏导致渗出的碳水化合物和游离氨基酸量增多,使病原菌的生长繁殖加快,导致水稻病害加重[11-12]。此外,锌还可以通过影响植物生理代谢过程来间接影响植物的抗病性[13]。
锌也影响着作物的营养品质。Anandan等[14]研究发现在水稻籽粒营养品质的研究中发现水稻籽粒品质与锌浓度有关,具体表现为锌含量较高的品种蒸煮后籽粒伸长率、籽粒中其他微量营养素含量较高。籽粒微量含量与颜色相关,紫黑米中锌、钙、铁、锰、硒等多种微量元素含量都高于白米,这可能是由于紫黑米中含有较多的花青素,而花青素可以与这些金属元素络合[15]。
1.2 过量锌对植物的影响
尽管锌在植物生长发育过程中必不可少,但是锌过量也会对植物造成损伤,一般植物锌中毒的临界值是含锌量>50 mg/kg[16]。锌浓度升高可能会通过影响植物生理代谢来抑制植物生长[17]。ROUT 和Zhu 等研究表明,高浓度锌抑制了根细胞分裂和细胞伸长,减少了光合作用,干扰线粒体结构以及营养素的吸收和转移,并诱导ROS 的过度生产[18-20]。植物中ROS 的过度生产会破坏氧化还原稳态[21-22]。锌浓度过高导致细胞结构发生致死性损伤,最终导致细胞死亡[23]。高浓度锌会抑制淀粉酶的活性,抑制种子萌发,随着锌处理浓度升高,处理时间延长,对种子萌发的抑制性越强[24]。植物体内游离脯氨酸可以防止植物细胞或组织结构受损,随着锌浓度的增加和处理时间的延长,黑麦草幼苗地上部游离脯氨酸含量升高[25]。过量锌会影响细胞分裂。锌浓度的增加和处理时间的延长,细胞分裂会受到抑制,细胞有丝分裂的指数下降并且分裂细胞的异常率升高[26]。过量锌也会影响对植物体内水分代谢。过量锌胁迫时,番茄幼苗含水量比对照有所下降[27]。
1.3 水稻锌的生物强化
锌在人体的生命活动中发挥着关键作用,不仅可以参与人体内必需的酶的合成,还可以参与体内的代谢、免疫调节等过程。因此解决缺锌问题对人体健康至关重要[2]。锌在人体内无法自行合成,须通过日常饮食中获取,水稻作为重要粮食作物,近年来越来越多的人关注水稻的锌强化。生物强化包括通过农艺措施如施肥、育种改良或者转基因生物强化等方式提高作物微量元素含量的方法[28]。而水稻由于其种植和食用地区的广泛性,水稻的锌生物强化是向缺锌人群提供锌的方式之一[29]。
农艺生物强化是一种以肥料为基础的方法,施用锌肥包括直接在土壤施用锌肥和叶面喷施锌肥等方式,适量的施用锌肥可以提高籽粒锌含量,还可以略微提升产量[30-32]。土壤肥料的使用效率不高,因为土壤中的许多元素会和锌发生反应,产生不溶形态,降低它们的有效性[33-34]。叶面喷施锌肥的效果更好,用量更少、吸收较快、且污染小、肥效率高等优点,能有效改善籽粒的锌含量,还能解决由于土壤对锌的固定所带来的不易吸收问题[35-37]。
与农艺措施不同,通过常规育种进行生物强化对环境更友好,但常规育种非常耗时,可能需要几年时间才能培育出高锌籽粒的优良品种。常规育种主要依赖于自然变异,包括主要数量性状基因座(QTL)和优势等位基因。在国际水稻研究所分析的939份水稻种质资源中,稻米籽粒锌含量在20~68 μg/g之间[38]。还有研究测定698份水稻精米中锌含量为5.8~29.6 μg/g[39]。这些研究表明,由于一些种质的锌含量高于水稻锌含量目标水平,通过常规育种可以实现高锌水稻的培育。目前已经定位到高锌籽粒的多个QTL 和优势等位基因,可以通过常规育种和分子标记辅助育种来培育籽粒锌含量较高的水稻品种[40-42]。
与传统育种相比,通过转基因手段进行生物强化是一种更有力、更快的方式。锌生物强化的基因改造目标包括增加根系对土壤中锌的吸收,促进锌向籽粒、特别是向胚乳的转移,以及增加锌的生物利用率,目前已经有研究表明有许多转运蛋白可以极大地提高籽粒锌含量。
2 影响水稻锌离子稳态的重要基因
适当增加植物锌含量有助于提高作物产量和品质,但缺锌会严重影响植物的生长发育,导致植株矮小,籽粒锌含量不足,产量和品质下降。因此,研究锌在植物体内吸收、转运、分配和累积的机理具有重要意义。而这些过程需要多种转运蛋白协同完成,主要包括:锌铁转运蛋白ZIP(zinc-regulated transporters,ironregulated transporter-like protein)、重金属ATP 酶HMA(heavy metal ATPases of the P1B-type ATPase)、烟酰胺合成酶NAS(Nicotianamine synthase)和植物金属耐受蛋白MTP(Metal tolerance protein)等[43](见表1)。
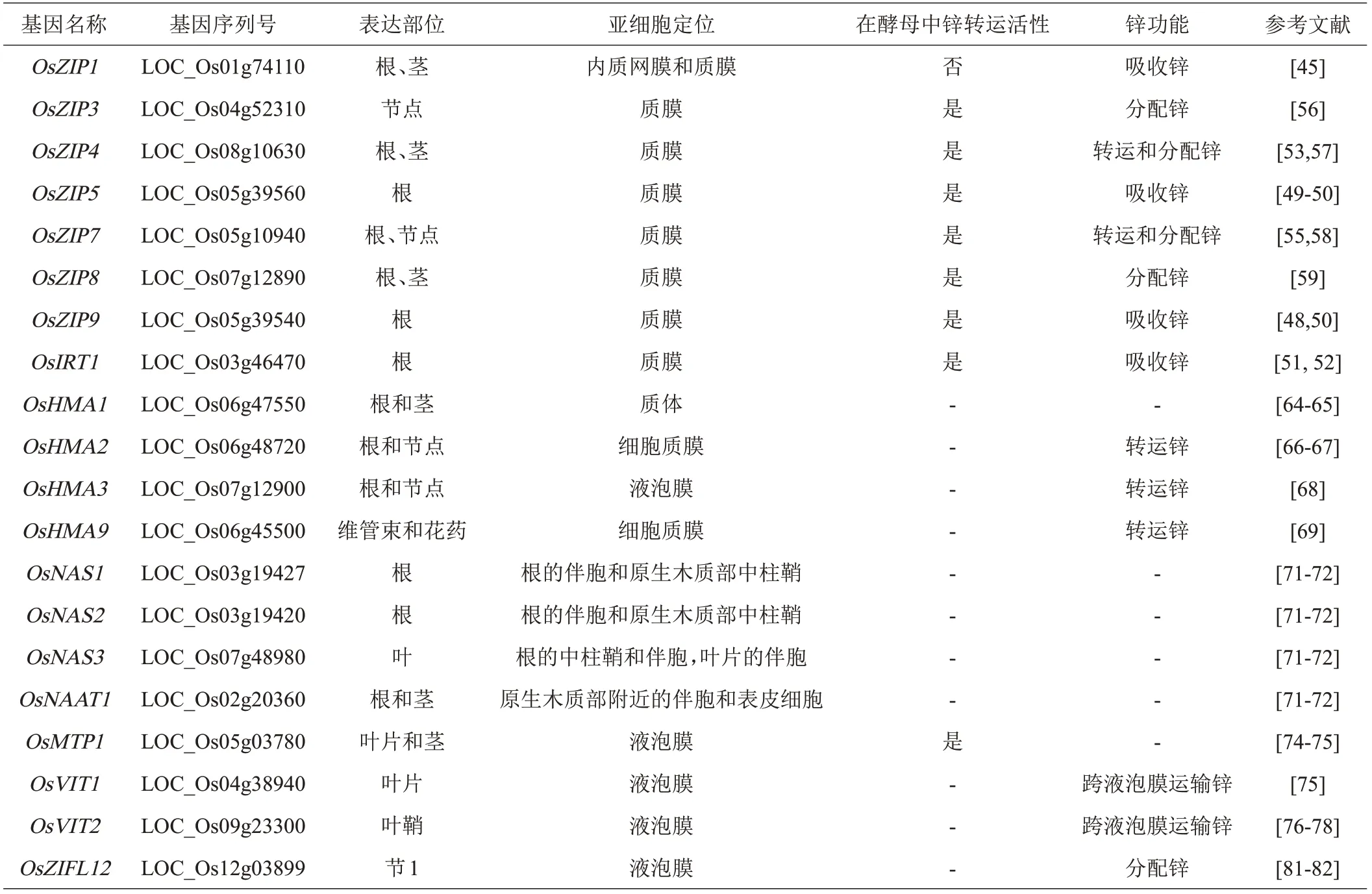
表1 水稻转运体家族部分成员的功能和表达特征
2.1 ZIP转运体
ZIP家族是非常重要的阳离子转运蛋白,ZIP转运蛋白不仅能转运锌铁等必需的微量元素,还能转运有害重金属元素[44]。目前在水稻中已知有16个ZIP家族成员,包括14个锌转运调控蛋白基因和两个铁转运调控蛋白基因。锌从土壤进入植物的第一步就是通过根系吸收,这一过程需要部分ZIP家族转运蛋白的参与,主要包括OsZIP1、OsZIP5、OsZIP9和OsIRT1。OsZIP1定位在内质网膜和质膜,主要在根中表达,是水稻体内过量锌、铜、镉所必需的金属外排转运蛋白,敲除OsZIP1根部锌含量显著下降,过表达该基因根部锌含量升高,说明OsZIP1参与水稻根系从土壤吸收锌的过程[45]。Ramegowda 等[46]实验表明,在小米和烟草中过表达OsZIP1 增加了种子中锌的含量。位于5 号染色体上的OsZIP5和OsZIP9,均定位在质膜,且在根中的表达受锌缺乏的诱导[47]。Meng 等[48]研究结果表明OsZIP9是一个重要的内流转运体,负责从外界介质中吸收锌进入根细胞。在低锌条件下,敲除OsZIP9显著降低了植株对锌的吸收,根和地上部锌浓度降低,导致生长发育受阻[49]。然而,敲除OsZIP9并不能完全抑制水稻对锌的吸收,说明可能还有其他转运蛋白参与了锌吸收的过程。作为高度同源的转运蛋白OsZIP5,也参与了植株对锌的吸收。OsZIP5 敲除突变体降低锌的吸收,但作用比OsZIP9 敲除系弱,而oszip5/oszip9双突变体对锌的吸收能力表现得更弱,说明OsZIP5与OsZIP9 存在功能冗余,协同调控植物对锌的吸收[50]。Lee等[51]研究表明,OsIRT1定位在质膜,主要在根中表达。过表达OsIRT1增加了植株根、地上部和籽粒中锌和铁含量,也导致了水稻株高变矮、分蘖数减少。这些结果表明OsIRT1 通过参与水稻对锌的吸收影响株高和分蘖数的改变[52]。
在将锌从土壤吸收到根部后,一部分锌储存到液泡中,另一部分锌则被转运到地上部。OsZIP4 和OsZIP7参与锌的转运过程。OsZIP4在维管束和叶片、茎和根的韧皮部表达,另外在根尖和茎的分生组织中表达较为明显。因此,OsZIP4的功能可能和锌的转运过程有关[53]。在田间正常条件下,OsZIP4过表达植株根中锌含量比野生型高10倍,但地上部锌含量低5倍,种子中锌含量降低了4倍,说明OsZIP4过表达减少了锌从根向地上部的转运[54]。OsZIP7 在根和节的维管束薄壁细胞中表达,敲除该基因会导致根部锌浓度上升,地上部锌浓度下降,说明功能缺失导致锌从根部向地上部转运减少[55]。
OsZIP3、OsZIP4、OsZIP7和OsZIP8参与了水稻体内锌的分配。OsZIP3定位于水稻茎节,负责将锌从膨大的维管束木质部转运到韧皮部[58]。敲除OsZIP3后,植株根部锌含量和根向地上部转运的锌并没有受到影响,而地上部伸长区和节点锌含量降低,表明OsZIP3的功能缺失影响了锌从节点分配到地上部快速生长组织的能力[56]。OsZIP4 基因敲除不影响植株对锌的总吸收量,但会导致穗部发育迟缓,这与锌在穗部的分配减少有关,表明OsZIP4也参与了生殖生长阶段节间锌的分配[57]。OsZIP7 敲除会导致锌和镉在根和基部节中滞留,阻碍其向节和籽粒中的运输。以上结果表明,OsZIP7 具有向发育中的组织和籽粒中分配锌的功能[58]。OsZIP8是定位于质膜的锌转运蛋白,其表达受缺锌的诱导。过表达OsZIP8 导致旗叶和籽粒中锌含量降低,说明OsZIP8 在锌的分配过程中起负调控作用[59]。
有研究表明,ZIP家族具有吸收、转运和分配锌的能力,同源基因的功能可能比较类似,但由于生存环境的差异或者其他因素的影响,不同物种同源基因的功能存在差异。在水稻中,OsZIP4与锌的分配和转运有关;但在蒺藜苜蓿中,MtZIP4与锌、铁和锰的分配和转运有关[60]。过表达OsZIP8影响锌在水稻体内的分配,而酵母实验表明AtZIP8 转运蛋白对锌没有转运活性[61]。因此ZIP转运蛋白在不同植物中的功能可能存在差异。
2.2 HMA转运体
重金属离子跨膜蛋白HMA家族通过ATP水解提供的能量实现重金属离子在细胞膜上的跨膜转运[62]。水稻中共有9 个HMA 家族成员,根据其金属-底物特异性划分为两类,一类是锌、镉、钴和铅转运蛋白包括OsHMA1、OsHMA2 和OsHMA3[63]。OsHMA1 定位在质膜上,在地上部表达,缺锌条件下表达上调[64-65]。OsHMA2定位于根的中柱鞘和节内维管束韧皮部,可能在锌和镉向木质部和根的转运中起作用,在低锌胁迫和锌毒害下表达没有明显变化,OsHMA2基因敲除导致根尖锌含量减少[66-67]。OsHMA3 定位在液泡膜,在同位素示踪实验中,OsHMA3功能缺失材料根中锌含量较低,而OsHMA3功能正常材料根系中更多的锌被转运到地上部,说明OsHMA3在锌的转运中起正调控作用[68]。另一类是铜、银转运蛋白包括OsHMA4、OsHMA5、 OsHMA6、 OsHMA7、 OsHMA8 和OsHMA9[63],其中OsHMA9定位在质膜,主要在维管束和花药中表达,并受高浓度铜、锌和镉条件的诱导。TDNA插入的OsHMA9突变体表现出对高浓度铜、锌和铅极强的敏感性,表明OsHMA9 可能参与铜、锌和铅的外排[69]。
2.3 NAS转运体和MTP转运体
烟草胺是植物体内一种主要的金属螯合剂,由烟酰胺合成酶NAS催化合成,NAS在锌和铁的稳态中发挥着重要的作用[70]。在缺锌条件下,OsNAS1 和OsNAS2 在根中表达无显著差异,而OsNAS3 和OsNAAT1 在根和地上部的表达量上升[71]。Johnson等[72]研究表明,过表达OsNAS1、OsNAS2 和OsNAS3植株籽粒中烟酰胺、锌和铁的含量都显著提高,其中在过表达OsNAS2和OsNAS3的植株中表现更为明显。
离子扩散协助蛋白CDF(cation diffusion facilitator)家族也称为植物金属耐受蛋白MTP,与维持生物体内金属离子稳态及生物重金属耐性密切相关[73]。水稻MTP家族中有10个成员,OsMTP1定位在液泡膜,在酵母异源互补实验中发现OsMTP1提高了对锌和镉的耐性[74-75]。
2.4 其他基因
植物液泡是储存多余营养元素的重要细胞器,VIT转运蛋白在液泡存储锌的过程中发挥着重要的作用。OsVIT1 和OsVIT2 定位于液泡膜上,分别在叶片和叶鞘中高表达,在酵母突变体Δccc1和Δzrc1中异源表达OsVIT1 和OsVIT2 可以部分回复突变体铁和锌敏感的表型,并且增加了液泡中铁、锌和锰的积累,表明OsVIT1 和OsVIT2 有跨液泡膜运输铁、锌和锰的功能[75]。Che 等[76]研究发现OsVIT2 在节点高表达,OsVIT2定位在节点的薄壁细胞和叶鞘中。OsVIT1和OsVIT2 的功能缺失均导致水稻籽粒中锌和铁的含量增加,剑叶中锌和铁的积累相应减少,表明源器官和库器官之间锌和铁的转运增加[76-78]。
转运蛋白超家族MFS(major facilitator super family)是第二大膜转运蛋白之一,广泛存在于生物体中,水稻锌诱导促进家族基因ZIFL(ZINC-INDUCED FACILITATOR-LIKE)是MFS 中的一员[79]。在锌过量处理条件下,根中OsZIFL2、OsZIFL4、OsZIFL5、OsZIFL7、OsZIFL10 和OsZIFL12 的表达上调[80]。OsVMT,即OsZIFL12,定位在液泡膜,在铁和锌含量较高的节间1 的薄壁细胞中高表达。OsVMT 突变体促进了水稻籽粒中铁和锌的积累[81]。
水稻有毒化合物外排转运复合体(Multidrug and toxic compound extrusion, MATE) 基因OsFRDL1(Ferric reductase defective like1),主要在根部表达,但表达水平既不受缺铁也不受铝毒害的影响。敲除OsFRDL1 会导致植株叶片失绿,铁含量降低,锌和锰的含量增加[82-83]。金属硫蛋白(MTs)是一种富含半胱氨酸的蛋白质,参与了金属的动态平衡和解毒作用[84-85]。Lei等[86]研究发现OsMT2b和OsMT2c在水稻节间高表达,分别敲除这两个基因会导致节间锌的积累,但籽粒中锌含量降低,说明OsMT2b 和OsMT2c 在锌的分配中有着重要作用。OsYSL6、OsYSL8、OsYSL14、OsNRAMP1、OsNRAMP7、OsNRAMP8、OsNAS1、OsFRO1和OsNAC5在水稻剑叶中的表达量和籽粒中锌或铁含量显著相关[87]。
3 分子调控机制
3.1 bZIP-ZIP调控模块
转录因子(Transcription factor,TF)也称反式作用因子,可以调控基因的转录。转录因子通过调控下游相关基因来适应环境的变化。目前在动植物体内发现了多个转录因子家族,其中bZIP转录因子存在于所有真核生物当中[88]。水稻中bZIP转录因子有89个,其中F 亚家族包括3 个成员,OsbZIP48、OsbZIP49 和OsbZIP50[89]。OsbZIP48定位在细胞核,在细胞质中也有部分表达,其功能缺失会使植株对缺锌更敏感[89]。通过转录组测序发现,OsbZIP48 突变使OsZIP4 和OsZIP8 表达下调,从而影响了水稻中锌的转运[88]。Lilay 等[90]研究发现,过表达OsbZIP48 和OsbZIP50 能恢复bzip19bzip23双突变体的缺锌敏感表型双突变体表型。在拟南芥中,AtbZIP19 和AtbZIP23 通过结合ZIP 转运体基因启动子区中的缺锌反应元件ZDRE(Zinc deficiency response element)来参与植物对缺锌的耐受性和锌累积的调控过程[91]。在不同物种的ZIP转运体中,ZDRE 基序有着高度的保守性[92]。Lilay 等通过酵母单杂交文库的筛选和EMSA 实验证明,OsbZIP48 和OsbZIP49 也可以结合ZDRE 基序。而酵母单杂交文库筛选中并未发现OsbZIP50,可能的原因是OsbZIP50主要在根中表达,而酵母单杂交文库筛选所用的cDNA文库来源于水稻地上部,因此OsbZIP50是否能结合ZDRE基序需要进一步的实验验证[90]。此外,在对ZIP转运体基因的启动子区序列分析中发现,OsZIP4、OsZIP8和OsZIP10的启动子区不仅存在完整的ZDRE 基序,也存在个别碱基替换的类型[90]。这一结果暗示着bZIP 转录因子可能也与个别碱基替换的ZDRE基序结合调控。
3.2 NAC-ZIP调控模块
NAC 转录因子是植物特有的转录因子中最大的家族之一,在离子稳态的调节中也发挥着重要作用。在水稻中,NAC 转录因子影响根的发育、水稻的品质和产量,在应对生物胁迫和非生物胁迫等方面起着重要作用[93]。OsNAC15定位在细胞核上,其表达受缺锌和过量锌的抑制[94]。敲除OsNAC15 降低水稻对缺锌的耐受性,且根部和地上部锌含量减少。进一步生化实验结果发现,OsNAC15 能和OsZIP7 和OsZIP10 的启动子直接结合并对其转录负调控。通过酵母单杂实验发现,OsNAC15可以和ZDRE基序结合,说明ZIP基因启动子中的ZDRE 基序不仅可以bZIP 转录因子结合,也可以被NAC 类型的转录因子所结合。此外,还发现OsNAC15 也可以与不含ZDRE 基序的ZIP 基因启动子片段结合,表明启动子区可能还存在着其他顺式元件被OsNAC15结合[94]。
综上所述,水稻F-bZIP 家族成员和OsNAC15 可以结合含有完整或个别碱基替换的ZDRE 基序,表明完整或个别碱基替换的ZDRE基序可能在缺锌调控机制中具有一定的保守性。因此,本研究对与锌相关转运体基因的启动区序列进行分析。如表2 所示,在OsZIP5、OsZIP7、OsZIP9 和OsZIP10 中含有完整的ZDRE基序,所有基因里面含有最多的4个ZDRE基序的基因是OsHMA1,OsZIP8、OsZIP10 和OsVIT1 含有3个ZDRE基序,这些启动子区含有ZDRE基序较多的基因可以在后续bZIP-ZIP 和NAC-ZIP 调控模块的验证中作为重点候选靶基因。
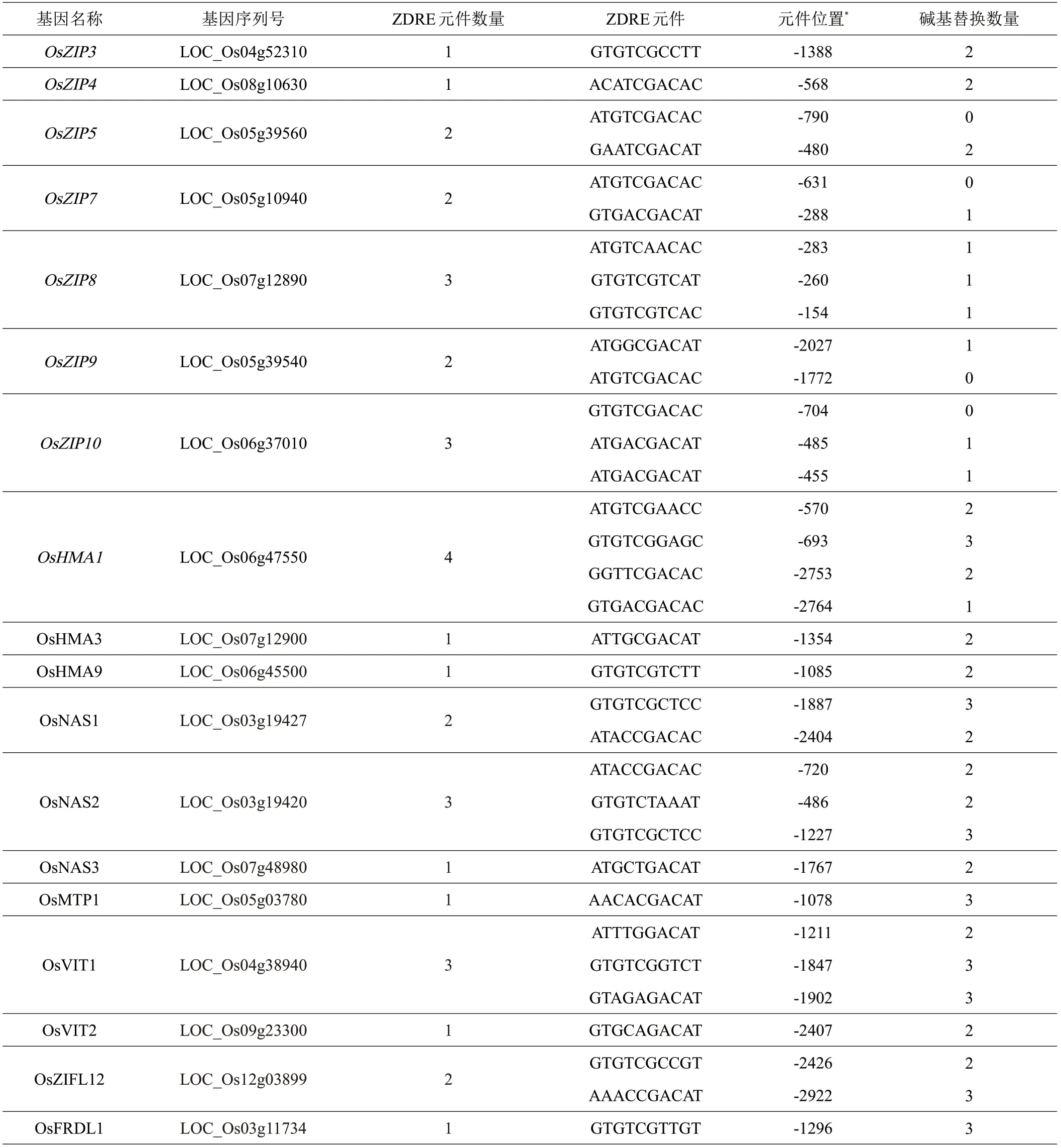
表2 转运体基因启动子区中ZDRE基序的分析
3.3 RR-ZIP调控模块
细胞分裂素作为重要的生长调节剂影响着植物生长发育的各个阶段,其活性受环境因素的影响[95]。植物反应调控因子RR(response regulator)参与细胞分裂素信号调控,目前在水稻中发现了7个A型RR和5个B 型RR 基因[96-97]。Gao 等[98]研究发现,OsZIP1 和OsZIP5的表达受细胞分裂素的负调控,且它们的启动子区中存在细胞分裂素响应元件RR。酵母单杂交和双荧光素酶报告系统检测实验中发现,OsRR22 蛋白可以直接与OsZIP1 和OsZIP5 基因的启动子结合,并促进其表达。这些结果表明,缺锌条件下,细胞分裂素的合成减少,OsRR22 上调表达,影响ZIP 家族基因的表达,从而提高了籽粒锌含量。此外,细胞分裂素也抑制了NAS和HMA家族基因的表达。
与bZIP 和NAC 转录因子不同的是,RR 类型的转录因子通过结合RR 响应元件来直接调控ZIP 转运体基因的表达[98]。这一结果表明,转运体启动子区中的RR响应元件可被RR转录因子结合,参与由细胞分裂素介导的缺锌耐性和籽粒锌含量累积的调控过程。因此,本研究对锌相关转运体基因启动子区中的RR 响应元件进行了分析。如表3 所示,其中OsZIP3、OsZIP9 和OsHMA2 最多含有8 个RR 元件,这些基因可以作为后续验证的重点候选基因。
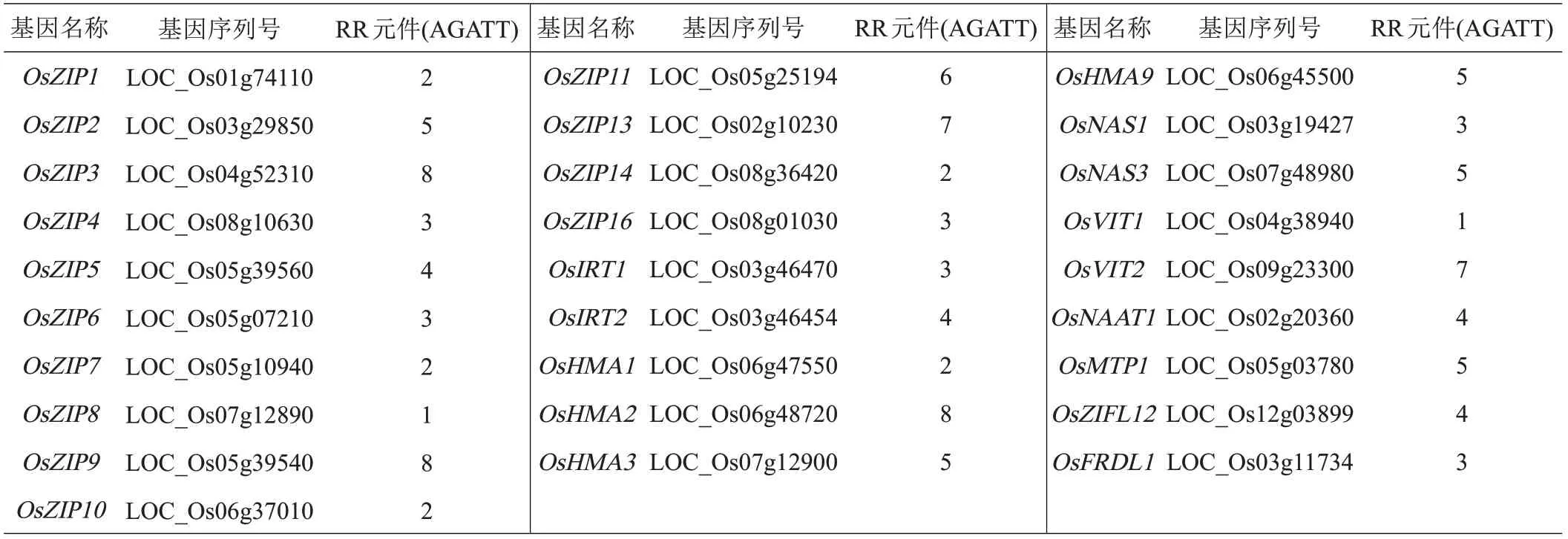
表3 转运体基因启动子区中RR响应元件的分析
综上所述,OsbZIP48、OsbZIP49和OsNAC15可以通过结合ZIP家族基因启动子中的ZDRE序列来调控其转录,调节水稻对锌缺乏的耐性。细胞分裂素相关转录因子OsRR22 可以通过结合RR 响应元件激活OsZIP1和OsZIP5的转录,抑制NAS和HMA家族基因的表达,调节水稻内锌的吸收、转运和分配,影响籽粒锌含量的累积(图1)。

图1 转录因子介导的锌缺乏调控模式图
4 展望
由于目前植物和人类缺锌是全球面临的十分严重的问题,提高作物缺锌胁迫耐受性,提高籽粒中锌含量至关重要。研究转运体基因对锌的吸收、转运和分配及其在籽粒中累积的规律,可为富锌水稻的培育提供理论基础。目前虽然已经鉴定了诸多锌的转运体家族成员,并对其功能和分子机制有初步的解析,但土壤中锌向不同器官、组织、细胞和细胞器转运的分子机制尚不明确。例如,锌外流转运体的吸收、木质部的负载和分配如何实现还尚未明确。在细胞内,锌被运输到不同的器官,如叶绿体和内质网,以实现各种功能,但实现这一过程的转运体仍然不清楚。此外,锌转运蛋白的调节和锌响应的分子机制也需要在转录、翻译和翻译后水平上进行研究。目前对多个锌转运体协同调控的研究较少,现有发现的锌转运体家族中也有许多未被深入研究的成员。对于目前已经验证过的转录因子介导的锌缺乏调控机制,对其他含有相同元件的基因是具有相同的调控作用尚未被验证。转录因子是直接接收缺锌信号,还是通过接收上游其他蛋白(如蛋白激酶)传递的信号来参与锌缺乏耐性和籽粒累积,还有待进一步的研究。因此,未来可以对转运体家族基因中锌元素吸收、转运和分配的生理机制,土壤中锌向不同器官、组织、细胞和细胞器转运的分子机制,以及转运体基因启动子区含有锌调控相关元件基因的调控机制进行深入研究,以期为富锌水稻种质的创制提供理论依据。

