缺锌胁迫对水稻叶绿体抗氧化系统的影响*
陈文荣, 陈雅彬, 陈 莉, 张常晶, 黄志恒, 孙培蓓
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
锌是生物体不可缺少的微量元素之一[1],在核酸合成、基因表达、细胞生长等过程中起着至关重要的作用.植物中缺锌会阻碍植株的生长发育,导致产量和品种质量下降.水稻(OryzasativaL.)作为重要的栽培粮食作物,对锌元素极为敏感,一旦缺锌,会引起水稻叶片失绿发白、根系老化、分蘖减少、植株矮小、生长停滞等现象,从而严重影响水稻的产量和口感[2].
缺锌会直接或间接地影响SOD及AsA-GSH循环中相关酶的活性,从而限制对活性氧的清除.缺锌条件下,不同物种的植物均表现出活性氧簇(ROS)的积聚及氧化胁迫的加剧,但抗氧化系统在不同物种间的表现不尽相同.水稻受缺锌胁迫后,叶内ROS含量上升、膜脂过氧化加剧,叶绿体超微结构受损明显,同时光合速率及荧光参数均显示缺锌对水稻光系统破坏严重[3],但这种损伤是否与ROS的氧化胁迫相关仍缺乏直接的实验证据.另外,作为产生ROS的主要细胞器,水稻叶绿体中ROS的浓度、抗氧化系统的抗氧化能力在缺锌胁迫下的动态变化亦需要进一步深入研究.
本文以水稻品种日本晴(Nipponbare)为材料,利用水培法进行不同程度的缺锌处理,研究了水稻叶绿体中活性氧代谢水平、膜脂过氧化程度及抗氧化物质(AsA和GSH)含量、SOD和AsA-GSH循环中相关酶(APX,GR等)活性在缺锌胁迫中的动态变化,以期揭示缺锌胁迫下水稻叶绿体中抗氧化系统在防御氧化损伤中的响应机制.
1 材料与方法
1.1 实验设计
1.1.1 植物培养
实验材料为水稻品种日本晴.种子经75%乙醇溶液消毒后,浸种2 d,37 ℃下催芽,挑选出芽较好且一致的种子移栽在96孔板上,放入温室内(光照14 h/黑暗10 h,白天28 ℃ /夜晚24 ℃,相对湿度75%,光照强度2 000 lx)用蒸馏水培养,2周后水稻用营养液培养[13],营养液pH 5.5.
1.1.2 缺锌处理
待水稻长至三叶期进行缺锌处理.设计3个锌处理组,即足锌、潜在缺锌及严重缺锌,其锌浓度分别设置为1.0×10-6,1.0×10-10和0 mol/L.锌处理时间为20 d.
1.2 实验方法
1.2.1 叶绿体的制备
待水稻处理完后,取地上部,通过差速离心法制备粗叶绿体制品,分别利用蔗糖密度梯度离心法和Percoll梯度离心法进一步分离纯化完整的叶绿体.缓冲溶液(0.05 mol/L磷酸盐,5 mmol/L乙二胺四乙酸,pH 7.8)悬浮叶绿体,用于测定抗坏血酸(AsA)和谷胱甘肽(GSH)的含量,以及超氧化物歧化酶(SOD,EC 1.15.1.1)、抗坏血酸过氧化物酶(APX,EC 1.11.1.11)、谷胱甘肽还原酶(GR,EC 1.6.4.2)、脱氢抗坏血酸还原酶(DHAR,EC 1.8.5.1)和单脱氢抗坏血酸还原酶(MDHAR,EC 1.6.5.4)的活性.
1.2.2 水稻根和叶中锌含量的测定
水稻处理好后,取根和叶,于65 ℃烘干研磨后,取0.1 g加8 mL硝酸和1 mL高氯酸,常温静置过夜,然后消解.样品消解后用超纯水定容至50 mL,过滤后用电感耦合等离子质谱仪ICP-MS(Agilent,7500a)测定Zn元素的含量[14].
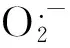

1.2.4 丙二醛(MDA)含量的测定
用硫代巴比妥酸(TBA)比色法测定MDA含量.50 mg叶绿体样品用80%乙醇溶液溶解,超声波裂解,4 ℃ 3 000 r/min离心10 min,沉淀重新提取2次.稀释一定倍数,加入等体积的100 g/L三氯乙酸(TCA)溶液,4 000 r/min离心10 min,上清液为样品提取液[15].取提取液2 mL(空白加入等量的重蒸馏水),加入2 mL 5 g/L TBA溶液混匀,沸水浴20 min,迅速冷却离心10 min,测定A532 nm和A600 nm的值.
1.2.5 AsA和GSH含量的测定
取叶绿体悬浮液1 mL,加入1.5 mL重蒸馏水,2.5 mL 50 g/L TCA溶液,混匀,4 000 r/min离心,上清液用于测定AsA和GSH的含量.
取0.1 mL上清液,加0.7 mL 75 mmol/L NaH2PO4溶液(pH 7.4),再加0.2 mL 100 g/L TCA溶液,0.2 mL 440 g/L H3PO4溶液,0.2 mL 40 g/L 2,2-二联吡啶溶液和0.1 mL 30 g/L FeCl3溶液,37 ℃反应1 h,测定A525 nm的值,根据AsA的标准曲线,计算AsA的含量[16].
取0.1 mL上清液,加1.3 mL 150 mmol/L NaH2PO4溶液(pH 7.2)和0.1 mL 5,5′-二硫代双(2-硝基苯甲酸),30 ℃保温5 min,测定A412 nm的值.根据GSH的标准曲线,计算GSH的含量[17].
1.2.6 SOD活性的测定
SOD活性采用氮蓝四唑(NBT)光还原法测定.取0.05 mL酶液,加3 mL反应液(1.3 μmol/L 核黄素,13 mmol/L甲硫铵酸,63 μmol/L NBT,100 μmol/L EDTA和0.5 mol/L pH 7.8磷酸盐)混匀后,于光强4 000 lx下反应15 min,测A560 nm的值,以缓冲液代替酶液作空白,以抑制氮蓝四唑光化还原的50%为1个酶活单位[18].
1.2.7 APX活性的测定
APX活性的测定参照文献[19]的方法,取3 mL反应液(0.5 mmol/L AsA,0.1 mmol/L EDTA,0.1 mmol/L H2O2,0.05 mol/L pH 7.0磷酸盐)和0.1 mL酶液,将30%H2O2溶液稀释500倍,加15 μL至3 mL反应体系中启动反应,测定A290 nm的值,记录1 min内的变化.抗坏血酸的消光系数为2.8 mmol/(L-15cm-1),以1 min氧化1 μmol抗坏血酸的酶量为1个酶活单位.
1.2.8 GR活性的测定
依照文献[20]的方法并适当修改,即反应体系中依次加2.46 mL 1 mmol/L氧化型谷胱甘肽(GSSG)溶液,0.24 mL 2 mmol/L还原型辅酶Ⅱ(NADPH.溶于磷酸缓冲液,pH 7.6)和0.3 mL酶提取液,以重蒸馏水代替GSSG溶液作空白对照,测定A340 nm的值,记录3 min内的变化.NADPH的消光系数为6.2 mmol/(L-15cm-1),以1 min催化还原1 nmol谷胱甘肽的酶量为1个酶活单位.
1.2.9 DHAR活性的测定
采用紫外分光光度法测定DHAR的活性.在反应体系中依次加入2.1 mL 50 mmol/L EDTA溶液,0.3 mL 2 mmol/L脱氢抗坏血酸(DHA)溶液,0.3 mL 2 mmol/L GSH溶液和0.3 mL酶提取液,测定A265 nm的值,记录3 min内的变化(消光系数为14 mmol/(L-15cm-1))[21].
1.2.10 MDHAR活性的测定
采用紫外分光光度法测定MDHAR活性.反应体系中依次加入2.49 mL 2 mmol/L AsA溶液(磷酸缓冲液,pH 7.0),0.06 mL 2 mmol/L APX溶液(磷酸缓冲液,pH 5.6),0.15 mL 2 mmol/L NDAPH溶液(磷酸缓冲液,pH 7.6)和0.3 mL酶提取液,测定A340 nm的值,记录3 min内的变化(消光系数为6.2 mmol/(L-15cm-1))[21].
1.3 数据分析
每一处理进行3次生物性重复和3次实验性重复.数据统计和显著性分析分别用Excel和SPSS 17.0软件,用SigmaPlot 10.0软件作图.
2 结果与分析
2.1 缺锌胁迫下水稻不同部位的锌含量
为检测水稻根部和叶部锌营养的实际状态,分析了不同缺锌处理下根和叶中的锌含量.如图1所示,随缺锌处理的加重,水稻根部及叶部的锌含量显著降低.根部,潜在缺锌处理和严重缺锌处理后的锌含量分别只有对照的19/50和7/25.叶部,各处理下锌含量分别是40.8,15.6和10.6 mg/kg.另外,在不同缺锌处理下,根部的锌含量均比叶内高,但两者的变化趋势是一致的.
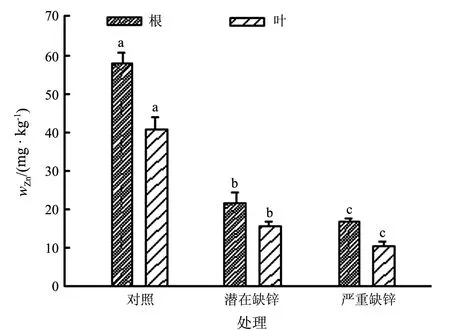
不同小写字母表示根和叶各处理间在P<0.05水平上差异显著图1 不同缺锌条件下水稻根和叶锌含量的变化
2.2 缺锌胁迫下水稻叶绿体内H2O2和的相对含量

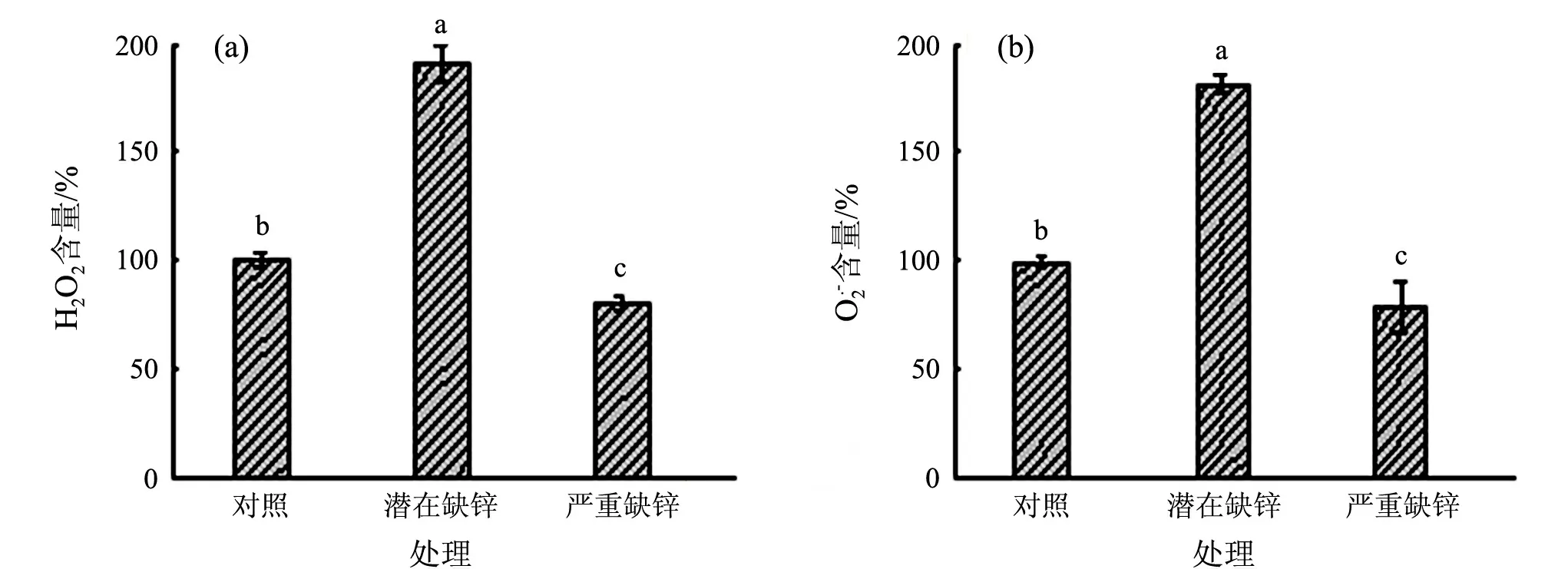
对照的含量设为100%.不同的英文小写字母表示各处理间在P<0.05水平上差异显著图2 缺锌对水稻叶绿体内过氧化氢和超氧阴离子自由基相对含量的影响
2.3 缺锌胁迫下水稻叶绿体内的MDA含量
丙二醛(MDA)是植物器官膜脂过氧化最重要的产物之一,其含量高低能说明膜脂过氧化程度的大小[22].如图3所示:相较于对照,潜在缺锌条件下,水稻叶绿体内MDA含量虽有所上升,但未呈现出显著性差异;在严重缺锌处理下,水稻叶绿体中MDA含量达3.64 nmol/mg,较对照增加了76.70%.
2.4 缺锌胁迫下水稻叶绿体内AsA和GSH的含量
抗坏血酸(AsA)几乎存在于所有的组织中,一般是在需氧的光合细胞和果实中含量较高,是一种非酶类的自由基清除剂.如图4所示,随着缺锌程度的增加,AsA含量先升高再降低,其中潜在缺锌条件下叶绿体AsA含量较对照升高了19.9%,而严重缺锌下叶绿体内AsA含量较对照

图3 缺锌对水稻叶绿体内MDA含量的影响
降低了21.0%.但脱氢抗坏血酸(DHA)与AsA的变化趋势相反.潜在缺锌处理下DHA含量显著降低,较对照降低了34.5%;而严重缺锌处理下DHA含量与对照无显著性差异.
叶绿体中谷胱甘肽(GSH)含量随缺锌程度的增加而不断下降.对照植株GSH含量分别比潜在缺锌和严重缺锌处理的多0.29倍和1倍.氧化型谷胱甘肽(GSSG)含量在对照、潜在缺锌和严重缺锌条件下分别是0.34,0.35和0.49 μmol/mg.
AsA/DHA和GSH/GSSG是植物细胞中相互关联的重要的氧化还原对,它们的含量比能反映细胞内氧化还原的状态[23].本研究中,AsA/DHA的含量比随着缺锌程度的增加而先增加后降低,但GSH/GSSG的含量比随着缺锌程度的增加不断降低.

图4 缺锌对水稻叶绿体内抗坏血酸和谷胱甘肽含量的影响
2.5 缺锌胁迫下水稻叶绿体内SOD的活性
从图5可见,潜在缺锌处理下叶绿体内SOD活性较对照有所上升,而严重缺锌下该酶活性急剧下降.对照、潜在缺锌和严重缺锌处理下叶绿体内SOD活性分别为152.44,181.89和76.13 U/mg.相较于对照,潜在缺锌处理下叶绿体内SOD活性上升了19.32%,严重缺锌处理的下降了50.06%.

图5 缺锌对水稻叶绿体内SOD活性的影响
2.6 缺锌胁迫下水稻叶绿体内APX的活性
在AsA-GSH循环系统中, 抗坏血酸过氧化物酶(APX)以AsA为电子供体催化H2O2的还原.图6显示的是在缺锌胁迫下水稻叶绿体内APX活性的变化,该酶活性的变化趋势与SOD相似,在潜在缺锌处理下APX活性最高,达374.09 U/mg,而严重缺锌处理的较对照的APX活性下降了40.27%.
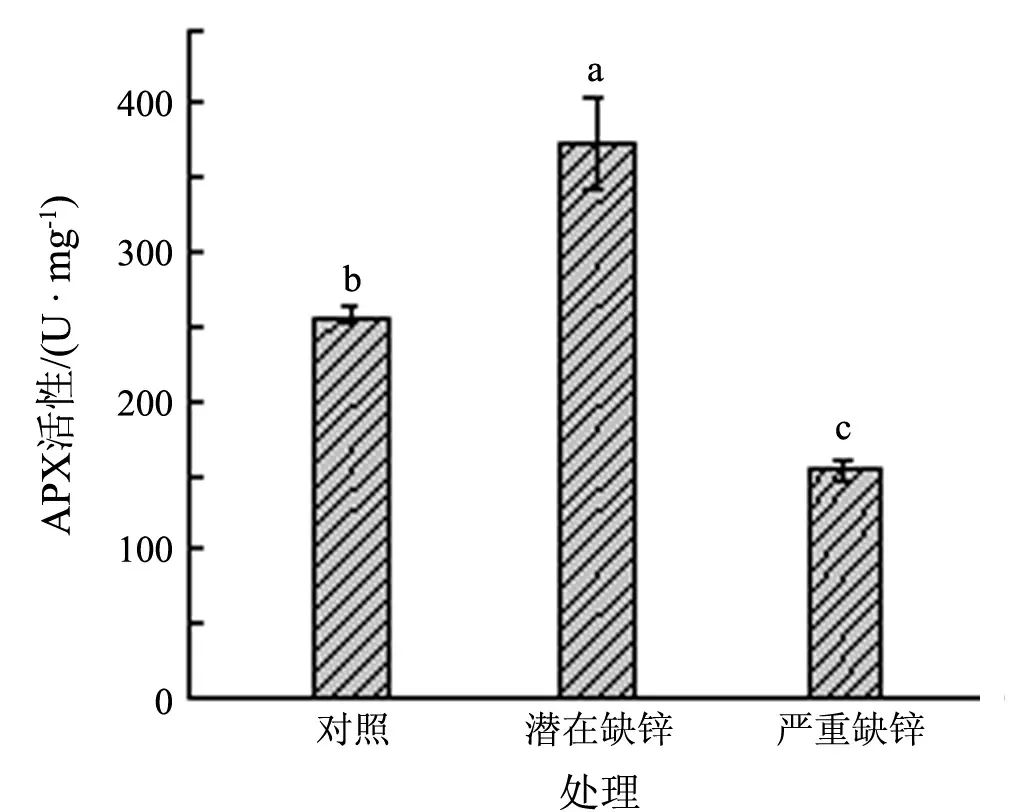
图6 缺锌对水稻叶绿体内APX活性的影响
2.7 缺锌胁迫下水稻叶绿体内GR的活性
谷胱甘肽还原酶(GR)是一种黄素蛋白氧化还原酶[24],当植物受氧化胁迫时,活性氧能将GSH氧化成GSSG,GSSG又能在GR的催化下利用NADPH的电子将GSSG还原为GSH.如图7所示:潜在缺锌处理下叶绿体内GR活性最高,达到110.67 U/mg,是对照的2倍多;而严重缺锌处理下叶绿体内GR活性与对照相比无显著性差异.

图7 缺锌对水稻叶绿体内GR活性的影响
2.8 缺锌胁迫下水稻叶绿体内MDHAR的活性
单脱氢抗坏血酸还原酶(MDHAR)是AsA-GSH循环中再生AsA的重要酶.随着缺锌程度的增加,MDHAR的活性先升高后显著下降.对照的MDHAR活性是163.64 U/mg,潜在缺锌处理的比其活性升高了40.18%,而严重缺锌处理的MDHAR活性下降了83.71%(见图8).

图8 缺锌对水稻叶绿体内MDHAR活性的影响
3 讨 论
锌在水稻的生长发育中至关重要,可增加植物体内的叶绿素含量,催化叶绿素的光合作用,间接影响生长素的合成,在维持细胞膜的完整性等方面起作用.目前普遍认为,缺锌对植物造成损伤的根本原因在于锌缺乏使植物体内的活性氧自由基过量积累,进而破坏植物细胞的关键结构和重要成分[9].在正常生长条件下,植物体内活性氧浓度不高,并能及时被植物自身的抗氧化系统清除,从而使活性氧的产生和清除一直处于动态平衡状态,避免了植物的损伤[25].但是,一旦活性氧的量超过了植物正常所能承受的阈值后,就会打破细胞内氧化还原状态的平衡,从而引发氧化胁迫伤害.
叶绿体是植物进行光合作用的场所,是产生活性氧的主要细胞器.缺锌能引起光合反应电子传递过程中超氧自由基的产生[26],过量积累的活性氧自由基将对叶绿体类囊体膜造成严重伤害[27],进而破坏叶绿体的结构和功能.本研究中活性氧在潜在缺锌处理下产生的量最多,说明植物受到了一定的氧化胁迫;严重缺锌处理下可能是过度的膜脂氧化对植物细胞造成了不可逆的损伤和破坏,甚至使细胞死亡,因此活性氧含量低于对照.同样,MDA检测中发现,在严重缺锌处理中其含量最高,说明水稻叶绿体膜脂过氧化程度高,损伤程度大.

AsA-GSH循环系统是植物体内清除活性氧自由基的重要途径,该循环实质上由2个小循环构成,即AsA与MDHA之间的循环和GSH与GSSG之间的循环.其中,AsA和GSH是AsA-GSH循环中2种重要的非酶促抗氧化物质,它们能直接与活性氧反应使其还原,或作为相应酶的底物在活性氧清除过程中扮演重要的角色,通常两者相互偶联起作用(见图9).AsA被氧化时会形成
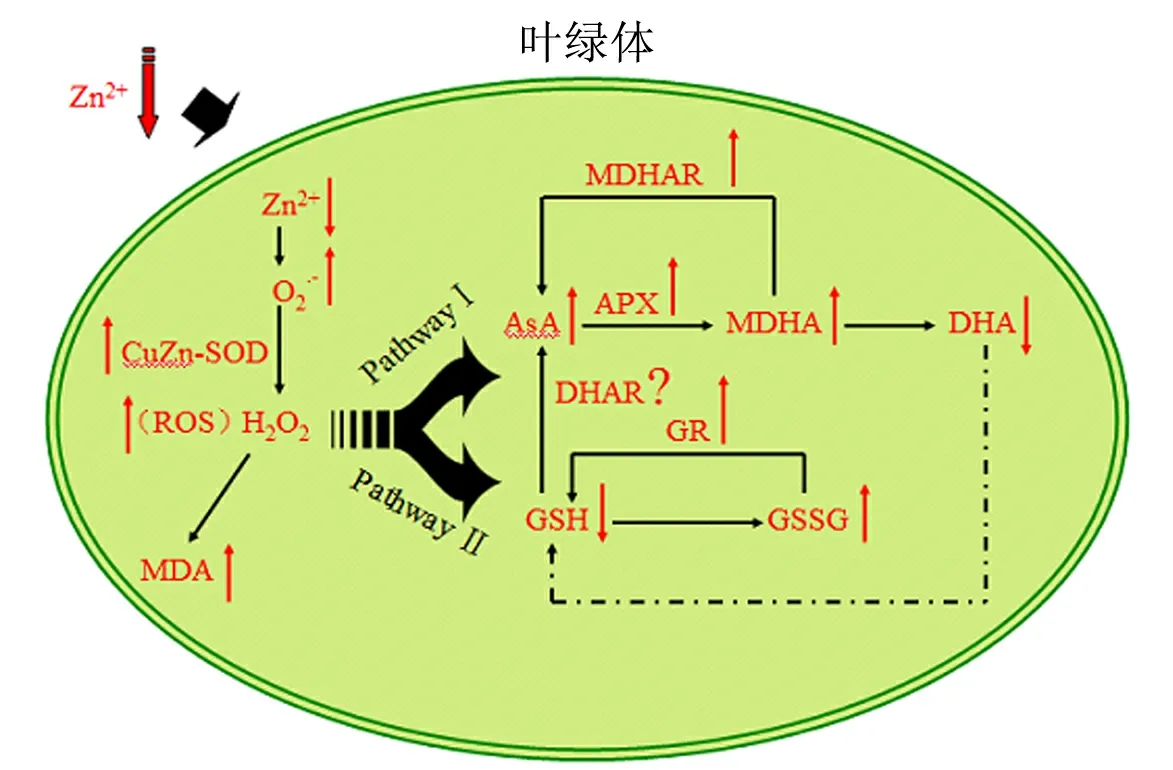
图9 潜在缺锌胁迫下水稻叶绿体AsA-GSH循环模式图
MDHA,MDHA很不稳定,又会进一步氧化形成DHA,DHA在DHAR作用下又可以再生成AsA.GSH因其结构上存在巯基,使其成为细胞内强有力的还原剂,而氧化态的GSSG在GR的作用下能够形成还原态的GSH.本研究中,在潜在缺锌条件下,AsA含量显著上升,而DHA含量呈相反的趋势,这可能是水稻应对缺锌胁迫引发的ROS积聚的一种应对反应(见图4(a)和(b));而GSH含量随着缺锌程度的加重呈现递减趋势,可能是由于细胞内大量的GSH用于各种活性氧的解毒过程,从而导致GSSG的含量递增(见图4(c)和(d)).另外,AsA/DHA和GSH/GSSG的含量比能反映细胞内氧化还原的状态,与植物响应逆境胁迫紧密相关,植物体内较高的AsA/DHA和GSH/GSSG的含量比有利于提高AsA-GSH循环的效率,减轻不良条件造成的氧化胁迫[32].本研究中,AsA/DHA含量比呈现先上升后下降的趋势(见图4(e)),说明在潜在缺锌处理时,叶绿体内通过加快AsA的合成,使抗坏血酸库中还原型抗坏血酸占优势,从而增强抗逆性.这与桑树[33]中受缺锌影响得到的结果类似:AsA随锌浓度的降低先增加后下降,AsA/DHA含量比也是潜在缺锌状态下达最高值.另外,本研究中发现,潜在缺锌和严重缺锌处理下GSH/GSSG含量比都小于对照(见图4(f)),表明GSH和GSSG小循环随着缺锌程度的增加运作效率降低.但水稻在缺镁胁迫下GSH含量和GSH/GSSG含量比均出现显著上升的变化[34].可见,AsA-GSH循环的变化复杂,不同物种对不同胁迫的应对机制不同.
作为叶绿体中能有效分解H2O2的重要酶之一,APX先与H2O2形成中间复合物,接着以AsA为底物氧化形成MDHA和H2O.本实验中,1.0×10-10mol/L锌处理的水稻叶绿体中APX活性高于对照,而且高活性的APX与高含量的AsA的作用是一致的.说明潜在缺锌处理使叶绿体中的AsA含量足以维持APX的活性,甚至可能与高浓度的活性氧共同刺激APX活性升高.APX活性的适应性升高同样出现在缺锌处理下的红球甘蓝[35]中.但APX对环境的胁迫非常敏感,严重缺锌处理导致APX活性急剧下降(见图6).MDHA可以在MDHAR作用下重新生成AsA.MDHAR的活性随着缺锌程度的增加呈现先升高后下降的趋势(见图8).严重缺锌处理下叶绿体内MDHAR活性较对照下降了83.71%,该酶活性急剧下降导致将MDHA还原成AsA的反应速率下降,使得MDHA氧化成DHA的反应增加,这与AsA/DHA含量比变化的结果相符(见图4(e)).但本研究中未能在水稻叶绿体中检测到DHAR的活性,可能是叶绿体中GSH循环与AsA循环偶联作用小,靠GSH协同DHAR还原DHA生成AsA成分少.
在植物体内,GR能使谷胱甘肽库保持在还原状态,AsA-GSH循环中GSSG通过GR还原.本研究中,GR活性与APX活性的变化相似,严重缺锌处理下叶绿体内GR活性与对照相当,而潜在缺锌处理下叶绿体内GR活性是对照的2倍多.GR活性高使得GSSG的还原速度加快,有利于抵御ROS的毒害.Frei等[31]对水稻受土壤缺锌影响时的抗氧化系统进行了研究,发现3种基因型的水稻(RIL46,IR74和RIL76)GR活性都极显著上升,表明GR作为GSH循环中的关键酶,在水稻应对缺锌胁迫中发挥着重要作用.
综上所述,本研究结果表明,在潜在缺锌胁迫下,水稻叶绿体内的活性氧含量升高,使得SOD,APX,GR和MDHAR的活性增加,说明植株通过增加抗氧化酶的活性来缓解外界环境产生的刺激及建立自我保护机制;另外,植株通过调节AsA-GSH循环中抗氧化物质的水平来适应逆境环境.但是,随着缺锌程度的加深,抑制了很多酶的活性,降低了植株的自我保护能力,加剧了膜脂过氧化的程度,甚至导致细胞死亡.
参考文献:
[1]虞银江,廖海兵,陈文荣,等.水稻吸收,运输锌及其籽粒富集锌的机制[J].中国水稻科学,2012,26(3):365-372.
[2]Wissuwa M,Ismail A M,Yanagihara S.Effects of zinc deficiency on rice growth and genetic factors contributing to tolerance[J].Plant Physiology,2006,142(2):731-741.
[3]Chen Wenrong,Yang Xiaoe,He Zhenli,et al.Differential changes in photosynthetic capacity,77 k chlorophyll fluorescence and chloroplast ultrastructure between Zn-efficient and Zn-inefficient rice genotypes (Oryzasativa) under low zinc stress[J].Physiologia Plantarum,2008,132(1):89-101.
[4]罗娅,汤浩茹,张勇.低温胁迫对草莓叶片SOD和AsA-GSH循环酶系统的影响[J].园艺学报,2007,34(6):1405-1410.
[5]Munns R,Tester M.Mechanisms of salinity tolerance[J].Annu Rev Plant Biol,2008,59:651-681.
[6]Lovelock C E,Winter K.Oxygen-dependent electron transport and protection from photoinhibition in leaves of tropical tree species[J].Planta,1996,198(4):580-587.
[7]Wang Hongchang,Jin Jiyun.Photosynthetic rate,chlorophyll fluorescence parameters,and lipid peroxidation of maize leaves as affected by zinc deficiency[J].Photosynthetica,2005,43(4):591-596.
[8]Alscher R G,Erturk N,Heath L S.Role of superoxide dismutases (SODs) in controlling oxidative stress in plants[J].Journal of Experimental Botany,2002,53(372):1331-1341.
[9]Cakmak I.Possible roles of zinc in protecting plant cells from damage by reactive oxygen species[J].New Phytologist,2000,146(2):185-205.
[10]王俊力,王岩,赵天宏,等.臭氧胁迫对大豆叶片抗坏血酸-谷胱甘肽循环的影响[J].生态学报,2011,31(8):2068-2075.
[11]Noctor G,Foyer C H.Ascorbate and glutathione:keeping active oxygen under control[J].Annual Review of Plant Biology,1998,49(1):249-279.
[12]Potters G,Horemans N,Bellone S,et al.Dehydroascorbate influences the plant cell cycle through a glutathione-independent reduction mechanism[J].Plant Physiology,2004,134(4):1479-1487.
[13]Yang Xiaoe,Römheld V,Marschner H,et al.Application of chelator-buffered nutrient solution technique in studies on zinc nutrition in rice plant (OryzasativaL.)[J].Plant and Soil,1994,163(1):85-94.
[14]陈莉,吴超,廖海兵,等.不同锌效率基因型水稻籽粒中矿质元素的原位微区分布研究[J].中国水稻科学,2012,26(6):706-714.
[15]Munné-Bosch S,Alegre L.Plant aging increases oxidative stress in chloroplasts[J].Planta,2002,214(4):608-615.
[16]Tanaka K,Suda Y,Kondo N,et al.O3tolerance and the ascorbate-dependent H2O2decomposing system in chloroplasts[J].Plant and Cell Physiology,1985,26(7):1425-1431.
[17]华春,王仁雷,刘友良.外源AsA对盐胁迫下水稻叶绿体活性氧清除系统的影响[J].作物学报,2004,30(7):692-696.
[18]Beyer Jr W F,Fridovich I.Assaying for superoxide dismutase activity:some large consequences of minor changes in conditions[J].Analytical Biochemistry,1987,161(2):559-566.
[19]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].Plant and Cell Physiology,1981,22(5):867-880.
[21]Cakmak I,Marschner H.Magnesium deficiency and high light intensity enhance activities of superoxide dismutase,ascorbate peroxidase,and glutathione reductase in bean leaves[J].Plant Physiology,1992,98(4):1222-1227.
[22]Belinky P A,Flikshtein N,Dosoretz C G.Induction of lignin peroxidase via reactive oxygen species in manganese-deficient cultures ofPhanerochaetechrysosporium[J].Enzyme and Microbial Technology,2006,39(2):222-228.
[23]May M J,Vernoux T,Leaver C,et al.Glutathione homeostasis in plants:implications for environmental sensing and plant development[J].Journal of Experimental Botany,1998,49(321):649-667.
[24]郑小林,陈燕,敬国兴,等.草酸处理对杧果采后果实AsA-GSH循环系统的影响[J].园艺学报,2011,38(9):1633-1640.
[25]Xu Sheng,Li Jianlong,Zhang Xinquan,et al.Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation,antioxidant metabolites,and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress[J].Environmental and Experimental Botany,2006,56(3):274-285.
[26]Kutman U B,Yildiz B,Ozturk L,et al.Biofortification of durum wheat with zinc through soil and foliar applications of nitrogen[J].Cereal Chemistry,2010,87(1):1-9.
[27]Sasaki H,Hirose T,Watanabe Y,et al.Carbonic anhydrase activity and CO2-transfer resistance in Zn-deficient rice leaves[J].Plant Physiology,1998,118(3):929-934.
[28]Gupta M,Cuypers A,Vangronsveld J,et al.Copper affects the enzymes of the ascorbate-glutathione cycle and its related metabolites in the roots ofPhaseolusvulgaris[J].Physiologia Plantarum,1999,106(3):262-267.
[29]郭天荣,姚鹏程,张子栋,等.铝毒和低磷胁迫下水稻幼苗抗氧化系统的响应[J].中国水稻科学,2013,27(6):653-657.
[30]Palma J M,Jiménez A,Sandalio L M,et al.Antioxidative enzymes from chloroplasts,mitochondria,and peroxisomes during leaf senescence of nodulated pea plants[J].Journal of Experimental Botany,2006,57(8):1747-1758.
[31]Frei M,Wang Yunxia,Ismail A M,et al.Biochemical factors conferring shoot tolerance to oxidative stress in rice grown in low zinc soil[J].Functional Plant Biology,2010,37(1):74-84.
[32]单长卷,韩蕊莲,梁宗锁.黄土高原冰草叶片抗坏血酸和谷胱甘肽合成及循环代谢对干旱胁迫的生理响应[J].植物生态学报,2011,35(6):653-662.
[33]Kumar T R,Kumar P,Nand S P.Morphology and physiology of zinc-stressed mulberry plants[J].Journal of Plant Nutrition and Soil Science,2008,171(2):286-294.
[34]Chou Tingshao,Chao Yunyang,Huang W D,et al.Effect of magnesium deficiency on antioxidant status and cadmium toxicity in rice seedlings[J].Journal of Plant Physiology,2011,168(10):1021-1030.
[35]Hajiboland R,Amirazad F.Growth,photosynthesis and antioxidant defense system in Zn-deficient red cabbage plants[J].Plant Soil Environ,2010,56(5):209-217.

