拟南芥网格蛋白重链突变体的遗传分析*
潘建伟, 姜 楠, 王 超, 严 旭
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
网格蛋白是一类进化上高度保守的蛋白复合体,在动物和酵母细胞中已有深入的研究.在动物细胞中,网格蛋白复合体由3条重链(clathrin heavy chains,CHC)和3条轻链(clathrin light chains,CLC)组成,形成一个三脚架结构,一般由36个或60个三脚架复合体进一步形成一个由12个五边形和若干个六边形组成的网格状笼形结构(网格蛋白因此而得名),其中CHC是构成三脚架结构的主要骨架,而CLC具有调控网格蛋白笼型结构组装和拆卸的功能[1-3].目前,已知网格蛋白介导的内吞(clathrin-mediated endocytosis,CME)是动物细胞最重要的内吞途径之一.
已知拟南芥基因组含有2个CHC和3个CLC同源基因[3].文献[4]已经鉴定了拟南芥CLC2和CLC3的生物学功能,发现CLC2和CLC3功能缺失改变了质膜定位的生长素极性输出载体PIN(PIN-FORMED)的内吞、胞内运输和信号传导功能,从而引起多种植物发育表型,表明植物网格蛋白介导的内吞在生长素极性运输和信号传导过程中具有重要的生物学功能.本研究主要分离鉴定了拟南芥网格蛋白重链T-DNA插入突变体chc1和chc2,观察分析了chc单突变体的发育表型,为进一步研究植物网格蛋白介导的内吞的生物学功能奠定基础.
1 材料与方法
1.1 实验材料与生长条件
本研究所用拟南芥(Arabidopsisthaliana)生态型为Col-0(Columbia-0),网格蛋白重链突变体chc1-1(SALK_112213)[4],chc1-2(Cs25142/SALK_103252)[4],chc1-3(SALK_018351),chc1-4(SALK_001652)和chc2-1(SALK_028826)[4],chc2-2(SALK_042321)[4],chc2-3(CS850328/WISCDSLOX289)[4],chc2-4(SALK_059018C)均购自美国俄亥俄州立大学拟南芥生物资源中心(ABRC).
拟南芥种子经表面消毒后,在4 ℃黑暗处理3 d,然后在含1.5%琼脂的1/2MS培养基(Sigma 公司)表面萌发,培养皿竖直放置.生长条件为:24 ℃ 16 h光照/22 ℃ 8 h黑暗,相对湿度为70%~80%,光照强度为80~100 μmol5m-25s-2.萌发5 d后观察幼苗表型.
营养土121 ℃高压灭菌40 min,将生长7 d左右的幼苗转移至土皿中,保鲜膜将幼苗盖住,放置生长室培养2~4 d后去除保鲜膜,培养2周后提取叶片DNA进行聚合酶链式反应(PCR)分析.
1.2 拟南芥DNA的提取
提取生长2周左右植株幼苗的DNA,具体步骤如下:1)剪取拟南芥幼嫩叶片放入1.5 mL离心管中,加入200 μL提取液;2)用磨棒研磨离心管中的叶子,使其变成悬浮液;3)将悬浮液放入65 ℃烘箱中温浴25~30 min,期间温和混匀2~3次;4)加入65 μL醋酸钾溶液,温和混匀,放入-20 ℃冰箱中冰浴5 min;5)加入300 μL氯仿,剧烈混匀,然后12 000 r/min离心8 min;6)将上清液(180 μL)转移到新的1.5 mL离心管中,加入180 μL异丙醇,温和混匀,室温下静置10 min,12 000 r/min离心5 min,弃上清;7)加入800 μL 70%乙醇溶液,充分混匀,室温下静置10 min;8)12 000 r/min离心5 min,弃上清,放入烘箱干燥;9)干燥完成后加入150~200 μL PCR纯净水,然后将其-20 ℃储存.
1.3 纯合体的分离与鉴定
根据拟南芥突变体库(ABRC)提供的T-DNA插入位点,设计了插入载体的引物SALK_LBb1,WisDs-p745和CHC基因上的F端和R端引物(见表1).以野生型(对照)或突变体基因组DNA为模板进行PCR扩增.

表1 引物序列信息
本实验采用的PCR试剂盒为2×TaqMaster Mix(南京博尔迪生物科技有限公司).反应体系为10 μL,包括5.1 μL 2×TaqMaster Mix,F端和R端引物各0.2 μL和1 μL DNA模板.PCR扩增程序为:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸50 s,35个循环;最后72 ℃延伸5 min.
1.4 突变体表型的分析
对野生型、重链突变体chc1和chc2的幼苗子叶表型进行统计分析,照片由OLYmpus体式解剖显微镜获得.
1.5 人工杂交
为制备chc1chc2双突变体,将chc1和chc2突变体进行人工杂交,具体方法如下:1)以花瓣开势良好(花完全展开,呈十字状,雄蕊鲜黄色)的花作为父本,以刚露白(能看到白色花瓣但未展开)的花作为母本;2)用镊子轻轻移去母本的花萼、花瓣和雄蕊(呈微黄色),留下柱头;3)取下父本的雄蕊,在母本花柱头上轻轻擦拭数次,并做好标记;4)1~2 d后,如果母本柱头迅速发育成豆荚则表明杂交成功.
2 结 果
2.1 网格蛋白重链的生物学信息学分析
根据哺乳动物重链氨基酸序列,从拟南芥信息资源网站(TAIR.http://www.arabidopsis.org/)中检索到2个重链基因(见图1),分别被命名为AtCHC1(AT3G11130)和AtCHC2(At3G08530).这两个网格蛋白重链CHC间的氨基酸同源性高达98%,推测它们之间在遗传上存在功能冗余.
在拟南芥信息资源网站突变体库中,CHC1和CHC2基因中均找到4个T-DNA插入株系,具体插入位点如图1所示.重链CHC1的4个突变体chc1-1,chc1-2,chc1-3和chc1-4中,T-DNA的插入位点分别位于第9,24,25和25个外显子上(见图1(a)).在重链CHC2的突变体中,chc2-2和chc2-3的T-DNA插入位点分别位于第25和第5个外显子上,而chc2-1和chc2-4的T-DNA分别插入在第1个内含子和3′-UTR上(见图1(b)).每个CHC基因上都设计3对引物组合:F1+R1,F2+R2和F3+R3(见图1),对相应突变株系进行PCR筛选.

白色和黑色分别代表非编码区和外显子;实线代表内含子箭头代表T-DNA插入位点;箭(F1,F2,F3,R1,R2和R3)代表PCR引物设计位置图1 拟南芥CHC基因结构示意图及T-DNA插入位点
2.2 网格蛋白重链CHC基因T-DNA突变体的鉴定与分离
已知T-DNA标签法只产生35%~40%的突变率[5],通过PCR扩增筛选可获得所需的纯合T-DNA插入株系.当用基因自身引物F+R未能扩增出全长片段,表明突变体中该基因已经被彻底敲除.图2(a)为生物诱变T-DNA插入敲除目的基因的模式图.通过T-DNA插入敲除的方法,可以获得如图2(b)所示的3种基因型:1)野生型(WT),目的基因没有插入T-DNA,其基因功能保持完整,F+R引物组合可扩增出全长(大片段)(见图2(c)),但不能和T-DNA上的引物扩增出小片段;2)杂合型(Het),目的基因的一条DNA链为野生型,另一条链被T-DNA插入,F+R引物组合既能扩增出大片段,又能和T-DNA上的引物扩增出小片段,电泳结果显示产生大小不同的2条带(见图2(c));3)纯合型(Hom),目的基因2条DNA链均被T-DNA插入,该基因被完全敲除,F+R组合无法扩增出全长片段,只能和T-DNA上的引物扩增出小片段(见图2(c)).第3种纯合基因型是本研究所期望的.

P1代表5′端引物;P2代表3′端引物;LBb1代表T-DNA插入引物;WT代表野生型;Het代表杂合型;Hom代表纯合型箭(图(c)中)分别代表了大片段(上)和小片段(下)图2 拟南芥chc突变体PCR筛选
2.3 网格蛋白重链CHC突变体的表型分析
已知网格蛋白轻链CLC功能缺失后可导致多种发育表型缺陷[4],如根变短、下胚轴变长、根的向地性反应迟钝,这些表型与生长素相关的表型缺陷相似[3,6-9].通过PCR分析,chc1和chc2均获得了纯合单突变体.发育表型分析表明,重链CHC功能缺失后也引起部分单突变体植株发育异常,表现出生长素相关的发育表型,如幼苗子叶出现棒状、喇叭状和扇形等各种异常表型(见图3).

A:野生型子叶表型;B-D:单子叶表型(chc1);E:棒状子叶表型(chc2);F和G:喇叭状子叶表型(chc2);H和J:扇形子叶表型(chc2);I:异常双子叶表型(chc2);A-J均为10 d的幼苗;标尺=2 mm图3 拟南芥chc1和chc2突变体发育表型
为分析chc1和chc2各等位突变体的表型缺陷程度,本研究进一步统计分析了各突变体幼苗发育缺陷的百分比.统计分析结果表明,chc2植株发育异常比例明显高于chc1突变体(见表2).在正常条件下培养,chc1-1,chc1-2(见图3中B),chc1-3(见图3中C)和chc1-4(见图3中D)单突变体有发育缺陷的植株分别占0.6%,1.3%,0.6%和0.9%(见表2),主要表现为单子叶表型.而chc2单突变体中除chc2-4仅有0.7%的异常表型外,其余单突变体chc2-1(见图3中E和F),chc2-2(见图3中H和I)和chc2-3的植株发育异常比例高达4.3%,8.0%和4.7%(见表2),并且幼苗子叶出现棒形(见图3中E)、喇叭形(见图3中F和G)、扇形(见图3中H和J)、单子叶和异形双子叶(见图3中I)表型.这些结果表明,CHC1和CHC2的遗传功能存在冗余,但从表型上看似乎CHC2具有更重要的发育功能.
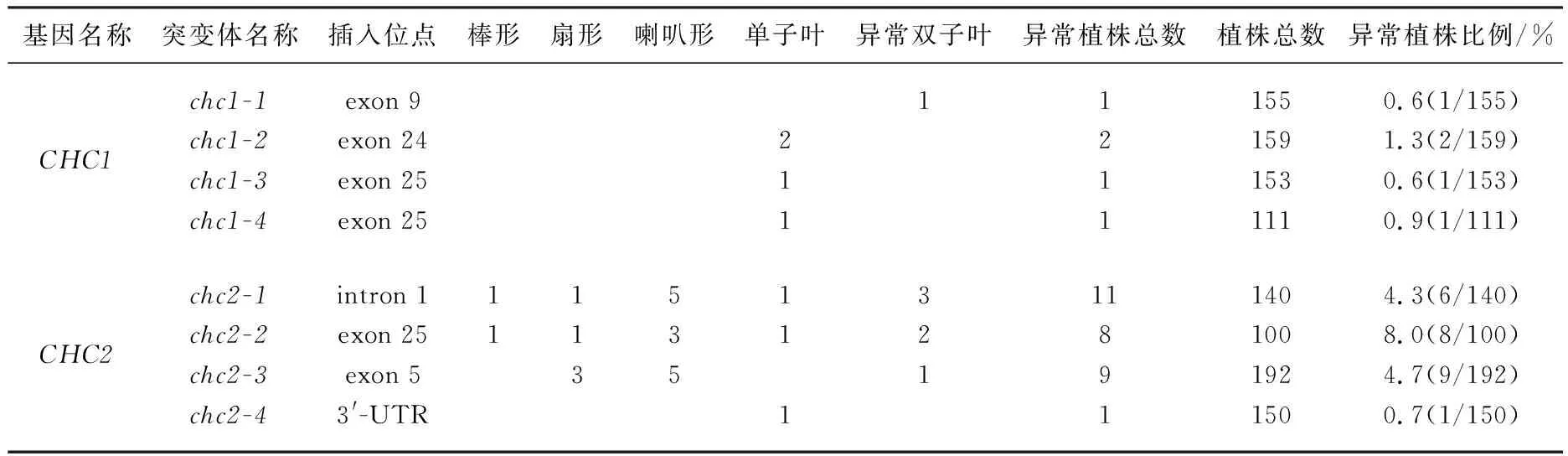
表2 拟南芥chc1和chc2突变体表型统计分析
为进一步揭示CHC的生物学功能,将chc1和chc2两个单突变体进行人工杂交.但很遗憾的是,对杂交F2分离群体进行大量的分析鉴定,均未能获得chc1chc2纯合双突变体,表明CHC1和CHC2功能同时缺失可能引起花粉致死或胚胎致死.这进一步表明CHC1和CHC2在遗传学上具有功能冗余,对植物生长发育不可或缺.
3 讨 论
最近的研究表明,网格蛋白介导的内吞也参与调控植物的生长发育和环境响应[4,10-14].clc2clc3双突变体具有短根长胚轴表型,其根尖向地性、侧根启动、根毛极性分布及对外源生长素的敏感性均受到明显抑制,植株未能直立,叶和豆荚的发育、表皮毛的形成也受到很大的影响[4].而在chc单突变体中,具有突变表型的个体一般很难在土壤中成活(见图3),并且未能获得chc1chc2双突变体,表明在植物发育过程中,CHC比CLC具有更重要的生物学功能.功能缺失的重链chc2单突变体和CHC1(HUB)负显性突变体的质膜蛋白内吞也受到显著性抑制[10].另外,最近的遗传学证据表明,拟南芥接头蛋白AP2 (adaptor protein 2)A1或μ2或σ亚基功能缺失也抑制质膜蛋白内吞,导致维管束发育异常,营养生长减弱,豆荚发育缺陷及繁殖能力下降[12-14].而最近发现一类植物特有的接头蛋白复合体TPLATE(adaptin-like protein with a role in cell plate anchorage)[11],该复合体部分功能缺失严重损害由网格蛋白介导的质膜蛋白内吞,表明该复合体是网格蛋白介导的内吞所必需的.
本研究实验结果与文献[10]的报道相一致:CHC2功能缺失导致植物发育缺陷,幼苗子叶出现棒状、喇叭状、扇形、单子叶和异常双子叶等表型,这些很可能与生长素极性运输、分布的改变相关,这些与pin,tmk和ap2σ及生长素运输抑制剂处理过的植物表型[12-16]类似.但文献[10]的研究表明chc1-1和chc1-2单突变体表型正常,未发现异常发育,而本研究发现chc1-1,chc1-2,chc1-3和chc1-4单突变体均出现少量单子叶表型;同时,文献[10]的统计数据表明chc2-1和chc2-2单突变体中分别约有14%和21%的异常子叶表型,该比例远高于本研究的实验结果.这些差异很可能起因于突变体的培养条件或生长环境不同,也可能是因为统计方法不同而造成的.
已知外源生长素能够抑制网格蛋白介导的内吞途径[4,17].在根表皮细胞中,生长素通过ABP1(AUXIN BINDING PROTEIN 1)负调控PIN1和PIN2的内吞[17-18].根据clc1clc2双突变体和abp1突变体具有相似的表型,推测CLC和ABP1在调控质膜定位的膜蛋白内吞时很可能位于同一通路中[4].但CHC和ABP1之间是否存在相互作用,目前还没有明确的证据.因此,本研究观察分析了chc单突变体的发育表型,为进一步研究植物网格蛋白介导的内吞的调控机制提供了新的材料.
参考文献:
[1]Liu Shuhui,Wong Meilie,Craik C,et al.Regulation of clathrin assembly and trimerization defined using recombinant triskelion hubs[J].Cell,1995,83(2):257-267.
[2]McMahon H T,Boucrot E.Molecular mechanism and physiological functions of clathrin-mediated endocytosis[J].Nat Rev Mol Cell Biol,2011,12(8):517-533.
[3]王超,潘建伟.高等动植物网格蛋白介导的内吞[J].浙江师范大学学报:自然科学版,2012,35(4):453-458.
[4]Wang Chao,Yan Xu,Chen Qian,et al.Clathrin light chains regulate clathrin-mediated trafficking,auxin signaling,and development inArabidopsis[J].Plant Cell,2013,25(2):499-516.
[5]吴乃虎.基因工程原理:下册[M].2版.北京:科学出版社,2001:180-181.
[6]Kitakura S,Vanneste S,Robert S,et al.Clathrin mediates endocytosis and polar distribution of PIN auxin transporters inArabidopsis[J].Plant Cell,2011,23(5):1920-1931.
[7]Blilou I,Xu Jian,Wildwater M,et al.The PIN auxin efflux facilitator network controls growth and patterning inArabidopsisroots[J].Nature,2005,433(7021):39-44.
[8]Geldner N,Richter S,Vieten A,et al.Partial loss-of-function alleles reveal a role for GNOM in auxin transport-related post-embryonic development ofArabidopsis[J].Development,2004,131(2):389-400.
[9]Tromas A,Braun N,Muller P,et al.The AUXIN BINDING PROTEIN 1 is required for differential auxin responses mediating root growth[J].PLoS ONE,2009,4(9):e6648.
[10]Effendi Y,Rietz S,Fischer U,et al.The heterozygous abp1/ABP1 insertional mutant has defects in functions requiring polar auxin transport and in regulation of early auxin-regulated genes[J].Plant J,2011,65(2):282-294.
[11]Gadeyne A,Sánchez-Rodríguez C,Vanneste S,et al.The TPLATE adaptor complex drives clathrin-mediated endocytosis in plants[J].Cell,2014,156(4):691-704.
[12]Fan Lusheng,Hao Huaiqing,Xue Yiqun,et al.Dynamic analysis ofArabidopsisAP2 σ subunit reveals a key role in clathrin-mediated endocytosis and plant development[J].Development,2013,140(18):3826-3827.
[13]Kim S Y,Xu Zhengyi,Song K,et al.Adaptor protein complex 2-mediated endocytosis is crucial for male reproductive organ development inArabidopsis[J].Plant Cell,2013,25(8):2970-2985.
[14]Yamaoka S,Shimono Y,Shirakawa M,et al.Identification and dynamics ofArabidopsisadaptor protein-2 complex and its involvement in floral organ development[J].Plant Cell,2013,25(8):2958-2969.
[15]Paciorek T,Zazímalová E,Ruthardt N,et al.Auxin inhibits endocytosis and promotes its own efflux from cells[J].Nature,2005,435(7046):1251-1256.
[16]Xu Tongda,Dai Ning,Chen Jisheng,et al.Cell surface ABP1-TMK auxin-sensing complex activates ROP GTPase signaling[J].Science,2014,343(6174):1025-1028.
[17]Robert S,Kleine-Vehn J,Barbez E,et al.ABP1 mediates auxin inhibition of clathrin-dependent endocytosis inArabidopsis[J].Cell,2010,143(1):111-121.
[18]Chen Xu,Naramoto S,Robert S,et al.ABP1 and ROP6 GTPase signaling regulate clathrin-mediated endocytosis inArabidopsisroots[J].Curr Biol,2012,22(14):1326-1332.

