水稻白叶枯病拮抗菌的筛选、鉴定及发酵液稳定性分析*
张艳军, 张萍华
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
水稻白叶枯病是由水稻黄单胞菌致病变种(Xanthomonasoryzaepv.oryzae,Xoo)所引起的一种世界性的细菌病害,与稻瘟病、纹枯病一起被称为水稻的“三大病害”.水稻遭受白叶枯病后,一般减产20%~30%,严重的可减产50%,甚至绝收,严重威胁全球农业和粮食安全[1-3].目前,培育抗性品种是控制白叶枯病最经济有效的方法[4].但由于致病菌株不断发生变异,使得抗性水稻品种逐渐表现出感病症状,因此化学防治仍是防治水稻白叶枯病不可缺少的重要手段.目前常用的化学合成药剂主要有噻枯唑、克菌壮、叶枯唑及其复配剂和噻森铜等.这些化学合成药剂的缺点显而易见,包括:1)对水稻白叶枯病的防治效果较差,一般只有60%左右[5];2)长期使用易产生抗药性[6];3)产生农药残留,污染环境,甚至影响人类健康[4].
近年来,生物防治以其生态环境友好、成本低、无污染的特点逐渐为人们所重视,筛选和利用拮抗菌剂防治水稻白叶枯病已成为十分活跃的研究领域,并取得了显著的进展.但是由于水稻白叶枯病菌致病小种会发生变异,从而对抗病药剂产生抗性,因此,从自然环境中寻找防治水稻白叶枯病的新药剂是一项长期的工作.本研究从稻田土壤、水稻植株、昆虫肠道等环境中分离纯化菌株,并以水稻白叶枯病菌生理小种P6菌株为指示菌,通过琼脂块法和牛津杯法,筛选出一株对水稻白叶枯病具有拮抗作用的菌株,并对其进行了分类鉴定;在此基础上,对该拮抗菌发酵液的抑菌稳定性,即热稳定性、酸碱稳定性、光稳定性等进行了系统研究,获得了该菌抑菌活性成分对不同环境因素耐受能力的相关数据,为抑菌活性物质的分离纯化提供了一定的理论依据.
1 材料与方法
1.1 菌种
水稻白叶枯病菌生理小种P6菌株,保存于-80 ℃冰箱中.
供试拮抗菌:从稻田土壤、昆虫肠道、水稻植株中分离获得.
1.2 培养基
PDA固体培养基(1 L):马铃薯200 g,葡萄糖20 g,琼脂15 g,pH自然.
PD液体培养基(1 L):马铃薯200 g,葡萄糖15 g,pH自然.
改良PDA固体培养基(1 L):马铃薯300 g,蔗糖15 g,Ca(NO3)254H2O 0.5 g,Na2HPO4·12H2O 2.0 g,胰蛋白胨5.0 g,琼脂15 g,pH自然.
改良PDA液体培养基(1 L):马铃薯300 g,蔗糖15 g,Ca(NO3)2·4H2O 0.5 g,Na2HPO4·12H2O 2.0 g,胰蛋白胨5.0 g,pH自然.
高氏Ⅰ号培养基(1 L):可溶性淀粉20 g,KNO31 g,K2HPO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.5 g,FeSO4·7H2O 0.01 g,琼脂20 g,pH 7.4~7.6.
孟加拉红培养基(1 L):蛋白胨5 g,葡萄糖10 g,KH2PO41 g,琼脂20 g,MgSO4·7H2O 0.5 g,1/3 000孟加拉红溶液100 mL,氯霉素0.1 g.
牛肉膏蛋白胨培养基(1 L):牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,pH 7.0.
鉴定培养基为固体淀粉培养基、糖发酵实验培养基、葡萄糖蛋白胨水培养基、蛋白胨水培养基、Simons氏柠檬酸盐培养基、明胶培养基等[7].
1.3 菌种的采集
1.3.1 土壤中菌种的分离纯化
用铲子从田间种植的水稻根际区域表层5~10 cm处取土样约200 g,用灭菌袋将土壤带回实验室,共采集8份.采用梯度稀释法制备土壤悬液,分别吸取10-5,10-6和10-7土壤稀释液0.1 mL涂布于牛肉膏蛋白胨培养基平板上,室温静置10 min后倒置于37 ℃恒温培养箱中培养;分别吸取10-3,10-4和10-5土壤稀释液0.1 mL涂布于高氏Ⅰ号培养基平板上,室温静置10 min后倒置于28 ℃恒温培养箱中培养;分别吸取10-1,10-2和10-3土壤稀释液0.1 mL涂布于孟加拉红培养基平板上,室温静置10 min后倒置于28 ℃恒温培养箱中培养.每处理重复3次.培养2~3 d后挑取单菌落,接种于PDA培养基上保藏并进行编号,用于下一步初筛实验.
1.3.2 昆虫内生菌的分离纯化
在水稻田附近共采集到蜻蜓、蝴蝶、豆娘及蝗虫4份昆虫样本,将它们饥饿24 h,排空体内食物残渣供试.样品先用蒸馏水冲洗干净,再用75%乙醇溶液浸泡3 min,然后用无菌滤纸吸干,再用无菌生理盐水冲洗3次,每次5 min.在无菌条件下解剖昆虫,取出肠道置于无菌研钵中,加入1 mL无菌生理盐水研磨,即得昆虫肠道菌原液,再逐级稀释获得10-1和10-2稀释液.取原液0.2 mL涂布于孟加拉红培养基平板上,室温静置10 min后倒置于28 ℃恒温培养箱中培养;取10-1菌液稀释液0.2 mL涂布于高氏Ⅰ号培养基平板上,室温静置10 min后倒置于28 ℃恒温培养箱中培养;取10-2菌液稀释液0.2 mL涂布于牛肉膏蛋白胨培养基平板上,室温静置10 min后倒置于37 ℃恒温培养箱中培养.每处理重复3次.培养2~3 d后挑取单菌落,接种于PDA培养基上保藏并进行编号,用于下一步初筛实验.
1.3.3 水稻内生菌的分离纯化
在水稻田采集有白叶枯病症状的整株水稻植株样品,置于灭菌袋中带回实验室处理,共6份.将样品洗净,取水稻的根、茎、叶、穗、叶鞘等部位各1 g,用无菌水冲洗多次,再用无菌剪刀剪碎置于无菌研钵中,加入少量石英砂和10 mL无菌水充分研磨,即得水稻内生菌原液,逐级稀释获得10-1和10-2稀释液.分别吸取0.1 mL原液、10-1稀释液和10-2稀释液涂布于孟加拉红培养基、牛肉膏蛋白胨培养基、高氏Ⅰ号培养基平板上,静置10 min后,牛肉膏蛋白胨平板倒置于37 ℃恒温培养箱中培养,孟加拉红平板和高氏Ⅰ号平板倒置于28 ℃恒温培养箱中培养.培养2~3 d后挑取单菌落,接种于PDA培养基上保藏并进行编号,用于下一步初筛实验.
1.4 水稻白叶枯病拮抗菌的筛选
1.4.1 初筛
将采集到的菌株分别划线接种于PDA培养基平板上,28 ℃恒温培养活化备用;将-80 ℃冰箱中保藏的水稻白叶枯病菌菌株接种至改良PD液体培养基中,于180 r/min和28 ℃摇床上进行活化培养,当菌体溶液的A600达到0.6时,取100 μL菌液均匀涂布于改良PDA固体培养基平板上,备用.用直径0.6 cm的无菌打孔器打孔得供试菌菌饼,放置于上述改良PDA固体培养基平板上,28 ℃恒温培养36~48 h,根据抑菌圈大小初步筛选有拮抗能力的菌株,并将其进行试管斜面和甘油管保藏.
1.4.2 复筛
将试管斜面保藏的拮抗菌接种至新鲜PDA平板中,于28 ℃培养箱中培养3 d.用直径0.6 cm无菌打孔器在长有拮抗菌的平板上打孔取菌块,再用无菌水洗下菌体,接种至装有100 mL PD液体培养液的500 mL三角瓶中,于180 r/min和28 ℃摇床培养,每隔24 h取样.所取拮抗菌发酵液12 000 r/min冷冻离心10 min,所得上清液经0.22 μm无菌微孔滤膜过滤后检测其抑菌效果.
取水稻白叶枯病菌悬液100 μL均匀涂布于改良PDA固体培养基上,再取200 μL微滤后的发酵液,以牛津杯法检测其对白叶枯病原菌的抑菌作用,并根据抑菌圈大小筛选抑菌效果明显的拮抗菌株.每处理重复3次.
1.5 水稻白叶枯病菌拮抗菌株的鉴定
1.5.1 拮抗菌菌落特征及菌丝形态观察
利用梯度稀释法获得拮抗菌稀释液,分别吸取10-4,10-5和10-6稀释液0.1 mL涂布于PDA培养基平板上,室温静置10 min后倒置于28 ℃恒温培养箱中培养,并定期观察菌落形态特征,同时采用印片染色法观察菌丝形态特征.
1.5.2 拮抗菌生理生化性状测定
参照文献[7]对拮抗菌进行甲基红实验、伏普实验、淀粉水解实验、吲哚实验、柠檬酸盐实验、碳源利用实验等.根据实验结果,初步鉴定拮抗菌种类.
1.5.3 拮抗菌分子生物学鉴定
使用生工生物工程(上海)股份有限公司的细菌基因组DNA抽提试剂盒(SK1201)提取拮抗菌株基因组DNA,并以此为模板,采用通用引物[8](27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1541R:5′-AAGGAGGTGATCCAGCGCA-3′)进行16S rDNA的PCR扩增,条件为:98 ℃预变性3 min,98 ℃变性25 s,55 ℃复性25 s,72 ℃延伸1 min,30个循环,72 ℃最终延伸10 min.PCR产物经琼脂糖凝胶电泳纯化回收后送至生工生物工程(上海)股份有限公司测序.将获得的菌株16S rDNA序列提交至NCBI 数据库,并进行BLAST比对检索,调取同源性较高菌株的16S rDNA序列,用ClustalX 2.1软件进行多序列对比,并进行人工校正,然后用软件MEGA 5.05按照Neighbour-Joining法构建系统发育树,确定未知菌种的分类地位.
纳米材料科学并不是一门具有完整体系和基础理论的成熟学科,直到1990年7月在巴尔的摩召开的第一届纳米科学技术学术会议,才正式把纳米材料作为材料科学的一个新分支公布于世。纳米材料是一门前瞻性、创新性、专业性和实践性很强的课程,涉及物理、化学、生物、能源、材料等多学科交叉和前沿领域,其教学内容主要直接面向科研实践的工作,需要考虑纳米材料科学的以下几个特点。
1.6 拮抗菌株发酵液抑菌稳定性的测定
1.6.1 拮抗菌株无菌发酵滤液制备
将拮抗菌接种至100 mL PD液体发酵培养液中,于转速180 r/min、温度28 ℃摇床中培养5 d,然后将拮抗菌发酵液12 000 r/min冷冻离心10 min,上清液经0.22 μm无菌微孔滤膜过滤,即获得拮抗菌株无菌发酵滤液.
1.6.2 拮抗菌株发酵液拮抗能力测定
制备水稻白叶枯病菌悬液,取100 μL菌液均匀涂布于改良PDA培养基平板上,再取200 μL拮抗菌株无菌发酵滤液,以牛津杯法检测其对白叶枯病原菌的抑菌作用.每处理重复3次.
1.6.3 拮抗菌株发酵液抑菌稳定性测定
1)热稳定性
制备拮抗菌株发酵上清液,分装于5支小试管中,每管5 mL样品,分别在30,50,70,90和121 ℃中保温处理20 min,冷却后用0.22 μm无菌微孔滤膜过滤,并检测滤液的抗菌活性,以原始无菌发酵滤液作为对照.每处理重复3次.
2)酸碱稳定性
制备拮抗菌株发酵上清液,分装于9支小试管中,每管5 mL样品,用1 mol/L NaOH溶液或1 mol/L HCl溶液将发酵滤液pH值调为2~11,处理2 h后用0.22 μm无菌微孔滤膜过滤,并检测滤液的抗菌活性,以原始无菌发酵滤液作为对照.每处理重复3次.
制备拮抗菌株发酵上清液,在室温条件下向培养皿内加入等量的拮抗菌株发酵上清液,于紫外灯(40 W)下分别照射1,2,4 h和自然光下分别照射3,6,9 h.处理后样品用0.22 μm无菌微孔滤膜过滤,并检测滤液的抗菌活性,以原始无菌发酵滤液作为对照.每处理重复3次.
2 结果与分析
2.1 水稻白叶枯病菌拮抗菌株的筛选
从采集的8份水稻根际稻田土壤、6份水稻植株和4份昆虫(蜻蜓、蝴蝶、豆娘及蝗虫)肠道样品中共分离纯化得到31株霉菌、29株细菌和28株放线菌,以水稻白叶枯病菌生理小种P6菌株为指示菌,通过琼脂块法和牛津杯法,筛选得到1株对水稻白叶枯病菌具有良好拮抗作用的菌株——12号拮抗菌株(来源于水稻根际土壤),其抑菌圈直径达6.09 cm.
2.2 12号拮抗菌株的鉴定
2.2.1 12号拮抗菌株的菌落特征及菌丝形态
如图1所示,12号拮抗菌株在PDA培养基上菌落较大,呈圆形、微隆起、干燥、边缘不规则且不透明.菌落正面初期为白色,5 d后呈现灰色;菌落背面呈微黄色.菌落质地硬而且致密,与培养基连接紧密,难以挑取,具有典型的放线菌特征.如图2所示:显微镜下12号拮抗菌株菌丝发达,且有大量分枝;孢子丝呈螺旋状,成熟后断裂成孢子,孢子(spore)呈圆形.

图1 12号拮抗菌菌落形态

图2 12号拮抗菌菌丝和孢子形态
2.2.2 12号拮抗菌株的生理生化特性
如表1所示:12号拮抗菌株的糖(葡萄糖和乳糖)发酵实验、甲基红反应、V-P实验和柠檬酸盐实验结果均为阴性;淀粉水解实验现象明显,呈阳性;吲哚实验和柠檬酸盐实验结果均呈阳性.结合其菌落形态和菌丝形态特征,参考文献[9],将12号拮抗菌株初步鉴定为链霉菌属.

表1 12号拮抗菌株的生理生化实验结果
注:+代表阳性;-代表阴性.
2.2.3 12号拮抗菌株的分子生物学鉴定
通过克隆、测序,获得了12号拮抗菌株的16S rDNA基因序列,长度为1 459 bp.该序列在EzTaxon数据库进行BLAST相似性分析,根据序列同源性从高到低的原则,选取相近的12个菌株16S rDNA序列,按照N-J法构建系统发育树,结果见图3.12号拮抗菌株与StreptomycesgramineusJR-43处于同一进化分支,两者序列相似性达98%,而且其形态特征和生理生化特征基本一致.因此,确定该菌株为Streptomycesgramineus.
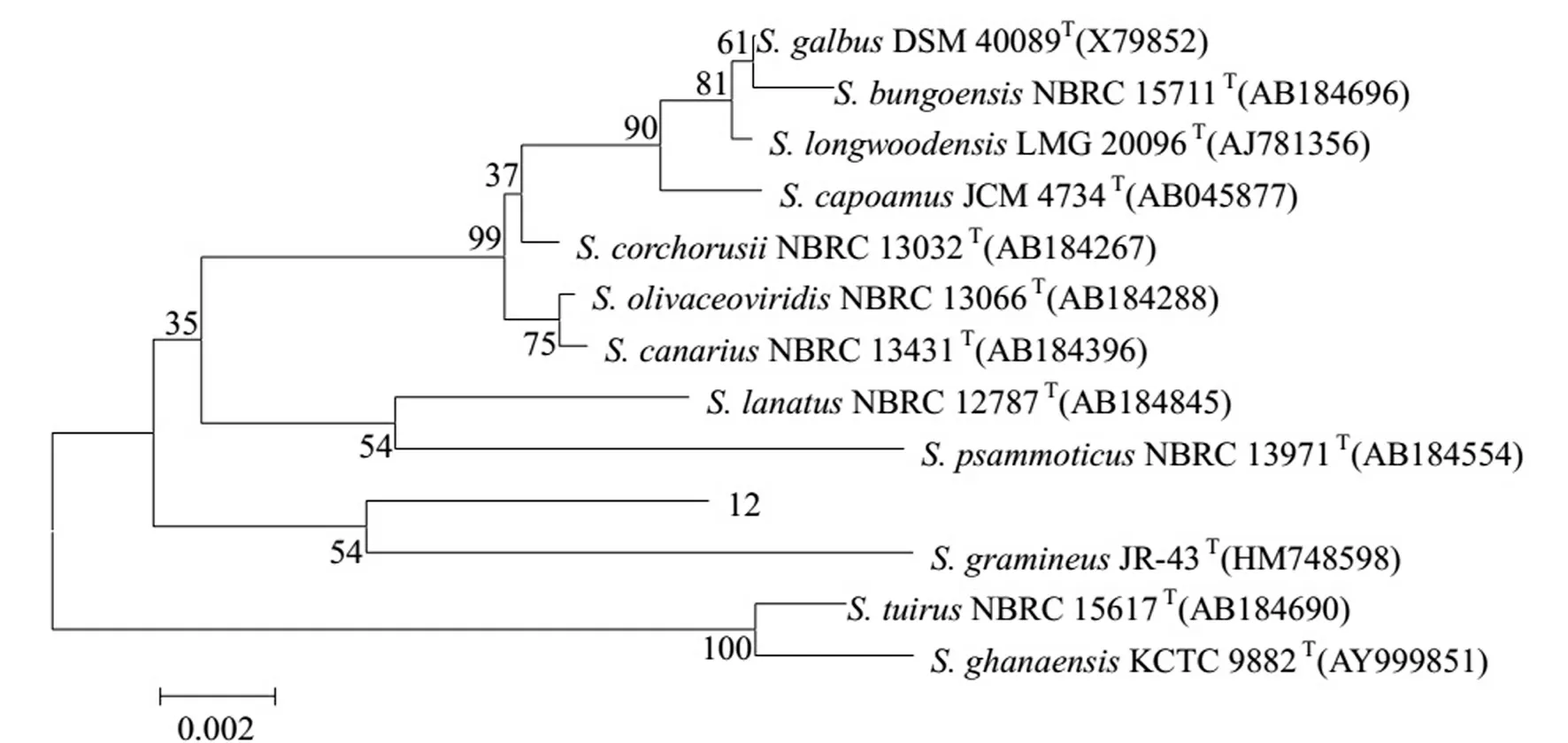
图3 基于12号菌株及12个系统发育密切相关链霉菌属代表菌株16S rDNA序列构建的邻接系统发育树
2.3 12号拮抗菌株发酵液稳定性的研究
2.3.1 热稳定性
由图4可知,12号拮抗菌株发酵液的抑菌活性随温度升高略有降低,但在121 ℃处理后发酵液的抑菌圈直径仍高达4.95 cm,仅比对照降低了1.14 cm,表明12号拮抗菌株发酵液具有很好的热稳定性.

图4 温度对12号菌株发酵液稳定性的影响
2.3.2 酸碱稳定性
12号拮抗菌株发酵液的原始pH值为6.05,分别调至2.07,3.07,4.19,5.21,6.05,8.64,9.39和10.13.由图5可知:12号拮抗菌株发酵液的抑菌活性在pH 4.19时最低,但抑菌圈直径仍有5 cm;随着酸/碱性的增加,12号拮抗菌株发酵液的抑菌活性呈逐步上升趋势,甚至在pH 2.07和pH 9.39时抑菌圈直径达到了6.60和7.10 cm,高于对照样品.因此,12号拮抗菌株发酵液具有较好的酸碱稳定性,甚至在过酸或过碱条件下其抑菌活性较对照有所增加.
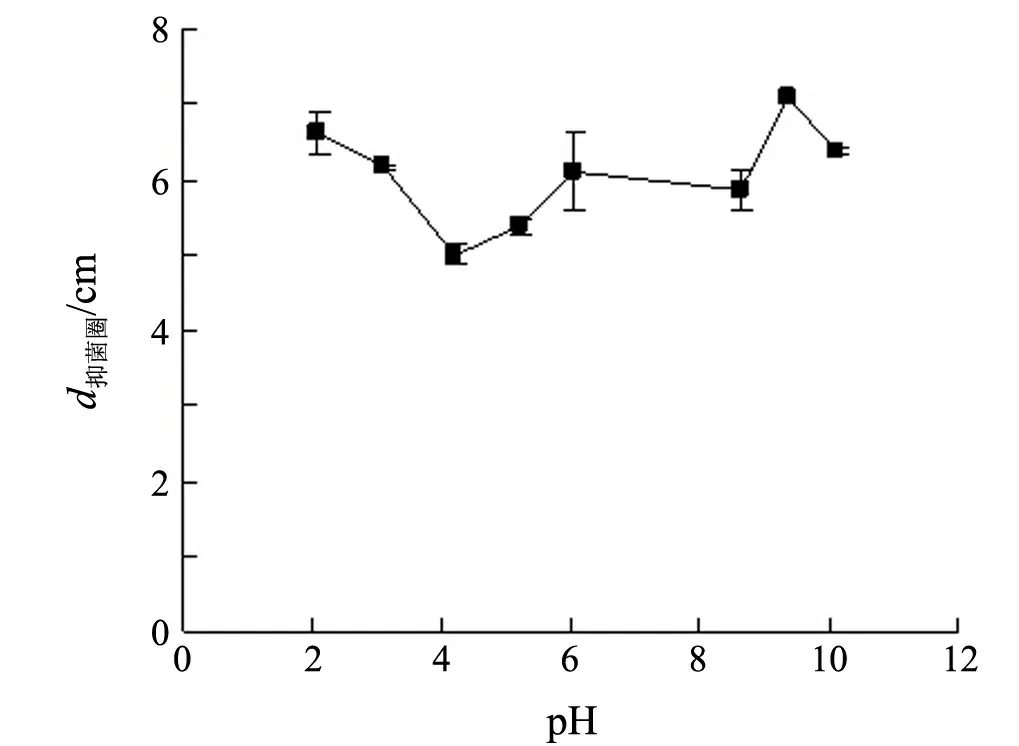
图5 pH对12号菌株发酵液稳定性的影响
2.3.3 光稳定性
由图6和图7可知,与对照样品相比,12号拮抗菌株发酵液经自然光或紫外光照射后,抑菌活性均略有降低,但抑菌圈直径随着照射时间的增加并无明显降低.因此,12号拮抗菌株发酵液具有较好的光稳定性.
3 讨 论
自20世纪80年代以来,筛选和利用拮抗细菌防治水稻白叶枯病在世界范围内已成为十分活跃的研究领域.Velusamy等[10]从水稻根际土壤中分离得到一株荧光假单胞菌PDY7,在平板中对白叶枯病菌的抑菌直径可达3.8 cm,在温室和大田实验的防治效果分别为58.8%和51.9%.葛米红[11]从健康水稻植株中分离得到了内生细菌MB-1-6-6,在室外条件下对水稻白叶枯病的防治效果达69.3%.魏兰芳等[12]筛选得到了抗生素溶杆菌13-1,含菌发酵液对水稻白叶枯病的防治效果达69.7%.周定中等[13]从昆虫黑水虻肠道中分离得到一株对水稻黄单胞菌有很强抑菌活性的枯草芽胞杆菌BSF-CL,通过活性物质的分子克隆鉴定初步推测其活性物质可能为脂肽Iturin和Surfactin.本研究以水稻白叶枯病菌生理小种P6菌株为指示菌,从水稻根际土壤中筛选得到1株对其具有明显拮抗作用的菌株,其抑菌圈直径高达6.09 cm,经查阅相关文献得知,该值为现有文献报道的最高值.根据12号拮抗菌株的菌落形态和菌丝形态特征、生理生化特征和16S rDNA序列分析结果,鉴定该菌株为Streptomycesgramineus.

图6 自然光对12号菌株发酵液稳定性的影响

图7 紫外光对12号菌株发酵液稳定性的影响
生物活性物质能否有效地发挥作用也与自身的稳定性有密切关系[14].即使筛选得到了抑菌效果良好的菌株,也可能因生物活性物质的稳定性差而无法在生产实践中应用.本文12号菌株发酵液抑菌稳定性的研究结果表明:该拮抗菌株发酵液中的抗菌活性物质具有较强的热稳定性、酸碱稳定性和光稳定性,将其作为生物农药具有一定的应用价值和开发前景.但要将该抗菌活性物质开发成新型生防制剂,充分发挥该拮抗菌的生防潜力,在理论和实践上仍需要进行大量研究,如拮抗菌发酵条件优化、抗菌活性物质的分离纯化、田间防治试验等.目前本实验室已着手对该抗菌活性物质进行分离纯化,并计划对其结构及抑菌机理做进一步的研究.
参考文献:
[1]赖传雅.农业植物病理学[M].北京:科学出版社,2003.
[2]Noh T H,Lee D K,Park J C,et al.Effects of bacterial leaf blight occurrence on rice yield and grain quality in different rice growth stage[J].Research in Plant Disease,2007,13(1):20-23.
[3]Verdier V,Vera Cruz C,Leach J E.Controlling rice bacterial blight in Africa:needs and prospects[J].Journal of Biotechnology,2012,159(4):320-328.
[4]Mueen A K,Muhammad N,Muhammad I.Breeding approaches for bacterial leaf blight resistance in rice (OryzasativaL.),current status and future directions[J].European Journal of Plant Pathology,2014,139(1):27-37.
[5]廖林,白学慧,姬广海,等.水稻品种间栽防治水稻白叶枯病研究[J].华南农业大学学报,2008,29(4):42-46.
[6]徐颖.水稻白叶枯病菌(Xanthomonasoryzaepv.oryzae)对链霉素和噻枯唑抗药性监测和抗药性机制的研究[D].南京:南京农业大学植物保护学院,2010.
[7]沈萍,范秀容,李光武,等.微生物学实验[M].北京:高等教育出版社,2002:100-114.
[8]姜云,黄丽丽,陈长卿,等.一株拮抗番茄叶霉病菌的放线菌筛选、鉴定及发酵条件研究[J].微生物学报,2007,47(4):622-627.
[9]阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992.
[10]Velusamy P,Immanuel J E,Gnanamanickam S S.Rhizosphere bacteria for biocontrol of bacterial blight and growth promotion of rice[J].Rice Science,2013,20(5):356-362.
[11]葛米红.利用内生细菌防治水稻白叶枯病的研究[D].武汉:华中农业大学植物科技学院,2008.
[12]魏兰芳,周丽洪,姬广海,等.Lysobacterantibioticus13-1菌株抗菌物质鉴定及对水稻白叶枯病的防治效果[J].微生物学通报,2014,41(2):274-280.
[13]周定中,曹露,王茂淋,等.黑水虻肠道细菌抗菌筛选及其活性物质分子鉴定[J].微生物学通报,2012,39(11):1614-1621.
[14]嵇豪,蒋冬花,杨叶,等.响应面法优化超声波辅助提取红曲米中水溶性色素[J].浙江师范大学学报:自然科学版,2011,34(1):91-96.

