槐花多糖的提取、纯化和抗氧化活性分析
张玉梅,邢慧珍,刘会平,乔赛凤
(天津科技大学食品科学与工程学院,天津 300457)
槐花是豆科植物槐(Sophora japonicaL.)的干燥花及花蕾,属于药食同源类植物,主要分布在黄土高原和华北平原[1-2]。研究表明,槐花由芦丁、酚类化合物、氨基酸、多糖、三萜和生物碱等化学成分组成[3],具有多种药理特性,包括抗氧化、抗菌、抗衰老、镇痛和抗过敏[4]。多糖是由10 个以上单糖通过糖苷键结合而成的高分子聚合物[5],具有多种生物活性,如降血糖[6]、抗肿瘤[7]、抗病毒[8]、抗氧化[9]等。
常见的槐花多糖的提取方法有水提醇沉法、酶提法[10]、超声辅助提取法[11]等。水提法是最传统的方法,具有工艺过程简单、设备要求低、多糖结构不易被破坏等优点。目前水提法提取槐花多糖主要采用正交法优化提取工艺,关于响应面法优化水提法提取槐花多糖工艺的的研究较少。王红庆等[12]采用正交法优化槐花多糖的提取工艺,得出最佳工艺条件为料液比1:25 g/mL、提取温度80 ℃、提取时间6 h,该工艺条件下槐花多糖的提取率为3.10%。胡喜兰等[13]采用正交试验法得出水提法提取槐花多糖的最佳工艺条件为料液比1:15 g/mL、浸提温度95 ℃、浸提时间6 h,所得槐花多糖的含量为0.0626 g/g。
此外,目前关于槐花纯化多糖组分抗氧化活性的研究较少。王丽华[14]从槐花中分离纯化出了三种分子量较低(10.85、7.72 和2.88 kDa)的多糖组分,发现这三种组分均具有一定的抗氧化能力。研究表明,多糖的均匀性和分子量会对其生物活性造成影响,且不同产地、不同提取条件下所得多糖的抗氧化活性不同[15]。
本研究以槐花为原料,通过响应面法优化水提法提取槐花多糖的工艺条件,并经过脱蛋白、透析、Sephadex G-200 凝胶柱层析得到一种新型的大分子纯化多糖组分,命名为SJP,对其结构进行表征,并以VC为阳性对照,DPPH·、·OH、ABTS+·清除率及总还原力为指标探究其抗氧化活性,为槐花多糖的进一步开发和应用提供理论依据。
1 材料和方法
1.1 材料与仪器
干燥的槐花 天津同仁堂中药店提供;牛血清白蛋白(BSA)、半乳糖醛酸、葡萄糖、葡聚糖凝胶G-200、抗坏血酸(VC)、ABTS 北京索莱宝科技有限公司;水杨酸、DPPH、铁氰化钾、氯化铁、硫酸亚铁麦克林生化科技有限公司;所使用的试剂均为国产分析纯。
SE-2000 高速粉碎机 浙江永康市圣象电器有限公司;DF-101S 恒温水浴锅 苏州威尔实验用品有限公司;RE-52AA 旋转蒸发仪 上海亚荣生化仪器厂;BS-100A 自动收集器 上海沪西仪器分析厂;FD-1A-50 冷冻干燥机 上海比朗仪器制造有限公司;Synergy HTX 酶标仪 美国伯腾仪器有限公司;Agilent 1260 高效液相色谱仪 美国安捷伦公司;Smartlab-3KW X 射线衍射仪 日本理学公司。
1.2 实验方法
1.2.1 槐花多糖的提取 将干燥的槐花粉碎并使用石油醚在70 ℃条件下对其进行脱脂处理,然后按照一定的料液比和提取时间,100 ℃水浴提取,冷却后以4000 r/min 离心10 min,将所得上清液浓缩至原体积的1/3,然后向其中加入一定体积的无水乙醇,4 ℃冰箱放置过夜,收集离心后的沉淀物,用蒸馏水复溶,8000 r/min 离心10 min,收集上清液并冷冻干燥,得到槐花粗多糖,命名为cSJP。cSJP 的得率由公式(1)计算:
1.2.2 单因素实验
1.2.2.1 料液比对cSJP 得率的影响 固定提取时间120 min,醇沉浓度60%,提取次数1 次,探究料液比(1:10、1:15、1:20、1:25、1:30 g/mL)对cSJP 得率的影响。
1.2.2.2 提取时间对cSJP 得率的影响 固定料液比1:20 g/mL,醇沉浓度60%,提取次数1 次,探究提取时间(60、90、120、150、180 min)对cSJP 得率的影响。
1.2.2.3 提取次数对cSJP 得率的影响 固定料液比1:20 g/mL,提取时间120 min,醇沉浓度60%,探究提取次数(1、2、3、4、5 次)对cSJP 得率的影响。
1.2.2.4 醇沉浓度对cSJP 得率的影响 固定料液比1:20 g/mL,提取时间120 min,提取次数1 次,探究醇沉浓度(40%、50%、60%、70%、80%)对cSJP 得率的影响。
1.2.3 响应面优化试验 以料液比(A)、提取时间(B)、醇沉浓度(C)作为考察因素,cSJP 得率为考察指标,根据Box-Behnken 原理设计试验模型,因素和水平的设计如表1 所示。

表1 响应面试验设计因素及水平Table 1 Response surface test design factors and levels
1.2.4 槐花多糖的纯化 采用Sevag 法脱除蛋白质,然后使用截留分子量为10 kDa 的透析袋透析除去小分子物质及无机盐,并通过Sephadex G-200 凝胶柱层析(柱尺寸为1.6 cm×40 cm,洗脱速度为0.3 mL/min,体积为3 mL/管)得到纯化多糖组分,命名为SJP。
1.2.5 SJP 的结构表征
1.2.5.1 SJP 的分子量测定 采用高效液相色谱(HPLC)测定SJP 的分子量。用超纯水配制1 mg/mL的SJP 溶液,过0.22 μm 水系滤膜后装入液相小瓶中待测。选用示差检测器,温度设置为35 ℃;柱温设置为30 ℃;超纯水为流动相,流速为0.6 mL/min;进样量为20 μL;采用T 系列(T-10、T-70、T-100、T-300、T-500 和T-2000)葡聚糖标准品建立lg Mw-Rt标准曲线,计算SJP 的分子量。
1.2.5.2 SJP 化学成分的测定 以葡萄糖为标准品,采用苯酚-硫酸法测定SJP 中的总糖含量[16]。以牛血清白蛋白为标准品,采用考马斯亮蓝法测定蛋白质含量[17]。以半乳糖醛酸为标准品,采用间羟基联基法测定糖醛酸含量[18]。
1.2.5.3 刚果红实验 将SJP 溶液(2 mL,0.4 mg/mL)、刚果红溶液(2 mL,50 μmol/L)与不同梯度浓度的NaOH 溶液混合,使得NaOH 的最终浓度分别为0,0.05,0.1,0.15,0.2,0.25,0.3,0.35 和0.4 mol/L,在室温下衍生化10 min 后,在400~600 nm 范围内测定最大吸收波长。
1.2.5.4 X-射线衍射分析 SJP 的X-射线衍射图谱(XRD)由X-射线衍射仪测定,具体扫描角度范围为5°~90°,扫描速度为2°/min。
1.2.6 SJP 抗氧化活性的测定 以下试验均以VC为阳性对照组,测定不同浓度(0.1~5 mg/mL)SJP 溶液的抗氧化活性。
1.2.6.1 DPPH·清除率的测定 将SJP 溶液与0.2 mmol/L DPPH-无水乙醇溶液按照体积比1:4 充分混匀,避光反应30 min,在517 nm 处测定吸光度值[19]。按照公式(2)计算清除率:
式中:A1为SJP 溶液的吸光度值;A2为无水乙醇代替DPPH-无水乙醇溶液的吸光度值;A0为蒸馏水代替SJP 溶液的吸光度值。
1.2.6.2 ·OH 清除率测定 向SJP 溶液中加入等体积的FeSO4溶液(6 mmol/L)、水杨酸-乙醇溶液(6 mmol/L)以及H2O2溶液(0.1%),37 ℃恒温水浴30 min,在510 nm 处测定吸光度值[20]。按照公式(3)计算清除率:
式中:A1为SJP 溶液的吸光度值;A2为蒸馏水代替H2O2溶液的吸光度值;A0为蒸馏水代替SJP溶液的吸光度值。
1.2.6.3 ABTS+·清 除 率 测 定 将 ABTS+·溶 液(7 mmol/L)与过硫酸钾溶液(2.45 mmol/L)以体积比1:1 混合,避光12 h 后,用蒸馏水稀释,使其在734 nm 处的吸光度值为0.7±0.02,得到ABTS+·工作液。移取10 μL SJP 溶液和200 μL 工作液于96 孔板中,室温放置6 min,在734 nm 处测定吸光度值[21]。按照公式(4)计算清除率:
式中:A1为SJP 溶液的吸光度值;A2为蒸馏水代替ABTS+·工作液的吸光度值;A0为蒸馏水代替SJP 溶液的吸光度值。
1.2.6.4 总还原力的测定 向1 mL SJP 溶液中先后加入2.5 mL 磷酸缓冲液(0.2 moL/L,pH6.6)和2.5 mL 铁氰化钾溶液(1%),50 ℃水浴20 min,然后加入2.5 mL 三氯乙酸(10%),充分混匀,3000 r/min离心10 min,取100 μL 上清液于96 孔板中,加入100 μL 蒸馏水和20 μL FeCl3溶液(0.1%),混匀后静置10 min,在700 nm 处测定吸光度值[22]。根据公式(5)计算:
式中:A1为SJP 溶液的吸光度值;A2为蒸馏水代替SJP 溶液的吸光度值。
1.3 数据处理
本实验中的实验数据均以平均数±标准差表示。应用单因素方差分析(One-way ANOVA)进行组间比较,P<0.05 或P<0.01 表示差异显著,具有统计学意义。采用SPSS 22、Origin 2018 和Design-Expert 10 软件进行统计分析和绘图。
2 结果与分析
2.1 单因素实验结果
2.1.1 料液比对cSJP 得率的影响 由图1 可知,cSJP得率随着料液比的增大呈现先上升后下降的趋势。当料液比为1:20(g/mL)时,cSJP 得率达到最高为3.81%。这与Li 等[23]研究发现的黄芪多糖得率随料液比变化的趋势相同。这种现象的发生是因为当蒸馏水比例过低时,受固液接触面积及植物细胞内部与溶剂之间浓度差的限制,多糖无法全部溶出,溶剂比例越大,浓度差异越明显,多糖分子扩散的越快,但过高的溶剂比例会延长分子从组织内部扩散的距离并导致杂质溶出的增多而抑制多糖的溶出[24-25]。此外,过量的溶剂会增加后续浓缩过程的负担,并导致溶剂的浪费。因此选择1:15、1:20、1:25(g/mL)三个水平进行响应面优化试验。
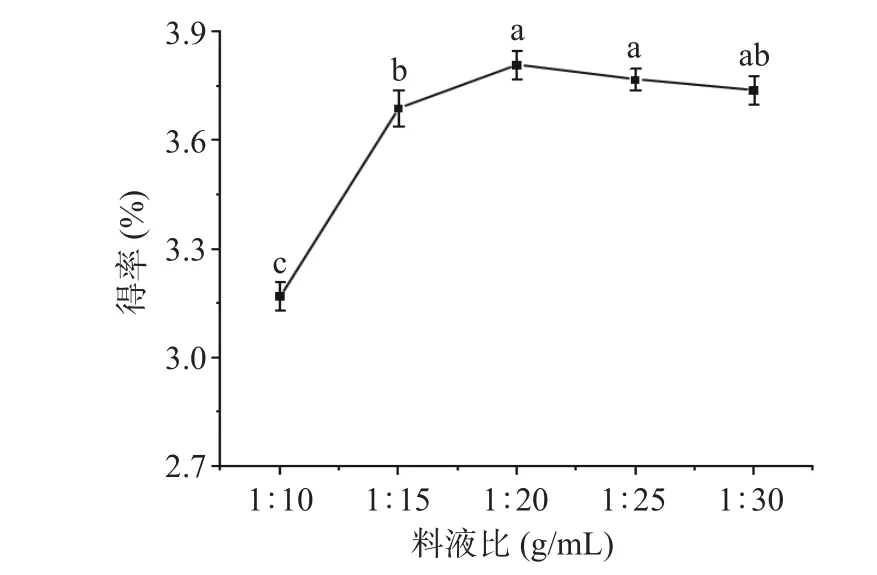
图1 料液比对cSJP 得率的影响Fig.1 Effect of solid-liquid ratio on the yield of cSJP
2.1.2 提取时间对cSJP 得率的影响 提取时间是影响多糖得率的重要因素。由图2 可知,当提取时间从60 min 增加至120 min 时,cSJP 得率显著增加(P<0.05),在120 min 时达到最大值为3.85%,之后继续增加提取时间,多糖的得率略有下降(P>0.05),这是因为提取时间过短,受传质速率的影响,多糖无法全部溶出,而提取时间过长则会导致多糖的结构的破坏以及杂质溶出的增多[26-27]。综合考虑多糖提取的时间成本及其最终得率,选择90、120、150 min 进行响应面优化试验。

图2 提取时间对cSJP 得率的影响Fig.2 Effect of extraction time on the yield of cSJP
2.1.3 提取次数对cSJP 得率的影响 由图3 可知,随着提取次数的增多,cSJP 得率的增加由快变缓。当提取次数为3 次时,cSJP 得率为3.67%,提取次数为4 次和5 次时,cSJP 得率分别为3.71%、3.73%,与提取3 次的结果均无显著差异(P>0.05),表明继续增加提取次数,对cSJP 得率的增加已不多,为节省提取时间,减少水资源损耗,最终确定最佳提取次数为3 次。
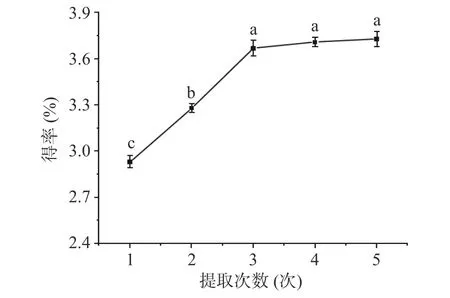
图3 提取次数对cSJP 得率的影响Fig.3 Effect of extraction times on the yield of cSJP
2.1.4 醇沉浓度对cSJP 得率的影响 由图4 可知,当乙醇浓度从40%增加到60%时,cSJP 的得率显著增加(P<0.05),总增加值为1.09%,继续加大醇沉浓度,cSJP 得率上升的趋势变缓,且醇沉浓度为70%时的cSJP 得率与60%相比无显著差异(P>0.05)。在保证多糖得率并考虑成本节约的前提下,最终选择50%、60%和70%进行响应面优化试验。
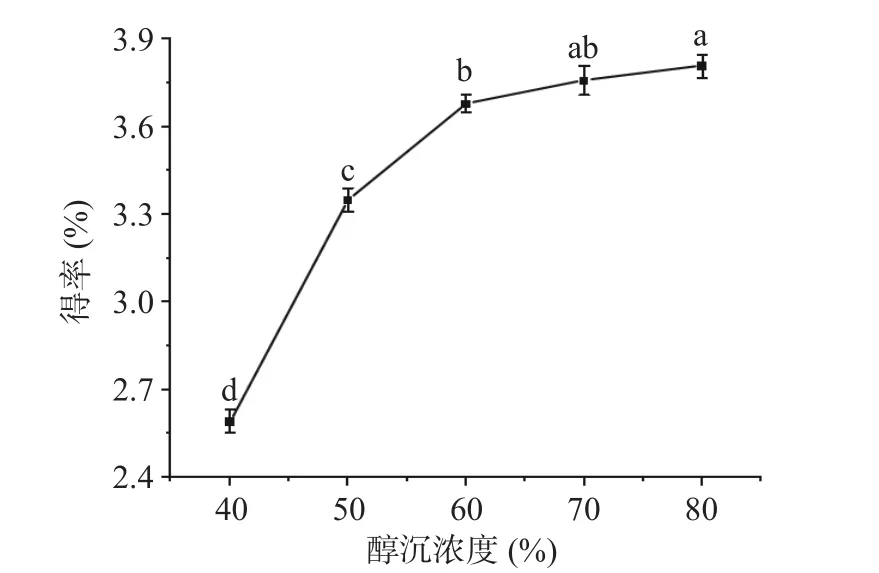
图4 醇沉浓度对cSJP 得率的影响Fig.4 Effect of alcoholic precipitation concentration on the yield of cSJP
2.2 响应面优化提取结果
2.2.1 响应面试验设计方案及结果 根据Box-Behnken 试验设计原理,选取料液比(A)、提取时间(B)和醇沉浓度(C)三个因素设计出17 组实验,以cSJP 得率为响应值,实验设计及结果见表2。
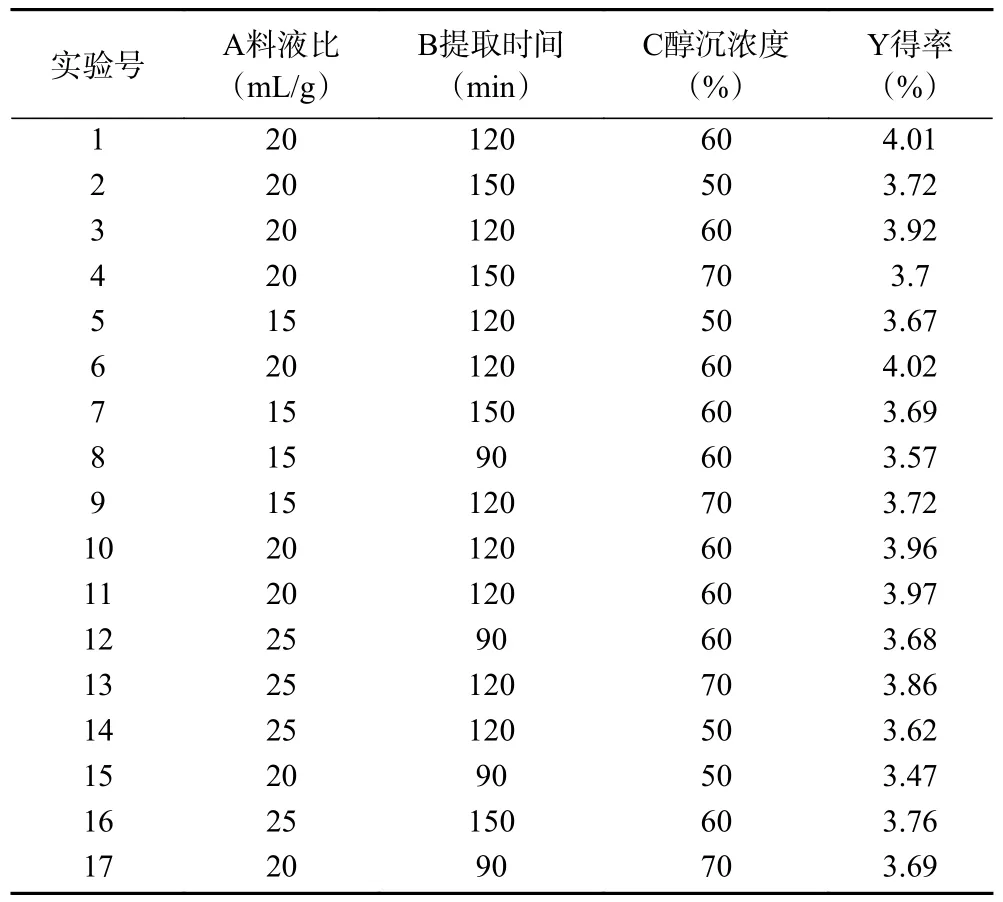
表2 响应面试验设计与结果Table 2 Response surface experimental design and results
对表2 数据进行多元回归拟合,得到的二阶多项式回归方程为:Y=3.98+0.034A+0.058B+0.061C-0.01AB+0.047AC-0.06BC-0.11A2-0.19B2-0.14C2。
由表3 可知,P值<0.0001,表明该回归模型极显著;失拟项P=0.6987>0.05,表明失拟项不显著;相关系数R2和校正决定系数R2(Adj)分别为0.9786 和0.9510,表明模型的预测值与实验值拟合度高,误差小,具有较高的可信度[28]。由F值可知,三个因素对cSJP 得率的影响程度为:醇沉浓度(C)>提取时间(B)>料液比(A)。通过P值可知,B、C、A2、B2、C2都表现为差异极显著水平(P<0.01),A、AC、BC 表现为差异显著水平(P<0.05)。

表3 方差分析结果Table 3 Analysis of variance results
2.2.2 各因素之间的交互作用分析 如图5(a)所示,提取时间响应曲面的陡峭程度大于料液比响应曲面,表明提取时间对cSJP 得率的影响大于料液比;由图5(b)可知,醇沉浓度对cSJP 得率的影响大于料液比[29],与方差分析结果一致。通过3D 图发现曲面呈中间凸四面凹的形状,说明曲面有最高点,也表明存在最优条件。
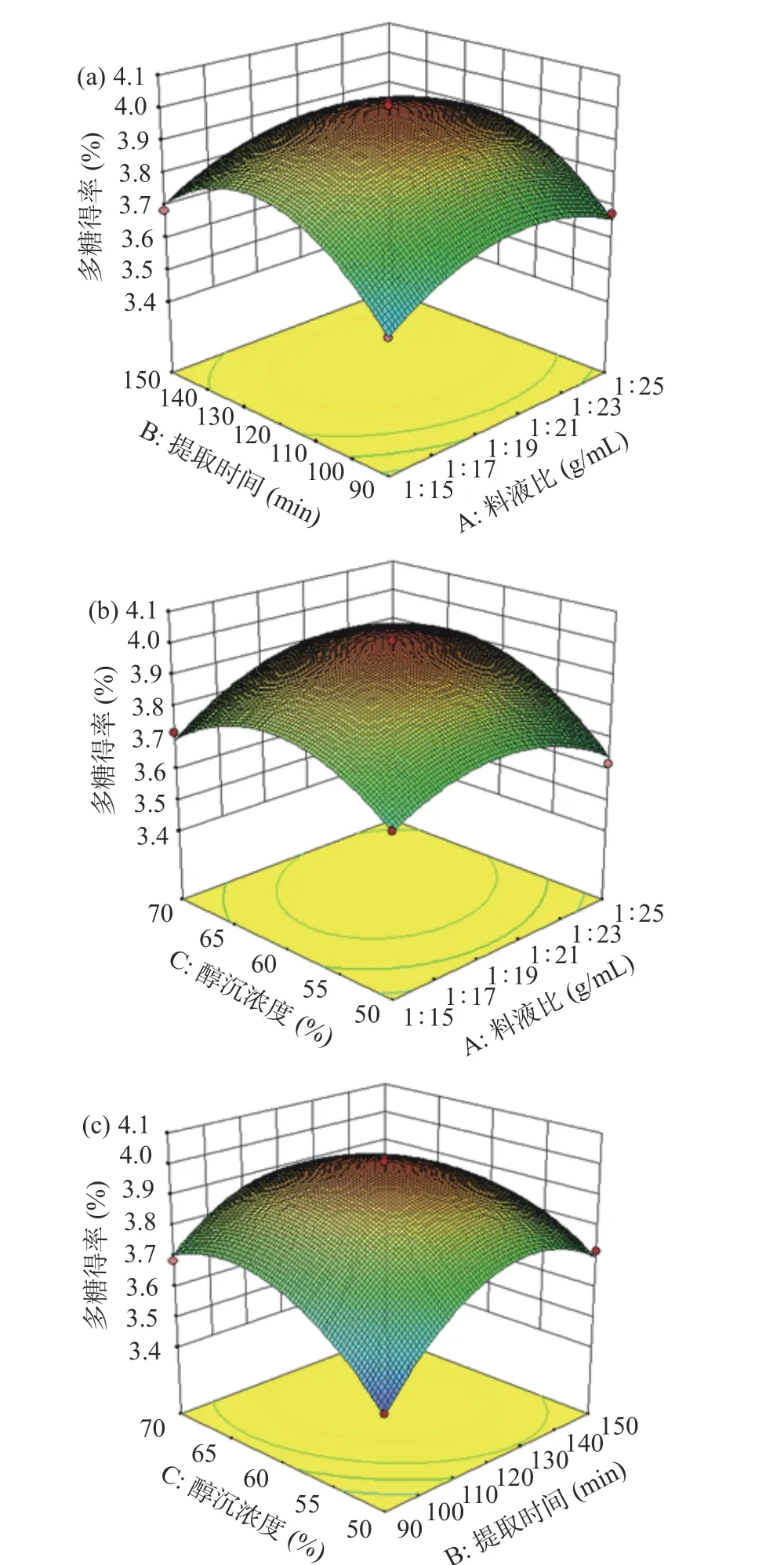
图5 各因素交互作用对cSJP 得率影响的响应曲面图Fig.5 Response surface plots of the effects of the interaction of various factors on the cSJP yield
2.2.3 最佳工艺的预测与验证 根据响应面实验得出cSJP 最佳提取条件为:料液比1:20.943 g/mL,提取时间123.411 min,醇沉浓度62.199%,槐花多糖得率的理论值为3.989%。在实际提取过程中,修正工艺条件为料液比1:20 g/mL,提取120 min,醇沉浓度60%,实验重复三次,多糖得率的平均值为3.94%,与预测得率相差不大,相对误差为1.2%,说明该模型预测槐花多糖的得率是可行的。
2.3 多糖的纯化
cSJP 的高效液相色谱图如图6(a)所示,将cSJP脱蛋白、透析之后,再用Sephadex G-200 层析柱纯化,以超纯水作为洗脱液进行洗脱,每管收集3 mL多糖洗脱溶液,测定每管糖含量。洗脱曲线如图6(b)所示,收集洗脱峰上最高处的两管,冻干后得到单一组分槐花多糖SJP。由图6(c)可知,SJP 仅在7.556 min处出现单一对称峰,表明纯化效果良好,SJP 纯度较高,是一种均质多糖[30]。
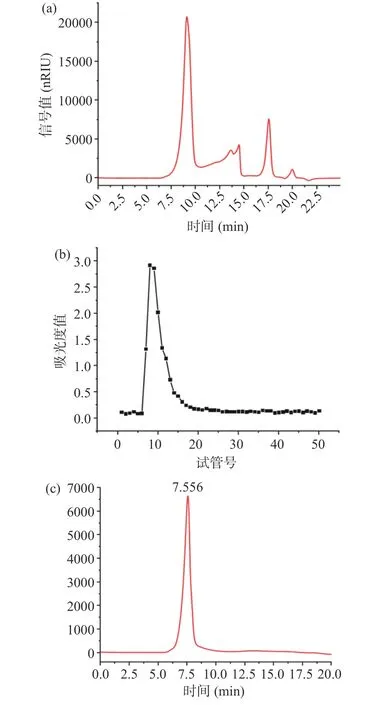
图6 分离纯化效果图Fig.6 Results of separation and purification
2.4 SJP 的结构表征
2.4.1 分子量测定 根据标准曲线回归方程y=-0.3216x+8.7973,R²=0.9989,得SJP 的分子量约为2.32×106Da(Rt=7.556 min)。王丽华[14]从槐花中分离出了三种组分的多糖,其分子量均远远低于本实验中所提取出的SJP,这可能与槐花的来源及提取工艺条件有关。
2.4.2 化学成分 经测定,SJP 中的总糖含量为93.47%±0.83%(y=7.87x-0.003,R²=0.9997),蛋白质含量为1.62%±0.13%(y=1.1253x+0.0074,R²=0.9953),糖醛酸含量为7.13%±0.51%(y=5.12x+0.0098,R2=0.9965)。
2.4.3 刚果红实验 一般情况下可以通过刚果红实验来确定多糖中是否含有三螺旋构象,这是因为具有三螺旋结构的多糖样品在弱碱性条件下能与刚果红形成络合物,导致最大吸收波长(λmax)发生红移,而在强碱性条件下,多糖分子之间的氢键被破坏,三螺旋结构分解,造成λmax迅速下降[31]。SJP 的刚果红实验的结果如图7 所示,不同NaOH 浓度下SJP 与刚果红混合后λmax变化曲线与对照组刚果红溶液的λmax变化曲线的趋势相同,即λmax随NaOH 浓度的增加而逐渐下降,表明SJP 中不含三股螺旋结构。科学研究表明提取方法的不同会造成多糖三螺旋构象的差异,如Gu 等[32]分别采用热水提取法、超声辅助提取法和亚临界水提取法从欧洲慈姑中提取出3 种多糖(SSW、SSU、SSP),结果发现SSU 和SSP 具有三螺旋结构,而SSW 不具有三螺旋结构,这可能是因为长时间的高温萃取会导致氢键的断裂,从而对SSW 的三螺旋结构产生破坏性影响。

图7 不同NaOH 浓度下刚果红与SJP 混合的λmax 变化Fig.7 Variation of λmax of the mixture of Congo red and SJP at different NaOH concentrations
2.4.4 X-射线衍射分析 XRD 作为一种阐明多糖结构的分析技术,通常用于评估聚合物的无定形或晶体性质。高结晶度的多糖存在尖锐的衍射峰,而结晶度较差的多糖则出现较宽的衍射峰。从图8 中可以看出SJP 显示出“包状”的XRD 曲线,且仅在22°左右出现较宽的衍射峰,表明SJP 结晶度低,为无定型结构[33]。
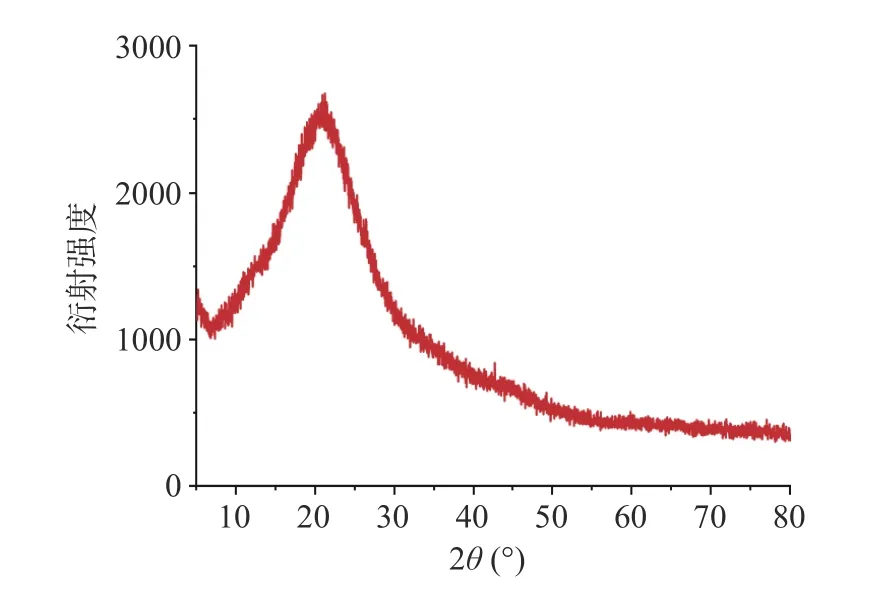
图8 SJP 的X-射线衍射图谱Fig.8 X-ray diffraction pattern of SJP
2.5 SJP 的抗氧化活性研究
2.5.1 SJP 对DPPH·的清除能力 DPPH·是一种稳定的自由基,已被广泛用于评估各种植物多糖样品的抗氧化能力[34]。由图9(a)可知,随着SJP 浓度的增加,其对DPPH·的清除能力逐渐增强。当SJP 浓度为4 mg/mL 时,DPPH·清除率为86.4%,当浓度增至5 mg/mL 时,DPPH·的清除率为89.24%,经计算,SJP 清除DPPH·的IC50值为1.09 mg/mL。结果表明,SJP 具有一定的DPPH 自由基清除能力,但其效果弱于VC。
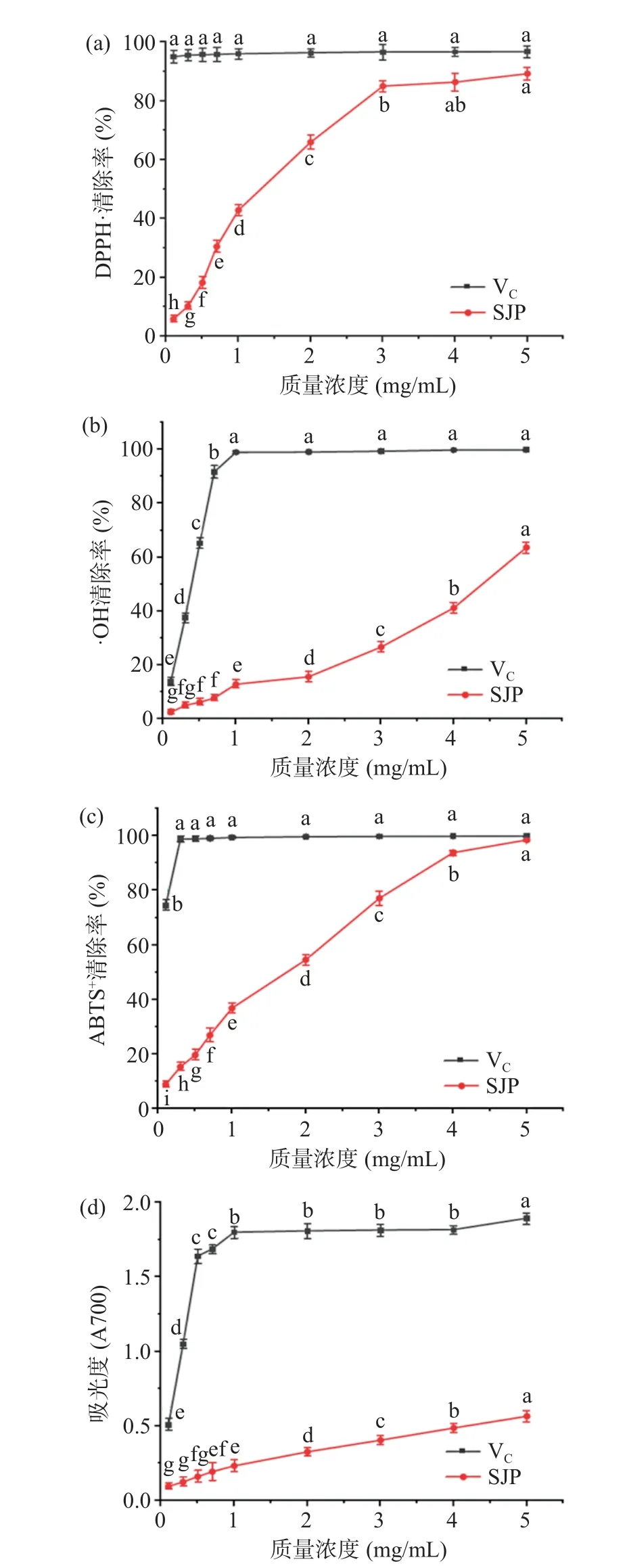
图9 不同浓度SJP 和VC 的抗氧化能力Fig.9 Antioxidant capacity of SJP and VC at different concentrations
2.5.2 SJP 对·OH 的清除能力 OH 自由基很容易与大多数生物大分子反应并造成严重的氧化损伤,因此可以通过测量多糖对·OH 的清除作用来评估多糖的抗氧化活性[35]。由图9(b)可知,SJP 的浓度越大,其对·OH 的清除能力越强。在0.1~5 mg/mL 的范围内,SJP 对·OH 的清除率由2.37%上升至63.61%,经计算可得VC和SJP 清除·OH 的IC50值分别为0.3 和4.31 mg/mL。结果表明SJP 对·OH 的清除能力较DPPH·与ABTS+·较弱,这可能与SJP 中的糖醛酸含量较低有关[36-37]。
2.5.3 SJP 对ABTS+·的清除能力 ABTS+自由基清除作用也可以用于评估多糖的抗氧化能力[34]。由图9(c)可知,SJP 对ABTS+·的清除率随浓度的升高而增加。当质量浓度为5 mg/mL 时,VC对ABTS+·的清除率为99.85%,SJP 对ABTS+·的清除率为98.5%,其清除效果达到了VC的98.65%。经计算可得SJP 清除ABTS+·的IC50值为1.39 mg/mL,表明SJP 对ABTS+·有较好的清除效果。
2.5.4 总还原力的测定 如图9(d)所示,在0.1~5 mg/mL 浓度范围内,SJP 的总还原力随着浓度的增加呈逐渐上升的趋势,但在同质量浓度下始终弱于VC。当SJP 浓度为5 mg/mL 时,其总还原力可以达到0.57。
3 结论
本文采用单因素结合响应面法优化了水提法提取槐花多糖的工艺条件,得出最佳组合为料液比1:20 g/mL,提取时间120 min,醇沉浓度60%,该条件下多糖的实际得率为3.94%。提取出的粗多糖经过脱蛋白、透析和Sephadex G-200 凝胶柱层析得到纯化多糖组分SJP,经测定其分子量为2.32×106Da,总糖含量、蛋白质含量和糖醛酸含量分别为93.47%±0.83%、1.62%±0.13%和7.13%±0.51%。刚果红实验表明SJP 不含三螺旋结构,X-射线衍射分析结果表明SJP 结晶度低,为无定型结构。抗氧化实验结果表明SJP 具有良好的DPPH·和ABTS+·清除效果,具有开发成为抗氧化剂的潜力。本研究为槐花多糖的进一步开发和应用提供了一定的理论依据,但关于槐花多糖更深层次的结构表征及具体的构效关系仍有待进一步研究。

