基于UPLC-MS/MS分析红豆杉鲜叶和茶叶非挥发性差异成分
李萌,耿婉茹,庞蕾,曲凤凤,王培强,王宝怡,王洁,张斌,张新富
(1.青岛农业大学园艺学院,山东青岛 266109)(2.济南大学研究生院,山东济南 250000)(3.山东理工大学档案馆,山东淄博 255049)(4.山东紫科曼地亚红豆杉有限公司,山东淄博 255049)
红豆杉(Taxus)是红豆杉科红豆杉属的一种裸子植物,常绿乔木和小灌木,有较高的药用价值和经济价值,也是第四纪冰川遗留下来的古老树种,被称为“植物中的黄金”[1]。红豆杉植物在全世界约有11种,主要分布于北半球的温带至亚热带地区[2,3]。我国有6种,分别为中国红豆杉、云南红豆杉、西藏红豆杉、东北红豆杉、南方红豆杉和曼地亚红豆杉[3,4]。曼地亚红豆杉(T. media)是东北红豆杉(T. cuspidata)为母本和欧洲红豆杉(T. baccata)为父本的天然杂交种,也是研究最广泛的红豆杉之一[5]。与其他红豆杉植物相比,曼地亚红豆杉生长速度快,对环境适应性强[6,7]。
自紫杉醇(一种低毒、高效、广谱的天然抗癌药物,用于治疗卵巢癌等多种疾病[7])被美国科学家Wall等[8]和Schiff等[9]从短叶红豆杉树皮中分离提取得到,红豆杉植物受到了极大的关注。Gai等[10]研究表明,在红豆杉的枝条和树叶中存在有益于健康的黄酮类化合物。此外,也在红豆杉的其他组织中鉴定出氨基酸类、酚类、生物碱、木质素和多糖等化合物[4,6,11]。据报道,这些物质具有抗氧化、抗炎和神经药理等作用,而且对乳腺癌和中枢神经系统疾病等具有显著的抑制作用[12-14]。我国传统医学名录《本草纲目》和《盛景通志》中记载红豆杉可用于治疗霍乱、伤寒等症[15]。红豆杉叶可以入药,具有消炎止痛、利尿消肿、治消化不良等功效。除此之外,相关研究表明,红豆杉茶叶能够显著有效地抑制晚期糖基化终末产物(AGEs)的形成,具有很好的抗氧化和抗糖基化作用[16],其提取物具有减轻倦怠、乏力、调节人体血脂等作用[17]。但关于红豆杉叶加工成茶前后非挥发性成分变化的研究鲜有报道。
代谢组学作为获得代谢信息和显著识别不同代谢物的常用技术,广泛用于鉴定和量化植物和食品等的代谢物研究。超高效液相色谱串联质谱(Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry,UPLC-MS/MS)分析主要侧重于鉴定和定量非挥发性成分,如氨基酸、黄酮和有机酸等初级代谢物[18-20]。本研究以红豆杉鲜叶(T. mediaFresh Leaves,TFL)及加工而成的红豆杉茶叶(T. mediaTea,TT)为材料,通过超高效液相色谱串联质谱技术分析曼地亚红豆杉鲜叶加工成茶前后的非挥发性成分种类和含量的差异变化,进一步筛选出差异成分,阐明红豆杉茶叶的非挥发性成分含量,为曼地亚红豆杉叶茶的加工和利用提供参考依据。
1 材料与方法
1.1 材料与试剂

图1 红豆杉鲜叶TFL(a)和红豆杉茶叶TT(b)Fig.1 T. media fresh leaves (a) and T. media tea (b)
试验样品为曼地亚红豆杉,由山东紫科曼地亚红豆杉有限公司提供,采摘的鲜叶一部分置于液氮中转移到-80 ℃超低温冰箱中保存备用,另一部分制成红豆杉茶叶。
甲醇(色谱级)、乙腈(色谱级),德国Meker公司;标准品(色谱级,纯度>99%),美国Sigma-Aldrich公司;纯净水,中国娃哈哈集团。
1.2 仪器与设备
6CST-40型杀青机,浙江上洋机械有限公司;6CR-30型揉捻机,浙江上洋机械有限公司;6CH94型烘干机,浙江上洋机械有限公司;DF-1140型分析天平,奥豪斯国际贸易有限公司;AB4500 Q TRAP四极杆串联飞行时间质谱仪,美国AB SCIEX公司;Nexera X2超高效液相色谱系统,日本岛津公司;Milli-Q Advantage A10纯水系统,德国Merck Millipore公司;Scientz-100F冷冻干燥机,中国新芝生物公司;MC京制00000246精密天平,德国Sartorius公司;5430R台式高速冷冻离心机,德国Eppendorf公司;G560E涡旋振荡器,美国Industrial Industries公司;1083型恒温振荡水浴器,德国GFL公司;MM400冷冻混合研磨仪,德国Retsch公司。
1.3 方法
1.3.1 红豆杉鲜叶的处理
将鲜叶从-80 ℃超低温冰箱取出,置于冷冻干燥机中冻干(真空度2 Pa、温度-50 ℃),冻干后的样品放入-80 ℃冰箱备用。
1.3.2 红豆杉茶叶的制备
工艺流程:鲜叶摊放(4 h);杀青(220 ℃,3 min);揉捻(轻10 min-重10 min-轻5 min);初烘(150 ℃,25 min);复烘(110 ℃,50 min);成品茶,放置于-80 ℃冰箱保存备用。
1.3.3 样品前处理
样品用液氮研磨成均匀粉末,称取100 mg于2 mL离心管中,加入1.2 mLφ=70%甲醇,涡旋30 s,30 min一次,共涡旋6次。离心10 min(12000 r/min)后吸取上清液至离心管中,用0.22 μm微孔滤膜过滤于进样瓶中,用于UPLC-MS/MS分析。各样本均进行三次生物学重复。
1.3.4 UPLC-MS/MS条件
1.3.4.1 UPLC条件
色谱柱:Agilent SB-C18(2.1 mm×100 mm,1.8 µm);流动相A(φ=0.1%甲酸),流动相B(乙腈);梯度洗脱:0~9 min(95%~5% A),9~10 min(5% A);10~11.10 min(5%~95% A);11.10~14 min(95% A);柱温:40 ℃;流速:0.3 mL/min;进样量4 μL。
1.3.4.2 MS/MS条件
电喷雾离子源(Electron Spray Ionization,ESI),温度500 ℃,质谱电压5500 V,气体Ⅰ(GS Ⅰ)和气体Ⅱ(GS Ⅱ)分别设置为55 psi和60 psi,帘气(Curtain Gas,CUR)25 psi,碰撞气体(氮气)5 psi,碰撞诱导电离(Collision Gas,CAD)参数设置为高。
1.4 定性定量分析
定性分析:通过保留时间和峰形信息对不同样品中的化合物质谱峰进行积分校正,以确保定性和定量分析的准确性。通过比对标准品,武汉迈特维尔生物技术有限公司自建数据库(Metware Database,MWDB)和化合物信息公共数据库KNAPSAcK(http://kanaya.naist.jp/KNApSAcK)等对TFL和TT中各化合物进行分析鉴定。
定量分析:通过峰面积归一法对得到的各化合物进行相对定量,计算每种组分的峰面积与峰面积总和的比值,作为各化合物的相对含量。试验重复三次,结果以均值±标准差表示。
1.5 数据分析
使用Microsoft excel绘制图表。使用SPSS软件进行差异显著性分析。使用R(MetaboAnalystR)软件进行正交偏最小二乘法判别分析(Orthogonal Partial Least Squares Discriminant Analysis,OPLS-DA)绘图,R(Base Package)软件进行主成分分析(Principal Component Analysis,PCA)和Venn绘图。使用Mev绘制热图。采用变量投影重要性(Variable Important In Projection,VIP)和差异倍数(Fold Change,FC)对差异性成分进行筛选。
2 结果与讨论
2.1 化合物分析
通过UPLC-MS/MS对TFL和TT进行检测,得到化合物的总离子流图和检测多峰图。两种样品共检测出796种化合物,包括196种黄酮、139种酚酸、95种氨基酸及衍生物(以下称“氨基酸类”)、91种有机酸、84种脂类、55种核苷酸及衍生物(以下称“核苷酸类”)、15种生物碱和121种其他化合物,TFL和TT的部分化合物组成和含量存在显著差异。
从图2a可以看出样本化合物在种类和数量上的差异,TFL检测到的化合物有777种,TT中的化合物为768种。如图2b所示,根据化合物在样品中的有无筛选特有成分,有6类28种物质只存在于TFL中;有6类19种物质只存在于TT中;两样品之间共有化合物749种,可以看出TFL和TT由较为一致的化合物组成,加工工艺主要对样品中化合物的含量产生显著影响。
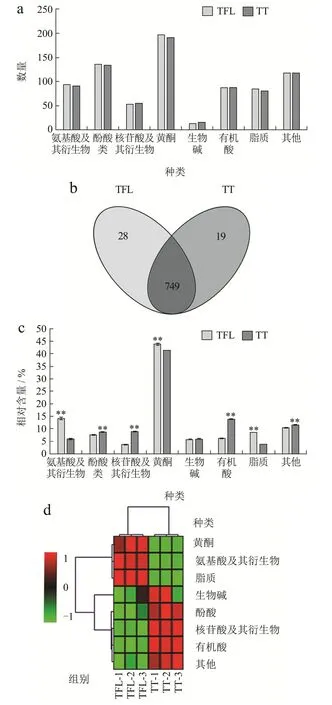
图2 TFL和TT中化合物种类的数量(a),Veen图(b),相对含量(c),聚类热图(d)Fig.2 Number (a), Veen diagram (b), relative content (c) and clustering heat diagram (d) of compound species in TFL and TT
由图2c和2d可知在加工前后各化合物含量也随之发生变化,黄酮、氨基酸类、脂质类化合物在TFL中显著积累,黄酮类物质含量占化合物的43.74%,根据结构可以分为:黄酮醇、双黄酮、异黄酮、黄烷醇类、花青素等。此外,异鼠李素仅在鲜叶中检测到,其作为一种有力的抗氧化剂,广泛存在于植物果实和叶片中[21]。其次是氨基酸类,占14.16%,L-异亮氨酸、L-正亮氨酸和L-亮氨酸等是在TFL中含量较高的氨基酸类化合物。有机酸类、酚酸类、核苷酸类、生物碱类和其他成分在TT中有较高积累。黄酮类化合物占非挥发组分的41.29%,扁蓄苷是在TFL和TT相对含量均最高的黄酮类物质,扁蓄苷具有抑制人乳腺癌细胞增殖、调控细胞周期的作用[22]。有机酸在TT中的含量仅次于黄酮占13.86%,柠康酸是TT中含量最高的有机酸,柠檬酸、异柠檬酸、苹果酸等常见有机酸也被检测到。酚酸在TT中的含量高于TFL,可以分为单羟基苯甲酸、双羟基苯甲酸、三羟基苯甲酸等,Elansary等[23]研究表明红豆杉中酚类成分可能有抗癌作用。而2-羟基腺苷、5-脱氧-5-甲硫腺苷等是核苷酸类中含量较高的化合物。刘茜等[24]发现红豆杉的抗氧化作用可能与生物碱类成分密切相关,而7-O-乙酰基紫杉碱 A是TT中含量最高的生物碱。此外,维生素、原花青素、糖及醇类等其他类在TT中也有较大比重。
黄酮类化合物是红豆杉中的重要成分之一,具有抗癌抗肿瘤的作用[25,26],研究发现,TFL和TT中含有丰富的黄酮类物质。Sun等[16]研究表明,儿茶素、表儿茶素、没食子儿茶素、表没食子儿茶素等化合物是红豆杉茶叶中有效抗氧化成分,这些成分在试验中均被检测到。此外,金松双黄酮、芹菜素等成分也均被检测到,与之前的研究结果一致[27]。紫杉醇被公认为世界上最有效的植物抗癌药[28],先前研究报道,紫杉醇主要从红豆杉植株的树皮中提取制备,其含量约为干重的0.005%~0.07%[29]。已有研究表明,紫杉醇在曼地亚红豆杉的种子中的相对含量最高,其次为树皮、鲜叶、种皮[30]。本试验发现,紫杉醇在曼地亚红豆杉鲜叶中的相对含量为0.28%,加工成茶后其含量上升为0.56%,表明加工过程能够促进紫杉醇的形成。因此,通过将红豆杉鲜叶加工成茶的方式提取紫杉醇,避免了剥取树皮造成的植株死亡,以更好的保护红豆杉资源。
2.2 PCA分析
主成分分析为无监督模识别的分析方法,通过对数据“简化和降维”对代谢谱进行处理归纳,显示样本组之间是否存在差异。通过PCA分析,可以直观的从总体反映出TFL和TT中样本组之间的差异度大小。由图3a可知,第1主成分(PCA)和第2主成分(PC2)的贡献率分别为77.85%和6.93%,总贡献率为84.78%,说明TFL和TT二者之间整体区分度较好。

图3 TFL和TT化合物的PCA图(a)和OPLS-DA图(b)Fig.3 The PCA diagram (a) and the OPLS-DA diagram (b) of compounds in TFL and TT
2.3 OPLS-DA分析
进一步采用有监督的OPLS-DA模型分析796种化合物(图3b)。在OPLS-DA中,主要通过参数指标对模型质量进行评估,R2X越接近1,模型越稳定可靠;R2Y越大,模型的解释能力越强;Q2大于0.9,模型为出色的模型。由图3b可以看出,各样本在区间和组间区分效果较好,差异明显。R2X=0.841,R2Y=1,Q2=0.995,说明本研究建立的OPLS-DA模型具有良好的拟合参数,该模型对TFL和TT具有良好的稳定性和较好的预测能力,可以利用VIP值筛选差异成分。
2.4 差异化合物分析
基于OPLS-DA结果获得的VIP值筛选差异化合物,通常认为VIP≥1.0为差异显著,VIP值越大,差异越显著。进一步结合FC值判断变化趋势。根据VIP>1,fold change≥2和fold change≤0.5相结合的方法筛选得到差异化合物330种,氨基酸类63种,黄酮60种,脂类59种,酚酸51种,有机酸30种,核苷酸类22种,生物碱8种和其他化合物37种。
为了更直观的观察变化规律,对鉴定出的330种差异化合物进行可视化处理,如图4a和4b所示。有225种差异化合物显著下降,这些物质以氨基酸、脂质、黄酮、酚酸等化合物为主,主要包括L-甘氨酰-L-异亮氨酸、γ-亚油酸、根皮素、松柏醇等,占所有化合物的28.26%,其中苯甲醛是下调最大的差异化合物。有105种差异化合物显著增加,这些物质以有机酸类为主,主要包括柠康酸、3,5-二羟基-3-甲基戊酸、L-谷氨酸-O-葡萄糖苷等,占所有化合物的13.19%,其中柠康酸是上调最大的差异化合物。无差异显著的化合物有446种,占56.03%。

图4 TFL和TT的差异化合物热图(a),差异化合物火山图(b),投影重要性示意图(c)和基于log2FC值对关键差异化合物筛选(d)Fig.4 The heat map of differential compounds (a), the volcano diagram of differential compounds (b), the schematic diagram of the importance of projection (c), and screening of key difference compounds based on log2FC value (d) in TFL and TT
黄酮作为茶汤苦涩味的主要贡献物,与茶汤口的感紧密相关,也是茶汤中重要的着色物质[31]。在60种黄酮差异化合物中,39种化合物下调,21种化合物上调。槲皮素、柚皮素等大部分化合物的含量在加工后显著下降,可能是在加工过程中发生了水解、酶促和氧化反应,导致加工过程中产生苷元和糖体[32,33]。
氨基酸不仅是茶汤鲜爽的主要基础物质,还会影响茶的香气和品质[34]。在本研究中鉴定出63种氨基酸差异化合物,52种化合物下调,11种化合物上调,L-瓜氨酸则是TFL和TT中差异最大的氨基酸类化合物。在加工后,L-丝氨酸、L-赖氨酸等的含量显著降低。N-乙酰-L-亮氨酸、L-谷氨酸-O-葡萄糖苷等的含量显著增加,这些变化对茶汤的滋味有一定的影响。这可能是由于高温和干燥的作用促进了氨基酸的氧化和糖基化反应,导致氨基酸发生脱羧或脱氨[35]。在揉捻过程中细胞破碎率增加,也使得氨基酸的浸出加快[36]。因此,在加工过程中可以合理的减轻揉捻,降低杀青温度,增加氨基酸物质的积累。
本文检测的各种脂类差异化合物,主要包括游离脂肪酸、甘油酯、溶血磷脂酰胆碱和溶血磷脂酰乙醇胺,加工后除了1种游离脂肪酸(十五烷酸)有所上调,其余的化合物均呈下降趋势。研究表明,脂类在供氧充足的情况下会氧化分解生成烃、醇和酸等化合物[37]。之前的研究表明,温度对植物脂类风味物质的形成具有显著性影响,在热力下作用下可引起脂类降解[38,39],从而表明脂类降解与加工温度有关。
有机酸作为重要的呈味物质,是碳水化合物分解的中间产物,同时抑制苦味和涩味[40]。在30种有机酸差异化合物中,吡咯-2-羧酸、柠康酸、3,5-二羟基-3-甲基戊酸、茉莉酸甲酯是在加工后形成的独特化合物,表明加工条件促进了这些化合物的形成。在加工过程中,琥珀酸等常见有机酸的含量显著增加,这些呈味物质的含量变化对调和茶汤滋味起到了重要作用。
加工后原儿茶醛、对羟基苯甲酸、阿魏酸等酚酸类化合物含量显著上调。相比之下,龙胆酸、原儿茶酸、咖啡酸在加工后显著上调。此外,苯甲醛具有特殊的杏仁和坚果香气[41],在加工后显著下降。1,3,5-苯三酚在加工后显著上调。这些结果表明,在加工过程中可能发生了强烈的氧化还原和水解反应,以促进酚酸类物质的转化[42]。
茶汤的风味与茶叶中滋味成分的含量及比例等都有密切关系。从结果可以看出加工工艺对于化合物的转化特别重要。因此,可以通过调整加工过程中温度、时间和其他影响化合物转化的一些参数,降低茶汤的苦涩味,改善茶汤口感,从而获得优良风味品质的成茶。
2.5 关键差异化合物分析
图4c为差异化合物VIP贡献值最大的前20种物质,其中11种化合物为上调趋势,包括澳大利亚紫杉碱、3,4-二羟基苯乙酸、柠康酸、(2'S3'R)-5-(N,N二甲基-3'-苯基异丝氨酰)-红豆杉三烯A、3-O-甲基没食子酸、1,3,5-苯三酚、3-羟基吡啶、3,5-二羟基-3-甲基戊酸、1-甲基胍、茉莉酸甲酯、吡咯-2-羧酸;9种化合物为下调趋势,包括9-过氧-10E,12Z-十八碳二烯酸、苯甲醛、木犀草素-7-O-(6''-咖啡酰)鼠李糖苷、1,18-十八烷二醇、13-羟基十八烷基-9,11-二烯酸、异鼠李素、2,4,6-三羟基苯甲酸甲酯、橙皮素-7-O-葡萄糖苷、L-甘氨酰-L-脯氨酸。
进一步进行log2处理,比较TFL和TT化合物的差异倍数,前20种差异化合物如图4d所示。与TFL相比,上调的前10种差异化合物包括柠康酸(23.50倍)、3,5-二羟基-3-甲基戊酸(20.73倍)、(2'S3'R)-5-(N,N二甲基-3'-苯基异丝氨酰)-红豆杉三烯A(18.64倍)、1,3,5-苯三酚(18.33倍)、澳大利亚紫杉碱(16.96倍)、L-谷氨酰胺-O-葡萄糖苷(15.16倍)、丁香醛-4-O-葡萄糖苷(14.36倍)、核酮糖-5-磷酸(14.09倍)、3-羟基吡啶(13.58倍)、吡咯-2-羧酸(13.41倍);下调的前10种差异化合物包括苯甲醛(-18.48倍)、橙皮素-7-O-葡萄糖苷(-17.06倍)、L-瓜氨酸(-15.27倍)、9-过氧-10E,12Z-十八碳二烯酸(-14.71倍)、二氢阿魏酸(-14.39倍)、L-岩藻糖(-14.23倍)、芥子酸(-13.00倍)、木犀草素-7-O-(6''-咖啡酰)鼠李糖苷(-12.94倍)、N-乙酰-D-半乳糖胺(-12.84倍)、琥珀酸半醛(-12.15倍)。
综上所述,根据VIP值和FC值结合分析可知TFL和TT中11种关键差异代谢物为柠康酸、3,5-二羟基-3-甲基戊酸、(2'S3'R)-5-(N,N二甲基-3'-苯基异丝氨酰)-红豆杉三烯A、1,3,5-苯三酚、澳大利亚紫杉碱、3-羟基吡啶、吡咯-2-羧酸在TT中含量较高;苯甲醛、橙皮素-7-O-葡萄糖苷、9-过氧-10E,12Z-十八碳二烯酸、木犀草素-7-O-(6''-咖啡酰)鼠李糖苷在TFL中含量较高。
2.6 差异化合物通路分析
通过KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对差异化合物进行通路富集分析,结果(图5a)显示主要分布在20条代谢途径中,差异化合物数量富集最多的前3条通路分别是①代谢产物的生物合成通路(Metabolic Pathways,图5b),主要包括苯甲醛、L-岩藻糖、柚皮素、以及关键差异代谢物柠康酸等123种化合物,在此通路上有39种化合物上调,84种化合物下调;②次生代谢物的生物合成通路(Biosynthesis of Secondary Metabolites,图5c),主要包括茉莉酸甲酯、根皮素、香橙素以及3,5-二羟基-3-甲基戊酸等86种化合物,在此通路上有23种化合物上调,45种化合物下调;③辅因子的生物合成通路(Biosynthesis of Cofactors,图5d),主要包括L-酪胺、烟酰胺、视黄醇,L-酪氨酸等29种化合物,在此通路上有10种化合物上调,19种化合物下调。

图5 TFL和TT差异化合物KEGG富集图(a)和KEGG通路图(b~d)Fig.5 The KEGG enrichment diagram (a) and KEGG pathway diagram (b~d) of differential compounds in TFL and TT
3 结论
本研究通过广泛靶向代谢组学探究了红豆杉鲜叶加工成茶前后非挥发性化合物种类和含量的差异变化。在TFL和TT中共检测出796种化合物,两种样本在物质种类和数量上的组成基本一致。根据PCA结合OPLS-DA筛选出差异化合物330种,其中氨基酸、脂质、黄酮、酚酸等255种化合物显著降低,有机酸等105种化合物显著增加。TFL和TT的关键差异化合物有11种,柠康酸、3,5-二羟基-3-甲基戊酸、(2'S3'R)-5-(N,N二甲基-3'-苯基异丝氨酰)-红豆杉三烯A、1,3,5-苯三酚、澳大利亚紫杉碱、3-羟基吡啶、吡咯-2-羧酸在TT中含量较高;苯甲醛、橙皮素-7-O-葡萄糖苷、9-过氧-10E,12Z-十八碳二烯酸、木犀草素-7-O-(6''-咖啡酰)鼠李糖苷在TFL中含量较高。通过KEGG数据库对差异化合物进行通路富集分析,找到了差异化合物数量富集最多的前3条通路,分别是①代谢产物的生物合成通路;②次生代谢物的生物合成通路;③辅因子的生物合成通路。本项研究仅对红豆杉鲜叶加工成茶前后的非挥发性成分进行了初步比较,所检测到的物质可为红豆杉鲜叶的功能研究及开发利用提供一定的参考。未来,红豆杉叶茶的生物利用度和体内有益作用应受到更多关注。

