lncRNA NEAT1 促进脓毒症诱导肝细胞损伤和炎症反应的机制研究
曹纪玲,孙 坚,吴 勇,胡志青
(1. 南京江北医院重症监护室,江苏 南京 210048;2. 南京江北医院急诊医学,江苏 南京210048;3. 南京江北医院重症医学,江苏 南京 210048)
脓毒症是由感染引起的致命性疾病,可诱发全身炎症反应综合征(systemic inflammatory reaction syndrome,SIRS)。目前,脓毒症患者的病死率为25%~30%[1-2],但尚无特异且有效的脓毒症相关肝损伤的治疗干预措施[3]。因此,深入研究脓毒症的发病机制至关重要。
miRNA 是一大类短链非编码RNA 分子,其靶向mRNA 并抑制基因的翻译。miRNA 参与许多生物学过程,包括细胞分化、增殖、凋亡等。脓毒症患者存在miRNA 水平失调或差异性表达[4]。有研究表明,miR-129-5p 可以减轻脓毒症引起的肺损伤[5]。然而,炎症条件下miR-129-5p 是否在脓毒症引起的肝损伤中起关键作用目前尚不清楚。lncRNA 是长度超过200 nt 的非编码RNA,参与多个生物过程。lncRNA 和miRNA 可以相互结合,进一步促进转录后调控。lncRNA 核旁斑组装转录本1(nuclear paraspeckle assembly transcript 1,NEAT1)在肿瘤发生中发挥关键作用,其过表达与癌症患者的不良预后有关[6]。此外,lncRNA NEAT1 在脓毒症诱导的急性肾损伤患者中明显上调,其上调与脓毒症患者急性肾损伤的严重程度相关[7]。然而,lncRNA NEAT1 在脓毒症引起的肝损伤中的作用仍不清楚。
本研究通过分析lncRNA NEAT1 对miR-129-5p 及其预测的靶基因Toll样受体4(Toll-like receptor 4 gene,TLR4)的调控作用,探讨脓毒症诱导的肝细胞损伤和炎症反应机制,现报道如下。
1 材料与方法
1.1 临床标本
收集我院重症监护室15 例脓毒症致肝损伤患者的外周血和体检的15例健康者的外周血,分别设为脓毒症组和健康组。根据《赫尔辛基宣言》,本研究经我院医学伦理委员会审批通过(2021046),每个受试者均签署对本研究的知情同意书。
1.2 NCTC1469细胞培养
小鼠正常肝细胞NCTC1469 购于武汉普诺赛生命科学有限公司。将NCTC1469 细胞置于含2 mmol/L 谷氨酰胺的无血清RPMI 1640 培养基(美国Gibco 公司)中,并在37 °C、5%CO2的湿润培养箱中培养。
1.3 细胞转染与分组
NCTC1469 细胞用100 mmol/L 脂多糖(lipopolysaccharide,LPS)单独刺激24 h,建立体外脓毒症模型,待细胞中炎症因子表达显著上调,表明LPS 诱导的体外模型成功建立,将其设为LPS 组。将未处理的NCTC1469细胞设为对照组。
转染前将NCTC1469细胞接种于12孔板中培养24 h。当细胞融合达70%~90%时,使用Lipofectamine 2000试剂(美国Invitrogen 公司)转染6 h 后,更换培养基培养24 h,收集细胞和细胞上清,用于后续细胞实验。单独转染mimic NC、mimic、inhibitor NC、inhibitor 质粒载体(上海吉玛公司)的NCTC1469细胞分别设为mimic NC组、mimic组、inhibitor NC组、inhibitor组。
另外,当细胞融合达70%~90% 时,使用Lipofectamine 2000 试剂转染6 h 后更换培养基,用100 mmol/L LPS 刺激细胞24 h,或者LPS 联合45 mg/L TLR4重组蛋白(英国Abcam 公司)刺激细胞24 h,收集细胞和细胞上清,用于后续细胞实验。将LPS刺激下转染mimic NC、mimic、siNC、siNEAT1 质粒载体的细胞分别设为LPS+mimic NC 组、LPS+mimic 组、LPS+siNC 组和LPS+siNEAT1 组,将LPS、siNEAT1、TLR4 重组蛋白联合处理的细胞设为LPS+siNEAT1+TLR4 组,将LPS、mimic、TLR4 重组蛋白联合处理的细胞设为LPS+mimic+TLR4组。
1.4 RNA提取和qPCR分析
将健康组、脓毒症组的外周血及处理好的NCTC1469细胞置于冰上,加入TRIzol试剂(美国ThermoFisher 公司)裂解5~10 min,将液体排入EP 离心管,加入1/5 体积的氯仿;液体混合后在4 ℃下放置10~15 min,随后离心15 min;取出400~500 μL上清液并放入新的EP 管中。加入等体积的异丙醇,在4 ℃下孵育10 min,然后以12 000 r/min 离心10 min。所得颗粒用75%乙醇洗涤,干燥后加入50 μL DEPC水完全溶解颗粒,然后于-80 ℃下储存。根据说明书,用TRIzol 试剂提取血液或细胞总RNA。在溴化乙锭染色的1%琼脂糖凝胶上电泳确认RNA的完整性。使用PrimeScriptTMRT 试剂盒(日本Takara 公司)逆转录1 μg 总RNA。用于扩增的引物序列见表1。GAPDH 用于内参基因。

表1 引物序列
1.5 Western blot
使用RIPA裂解缓冲液制备用于裂解的全细胞裂解物,然后在SDS-PAGE凝胶上分离并转移到PVDF膜上。使用TLR4、GAPDH一抗和适当的辣根过氧化物酶偶联二抗进行蛋白免疫印迹分析,然后用增强的化学发光试剂检测蛋白表达,并使用光密度测定法进行量化。
1.6 ELISA法
NCTC1469 细胞在96 孔板中用含10%FBS 和1%青霉素-链霉素的DMEM培养,以5 000个/孔的密度在37 °C、5%CO2加湿培养箱中培养。收集对数生长期的NCTC1469 细胞及细胞培养上清液,按照ELISA 试剂盒说明书分别检测TNF-α、IL-6、IL-1β 水平。分离外周血血清后,按照说明书检测外周血中TNF-α、IL-6、IL-1β水平。
1.7 5'-脱氧朊啶核苷酸末端标记(TdT-mediatedd UTP Nick-End Labeling,TUNEL)检测细胞凋亡
各组NCTC1469 细胞用PBS 洗涤,然后用4%多聚甲醛固定。实验根据TUNEL 试剂盒(上海碧云天生物科技有限公司)说明书进行。TUNEL 阳性细胞视为凋亡。使用荧光显微镜(德国蔡司Axio Vert A1)获得荧光图像。显微镜下以TUNEL 阳性细胞占总细胞的比例计算细胞凋亡率。
1.8 双荧光素酶报告基因检测
将含预测的miR-129-5p 结合位点或相应突变片段的lncRNA NEAT1/TLR4 基因片段克隆到pGL3 基本载体中。mimic 的寡核苷酸用于miR-129-5p 过表达。在转染过程中,pGL3、miRNAoligos和pRL质粒与Lipofectamine3000(美国ThermoFisherScientific 公司)以1∶3(DNA:Lipofectamine)的比例共转染到NCTC1469 细胞中。转染48 h后,使用测定试剂盒说明书(美国普洛麦格公司)检测海肾荧光素酶活性和萤火虫荧光素酶活性,计算萤火虫荧光素酶活性/海肾荧光素酶活性的比值。
1.9 统计学分析
使用Graph Pad Prism 83.0 进行统计分析。正态分布的数据以均数±标准差(±s)表示。组间比较采用单因素方差分析,LSD-t法分析两两比较的差异。P<0.05为差异具有统计学意义。
2 结果
2.1 lncRNA NEAT1、miR-129-5p、TLR4 和炎症因子在脓毒症诱导的肝损伤患者体内的表达
qPCR 结果显示,与健康组相比,脓毒症组外周血中lncRNA NEAT1和TLR4的表达明显升高(P<0.05),而miR-129-5p的表达明显降低(P<0.05),见图1a。miR-129-5p表达与lncRNA NEAT1、TLR4 表达均呈负相关(P<0.05),lncRNA NEAT1 表达与TLR4 表达呈正相关(P<0.05),见图1b。脓毒症组外周血中TNF-α、IL-6 和IL-1β的表达比健康组分别高1.5、3.0、38.0倍(P<0.05),且ELISA获得了类似的结果(P<0.05),见图1c、d。
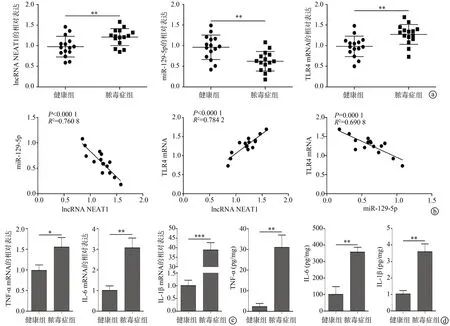
图1 脓毒症组和健康组外周血中lncRNA NEAT1、miR-129-5p、TLR4及炎症因子的表达
2.2 LPS 刺激下沉默lncRNA NEAT1 对miR-129-5p表达的影响
与对照组比较,LPS 组lncRNA NEAT1 的表达增加,miR-129-5p 的表达减少(P<0.01);与LPS 组、LPS+siNC 组比较,LPS+siNEAT1 组中lncRNA NEAT1 的表达降低,miR-129-5p的表达增加(P<0.01),见图2。

图2 LPS刺激下沉默lncRNA NEAT1对miR-129-5p的影响
2.3 LPS 刺激下lncRNA NEAT1 通过调控TLR4 对肝细胞炎症和凋亡的作用
与对照组比较,LPS+siNC 组中TLR4 mRNA 和蛋白表达水平均上调(P<0.05);与LPS+siNC 组比较,LPS+siNEAT1 组中TLR4 mRNA 和蛋白表达水平均下调(P<0.05);与LPS+siNEAT1 组比较,LPS+siNEAT1+TLR4 组中TLR4 mRNA 和蛋白表达水平均上调(P<0.05),见图3a、b。与对照组比较,LPS+siNC 组中细胞凋亡率上调(P<0.05);与LPS+siNC 组比较,与LPS+siNEAT1 组中细胞凋亡率下调(P<0.05);LPS+siNEAT1 组比较,LPS+siNEAT1+TLR4 组中细胞凋亡率上调(P<0.05),见图3c。与对照组比较,LPS+siNC 组中TNF- α、IL-6 和IL-1β 的表达均上调(P<0.05);与LPS+siNC 组比较,LPS+siNEAT1 组中TNF-α、IL-6 和IL-1β 的表达均下调(P<0.05);与LPS+siNEAT1 组比较,LPS+siNEAT1+TLR4 组中TNF-α、IL-6和IL-1β的表达均上调(P<0.05),见图3d、e。

图3 LPS通过上调lncRNA NEAT1促进TLR4的表达诱导炎症反应和细胞损伤
2.4 lncRNA NEAT1/miR-129-5p 及miR-129-5p/TLR4的相互作用
经生物信息学软件TargetScan 预测发现,lncRNA NEAT1和miR-129-5p之间存在结合碱基区(图4a)。双荧光素酶基因报告实验测定结果显示,在野生型(NEAT1-WT)中,与mimic NC 组比较,mimic 组的荧光素酶活性降低(P<0.05);在突变型(NEAT1-MUT)中,与mimic NC组比较,mimic组的荧光素酶活性变化无统计学意义(P>0.05),见图4a。miR-129-5p 与lncRNA NEAT1存在相互作用。qPCR分析显示,siNEAT1沉默了lncRNA NEAT1 并增加了miR-129-5p 的表达(P<0.01),见图4b、c。

图4 lncRNA NEAT1/miR-129-5p及miR-129-5p/TLR4的相互作用
进一步分析miR-129-5p 与TLR4 的相互作用。生物信息学软件TargetScan 预测miR-129-5p 和TLR4 有多个结合位点(图4d)。双荧光素酶报告基因实验结果显示,miR-129-5p 与TLR4 之间存在靶向关系。mimic明显降低了TLR4野生型(WT)细胞的荧光素酶活性(P<0.01),而对TLR4 突变型(MUT)细胞的荧光素酶活性无影响(P>0.05),见图4e。与mimic NC 组比较,mimic组中miR-129-5p的表达增加,TLR4的mRNA和蛋白表达显著下调(P<0.05);与inhibitor NC 组比较,inhibitor 组中miR-129-5p 的表达下调,TLR4 的mRNA和蛋白表达上调(P<0.05),见图4f~h。
2.5 lncRNA NEAT1 通过miR-129-5p 靶向TLR4 调节LPS诱导的炎症反应
qPCR 结果显示,与对照组比较,LPS+mimic NC 组TNF-α、IL-6 和IL-1β 的mRNA 表达增加(P<0.05);与LPS+mimic NC 组比较,LPS+mimic 组TNF-α、IL-6 和IL-1β的mRNA表达降低(P<0.05);与LPS+mimic组比较,LPS+mimic+TLR4 组TNF-α、IL-6 和IL-1β 的mRNA表达增加(P<0.05),见图5a~c。ELISA 实验所观察到的TNF-α、IL-6 和IL-1β 表达结果与qPCR 的结果相似(P<0.05),见图5d~f。因此,TLR4 作为miR-129-5p 的下游效应分子调节LPS 诱导的炎症反应。TUNEL 实验结果显示,与对照组比较,LPS+mimic NC 组的细胞凋亡率增加(P<0.05);与LPS+mimic NC 组比较,LPS+mimic 组的细胞凋亡率降低(P<0.05);与LPS+mimic组比较,LPS+mimic+TLR4 组的细胞凋亡率增加(P<0.05),见图5g。

图5 miR-129-5p表达可诱导炎症反应和细胞损伤
3 讨论
脓毒症是一种全身性炎症反应,严重时可能导致器官功能障碍和/或循环障碍[7]。失调的炎症反应在脓毒症引起的肝损伤中起关键作用[8]。之前的研究证实了多种microRNA 和lncRNA 与炎症反应都有关[9-11],然而,其在调节脓毒症引起的肝损伤中的具体作用尚未明确。本研究根据TargetScan 软件预测发现,lncRNA NEAT1 与miR-129-5p 之间存在相互作用,这可能与脓毒症患者的严重程度和预后不良有关。此外,本研究观察到脓毒症诱导的肝损伤患者体内的TNF-α、IL-6、IL-1β、lncRNA NEAT1 和TLR4 的表达均增加,但miR-129-5p 的表达水平降低。进一步证明了lncRNA NEAT1 可通过调节miR-129-5p 的表达,靶向TLR4 来调节LPS诱导的炎症反应。这些研究结果为脓毒症引起肝损伤的治疗提供了一个潜在治疗靶点。
研究表明,lncRNA NEAT1 在脓毒症患者体内表达上调,其在脓毒症诱导的急性肾损伤中也扮演着重要角色[12-13]。本研究结果显示,在脓毒症诱导的肝损伤患者中,lncRNA NEAT1 表达也升高,这与之前的研究一致。另外,lncRNA NEAT1 的升高还伴随着miR-129-5p的抑制、TLR4的激活以及炎症反应的显著增加。本研究结果显示,miR-129-5p 与lncRNA NEAT1、TLR4 均呈负相关,而lncRNA NEAT1 与TLR4呈正相关。之前研究也指出,lncRNA NEAT1 可通过与miR-129-5p 的结合,抑制miR-129-5p 的表达从而促进酒精性脂肪肝的肝纤维化[14]。因此,本研究在脓毒症中证实了lncRNA NEAT1、miR-129-5p 和TLR4 在介导脓毒症诱导的肝损伤中具有显著的相关性。
在实验性脓毒症模型中,LPS 通常用于研究脓毒症期间的炎症反应[15-17]。本研究发现,与脓毒症引起肝损伤患者的lncRNA NEAT1表达上调结果一致,LPS刺激后肝细胞中lncRNA NEAT1 的表达上调,而沉默lncRNA NEAT1 则降低了LPS 诱导的炎症细胞因子水平。此外,用TLR4 重组蛋白上调TLR4 的表达可以逆转沉默lncRNA NEAT1 对细胞凋亡和炎症细胞因子表达的抑制作用,这表明miR-129-5p 和TLR4 在lncRNA NEAT1的下游扮演重要角色。
本研究结果还显示,lncRNA NEAT1/miR-129-5p和miR-129-5p/TLR4直接结合,这可能是lncRNA的内源竞争性RNA机制发挥的作用[18-19]。本研究通过双荧光素酶报告基因实验证实lncRNA NEAT1与miR-129-5p可直接结合,并且证实TLR4是miR-129-5p的靶基因,TLR4可以被miR-129-5p 靶向抑制。因此,本研究认为在LPS 刺激下,lncRNA NEAT1 的表达显著上调,随后与miR-129-5p 竞争性结合,使细胞中miR-129-5p 的表达显著降低,提示lncRNA NEAT1 扮演了内源竞争性RNA,从而激活被miR-129-5p 抑制的靶基因TLR4,TLR4被激活后刺激下游信号传导,导致严重的炎症反应并诱导肝损伤。
综上,lncRNA NEAT1 在脓毒症引起的肝损伤中具有重要的生物学功能,其在脓毒症诱导的肝损伤患者体内表达上调,且与miR-129-5p 竞争并调节TLR4,以促进肝损伤。揭示了lncRNA NEAT1/miR-129-5p/TLR4轴在脓毒症诱导的肝损伤中的重要功能,为脓毒症诱导的肝损伤提供了潜在的治疗靶点。

