miR-524-5p调控HEG1表达对食管癌细胞上皮间质转化的影响
王娅菲,耿天祥,陈林林,李治国,李世朋
0 引言
食管癌(esophageal cancer, EC)是临床上常见的迁移、侵袭能力很强的癌症之一[1],致病因素包括吸烟、饮酒、社会地位低下、生存环境不佳、微量元素缺乏等[2]。食管癌术后预后较差,化疗是治疗食管癌的主要手段,但长期使用化疗药物会产生耐药性,导致治疗效果不佳。目前,靶向疗法在食管癌的临床治疗中已发挥了重要作用[3]。研究发现miRNA及其靶基因在食管癌中与免疫浸润、肿瘤微环境、癌症干性特性和上皮间质转化(epithelial-mesenchymal transition, EMT)呈现不同程度的相关性[4]。研究表明多种miRNA通过调控其靶基因影响食管癌细胞的迁移、侵袭能力,如miR-493过表达靶向Wnt5a/PD-L1[5]、miR-2053过表达靶向KIF3C[6]等均可抑制食管癌细胞增殖、迁移和侵袭,起抑癌作用。Starbase数据库预测显示miR-524-5p与具有EGF样结构域的心脏发育蛋白1(heart development protein with EGFlike domains 1, HEG1)有结合位点。已知HEG1在肝癌细胞中表达上调,并且可以促进肝癌细胞侵袭转移和EMT进程[7-8]。本研究拟探讨miR-524-5p是否通过调节HEG1影响食管癌细胞的增殖、EMT和侵袭转移并对此进行研究。
1 材料与方法
1.1 细胞
人食管癌细胞TE-1购自上海泽叶生物科技有限公司;人食管癌细胞KYSE30、KYSE150购自上海烜雅生物科技有限公司;人食管癌细胞NEC由上海生化细胞所提供;人正常食管上皮细胞HEEC购自上海研域生物科技有限公司。
1.2 试剂与仪器
RPMI 1640培养基购自上海麦克林生化科技有限公司;miR-524-5p过表达(miR-524-5p mimic)或阴性对照(miR-524-5p NC)序列购自上海吉玛制药公司;胎牛血清(FBS)、LipofectamineTM2000转染试剂购自赛默飞世尔科技(中国)有限公司;CCK-8试剂盒购自上海宏叶生物科技有限公司;双荧光素酶试剂盒购自上海通蔚实业有限公司;一抗MMP2、MMP9、E-cadherin、Vimentin、N-cadherin、Snail和二抗均购自艾博抗(上海)贸易有限公司;HEG1抗体购自美国Invitrogen公司。仪器:CO2恒温培养箱购自德国艾本德公司;荧光倒置显微镜购自徕卡显微系统上海贸易有限公司;PCR仪购自赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 细胞培养 将1.1中四种人食管癌细胞和人正常食管上皮细胞用RPMI1640培养基(含有10%FBS,青霉素100 u/ml,链霉素100 μg/ml),在5%CO2、 37℃培养箱中培养,每2天更换一次培养基,传代培养至对数期用于后续实验。调整培养的5种细胞浓度至每升1×107个,于6孔板每孔接入1 ml上述浓度细胞,培养24 h。
1.3.2 RT-qPCR检测miR-524-5p及HEG1 mRNA表达 收集1.3.1中培养的细胞,加入TRIzol溶液提取总RNA,按照反转录试剂盒进行PCR扩增,引物由生工生物工程(上海)股份有限公司提供,扩增条件为:95℃ 60 s, 95℃ 10 s, 60 ℃ 30 s,共40个循环。miR-524-5p以U6为内参,HEG1以GAPDH为内参。引物设计见表1。
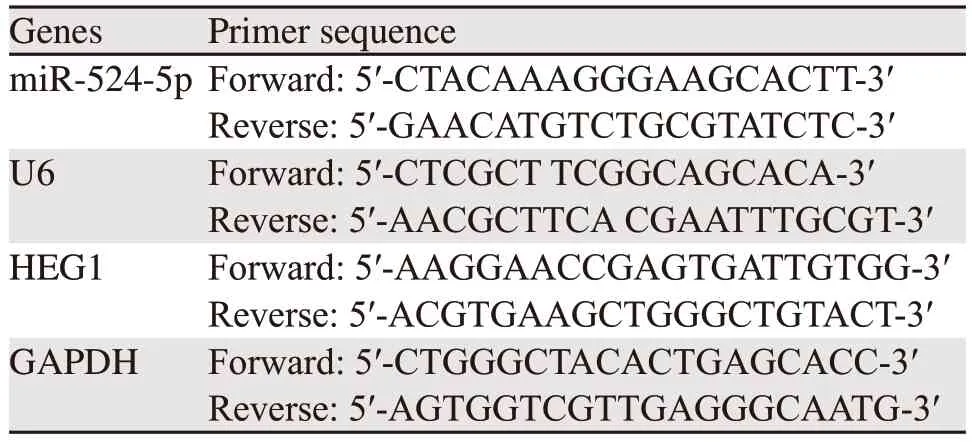
表1 PCR引物序列Table 1 PCR primer sequences
1.3.3 HEG1在食管癌肿瘤组织和正常食管组织中的表达 利用GEPIA数据库查询HEG1在食管癌肿瘤组织和正常食管组织中的表达水平。
1.3.4 细胞转染与分组 KYSE30细胞以2×105个/孔的密度接种6孔板中,37℃恒温CO2培养箱培养过夜后,采用LipofectamineTM2000试剂转染核酸序列,实验分为四组:转染miR-524-5p mimic(miR-524-5p mimic组)、miR-524-5p NC(miR-524-5p NC组)、共转染miR-524-5p NC和pcDNA3.1(miR-524-5p mimic+pcDNA3.1组)和共转染miR-524-5p NC和pcDNA3.1-HEG1(miR-524-5p mimic+pcDNA3.1-HEG1组),另设置未经转染的细胞为正常对照组(Control组)。转染后细胞培养6 h,弃掉培养基,更换为1.3.1中使用的培养基继续培养72 h,收集细胞用于后续实验。
1.3.5 细胞增殖能力检测 使用CCK-8试剂盒检测KYSE30细胞增殖能力,细胞按照1.3.4中的方法转染后,继续培养72 h,分别于24 、48和72 h三个时间段加入CCK-8溶液,培养2 h后,用酶标仪在450 nm下读取吸光度值。
1.3.6 KYSE30细胞克隆形成实验 按照1.3.4的方法转染细胞后,培养24 h后收集KYSE30细胞,重新在培养皿中按照1×103个/皿接种KYSE30细胞,继续培养2周后,弃培养液,PBS冲洗,加入固定液固定15 min,弃去固定液,结晶紫染色,显微镜观察并计数克隆细胞数目。
1.3.7 Western blot检测蛋白表达 将细胞按照1.3.4的方式培养24 h后,收集细胞,裂解后提取总蛋白,测定蛋白浓度。随后进行电泳、转膜及5%脱脂牛奶室温封闭等操作,封闭2 h后加入一抗MMP2、MMP9、E-cadherin、Vimentin、N-cadherin、Snail、HEG1(1:1 000)培养过夜,PBS清洗后加入二抗(1:2 000)培养2 h,GAPDH(1:1 000)为内参,加入ECL显影,Image J软件分析条带灰度值,计算蛋白表达量。
1.3.8 KYSE30细胞迁移能力检测 细胞划痕实验:将细胞按照1.3.4的方法培养至对数期后,用无菌10 μl移液枪枪头尖在6孔板底部垂直划线,PBS冲洗后加入无血清的RPMI1640培养基,培养24 h,分别在培养的0和24 h时用显微镜观察并拍照,计算划痕愈合率。
1.3.9 KYSE30细胞侵袭能力检测 Transwell实验:将基质胶用不含血清的RPMI 1640培养基稀释8倍后,每个小室加入50 μl,置于CO2恒温培养箱(37℃)培养30 min,将按照1.3.4的方法转染细胞,消化重悬后,在小室的上室中接入200 μl浓度为1×105/ml的细胞悬液,下室为600 μl含血清的RPMI1640培养基,培养24 h后,加入固定液固定,结晶紫染色,擦去上室细胞,倒置显微镜拍照并计数。1.3.10 双荧光素酶报告基因检测 利用Starbase数据库(https://starbase.sysu.edu.cn/)预测miR-524-5p与HEG1的结合位点,构建野生型(WT)和突变型(MUT)HEG1质粒,利用LipofectamineTM2000试剂将miR-524-5p mimic或NC和HEG1野生或突变质粒共转染KYSE30细胞,并且转染海肾质粒为内参,转染48 h后用双荧光素酶报告基因试剂盒检测荧光素酶活性。
1.4 统计学方法
采用SPSS26.0和GraphPad Prism 9软件进行数据分析。所有数据均表示为平均值±标准差(±s),多组比较采用单因素方差分析,两两组间比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 miR-524-5p和HEG1在人食管癌细胞和正常食管上皮细胞中的表达
miR-524-5p在食管癌细胞TE-1、KYSE30、KYSE150、NEC中的表达均显著降低,HEG1 mRNA相对表达量在各细胞系中均显著上调(均P=0.000),见表2。说明在食管癌细胞中miR-524-5p为低表达,HEG1高表达。本实验选择miR-524-5p表达量最低的KYSE30细胞作为后续实验细胞。
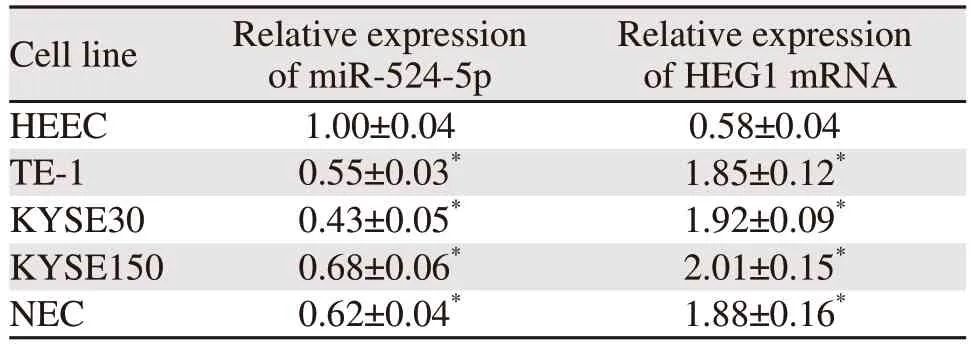
表2 miR-524-5p和HEG1在几种食管细胞系中的相对表达量Table 2 Relative expression of miR-524-5p and HEG1 in several esophageal cell lines
2.2 HEG1在食管癌组织和正常食管组织中的表达
在GEPIA数据库中,HEG1在食管癌组织中表达显著高于正常食管组织(P<0.05),见图1。
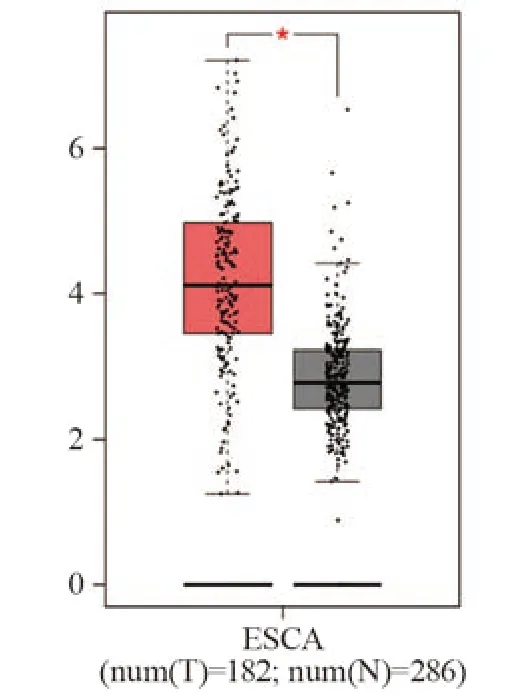
图1 HEG1在食管癌组织和正常食管组织中的表达Figure 1 Expression of HEG1 in esophageal cancer tissues and normal esophageal tissues
2.3 KYSE30细胞增殖能力
在24、48、72h时,miR-524-5p NC组和Control组的KYSE30细胞增殖能力比较,差异均无统计学意义(均P>0.05),在24 h时,与miR-524-5p NC组比较,miR-524-5p mimic组KYSE30细胞增殖能力差异无统计学意义(P>0.05),与m i m i c+p c D N A 3.1 组比较,m i R-5 2 4-5 p mimic+pcDNA3.1-HEG1组KYSE30细胞增殖能力明显增强(P=0.000);在48 h和72 h时,与miR-524-5p NC组比较,miR-524-5p mimic组KYSE30细胞增殖能力明显降低(均P=0.000),与miR-524-5p mimic+pcDNA3.1组比较,miR-524-5p mimic+pcDNA3.1-HEG1组KYSE30细胞增殖能力明显增强(均P=0.000),见表3。
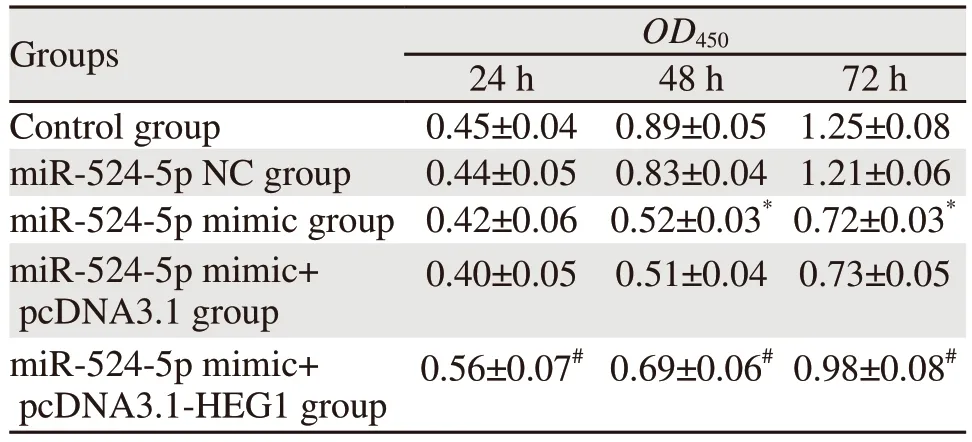
表3 miR-524-5p对KYSE30细胞增殖能力的影响Table 3 Effect of miR-524-5p on the proliferative capacity of KYSE30 cells
2.4 KYSE30细胞克隆形成率
miR-524-5p NC组(385.13±17.12)和Control组细胞克隆形成数(387.88±16.04)比较,差异无统计学意义(P>0.05);与miR-524-5p NC组比较,miR-524-5p mimic组的KYSE30细胞克隆形成数(143.22±10.85)明显降低(P=0.000),与miR-524-5p mimic+pcDNA3.1组(152.25±11.34)比较,miR-524-5p mimic+pcDNA3.1-HEG1组KYSE30细胞克隆形成数(293.10±13.74)明显上升(P=0.000),见图2。
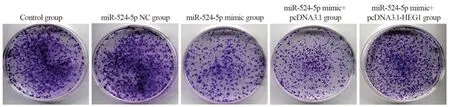
图2 各转染组KYSE30细胞平板克隆形成情况Figure 2 Plate clone formation of KYSE30 cells in each transfection group
2.5 KYSE30细胞中EMT、HEG1和miR-524-5p的表达
miR-524-5p NC组和Control组上皮标志蛋白E-cadherin、间质标志蛋白Vimentin、N-cadherin、Snail以及HEG1蛋白、miR-524-5p表达量比较,差异无统计学意义(P>0.05);与miR-524-5p NC组比较,miR-524-5p mimic组上皮标志蛋白E-cadherin、miR-524-5p表达明显上调,间质标志蛋白Vimentin、N-cadherin、Snail及HEG1蛋白表达明显下调(均P=0.000),与miR-524-5p mimic+pcDNA3.1组比较,miR-524-5p mimic+pcDNA3.1-HEG1组上皮标志蛋白E-cadherin、miR-524-5p表达明显下调,间质标志蛋白Vimentin、N-cadherin、Snail及HEG1蛋白表达明显上调(均P=0.000),见图3、表4。
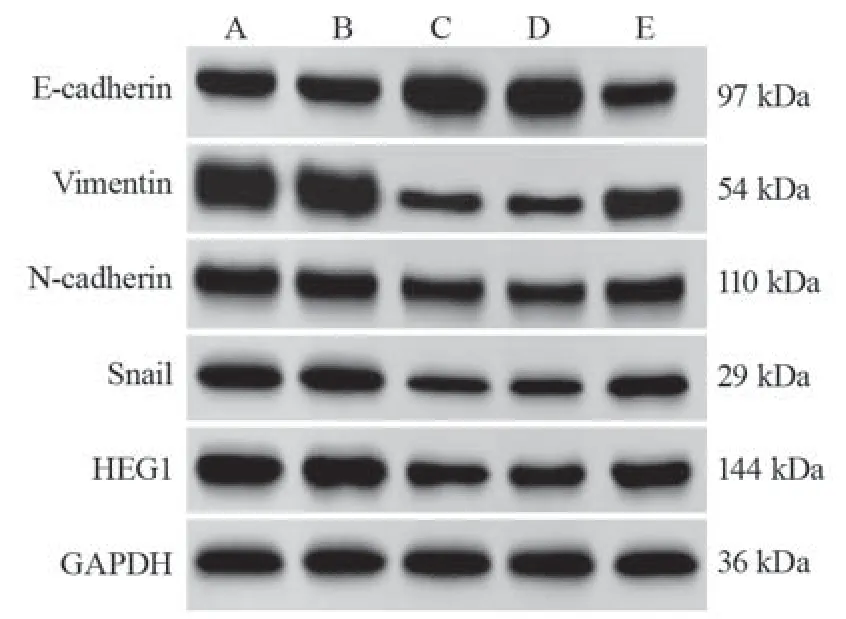
图3 不同转染组中EMT相关蛋白和HEG1蛋白表达量Figure 3 EMT-related protein and HEG1 protein expression in different transfection groups
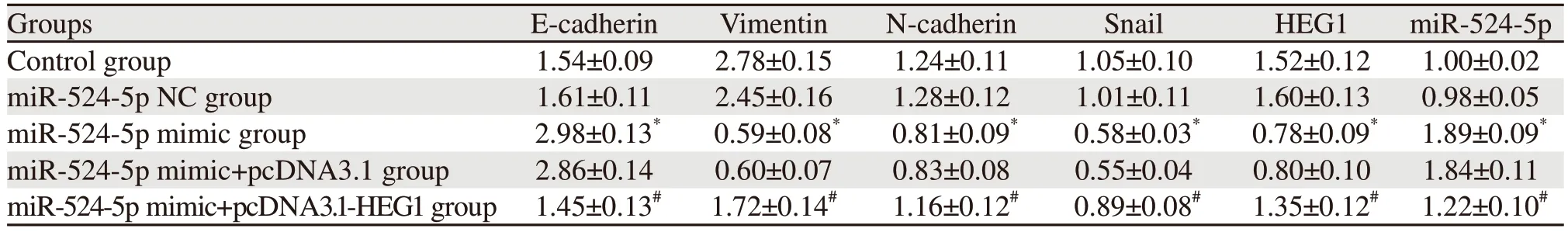
表4 不同转染组中EMT相关蛋白和HEG1蛋白表达量Table 4 EMT-related protein and HEG1 protein expression in different transfection groups
2.6 KYSE30细胞迁移能力
miR-524-5p NC组细胞划痕愈合率((42.59±2.33)%)和Control组((43.28±3.51)%)比较,差异无统计学意义(P>0.05);与miR-524-5p NC组比较,miR-524-5p mimic组KYSE30细胞划痕愈合率((21.68±1.65)%)明显降低(P=0.000);与miR-524-5p mimic+pcDNA3.1组((22.15±1.44)%)比较,miR-524-5p mimic+pcDNA3.1-HEG1组KYSE30细胞划痕愈合率((34.25±1.65)%)明显升高(P=0.000),见图4。

图4 划痕实验检测各组KYSE30细胞迁移能力Figure 4 Scratch assay of the migration ability of KYSE30 cells in each group
2.7 KYSE30细胞侵袭能力
miR-524-5p NC组(212.48±9.12)和Control组细胞侵袭数目(208.26±7.48)比较,差异无统计学意义(P>0.05);与miR-524-5p NC组比较,miR-524-5p mimic组KYSE30细胞侵袭数目(89.35±6.95)明显降低(P=0.000),与miR-524-5p mimic+pcDNA3.1组(91.02±7.05)比较,miR-524-5p mimic+pcDNA3.1-HEG1组KYSE30细胞侵袭数目(149.75±8.47)明显升高(P=0.000),见图5。
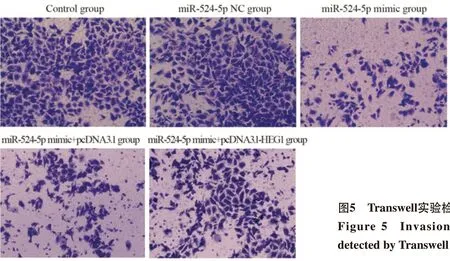
图5 Transwell实验检测KYSE30细胞侵袭能力Figure 5 Invasion ability of KYSE30 cells detected by Transwell assay
2.8 侵袭迁移相关蛋白MMP2、MMP9表达
miR-524-5p NC组和Control组细胞MMP2、M M P 9 蛋白表达比较,差异无统计学意义(P>0.05);与miR-524-5p NC组比较,miR-524-5p mimic组KYSE30细胞侵袭迁移相关蛋白MMP2、MMP9表达明显降低(均P=0.000),与miR-524-5p mimic+pcDNA3.1组比较,miR-524-5p mimic+pcDNA3.1-HEG1组KYSE30细胞侵袭迁移相关蛋白MMP2、MMP9表达明显升高(均P=0.000),见图6、表5。
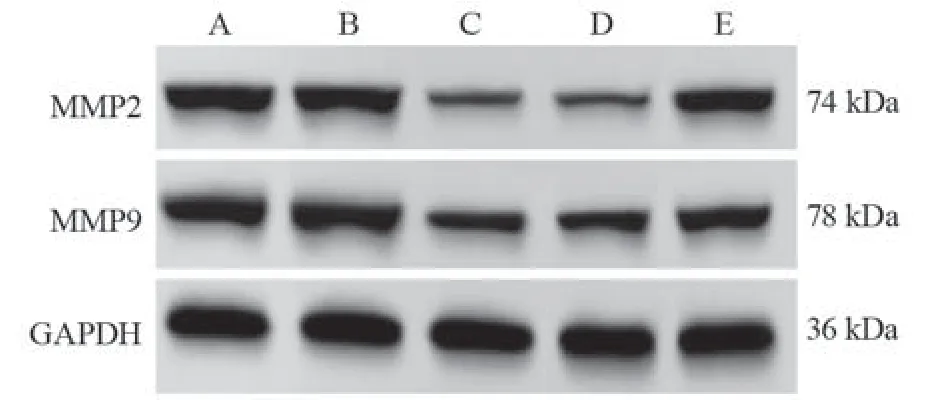
图6 侵袭迁移相关蛋白表达量Figure 6 Expression of invasive- and migration-related proteins
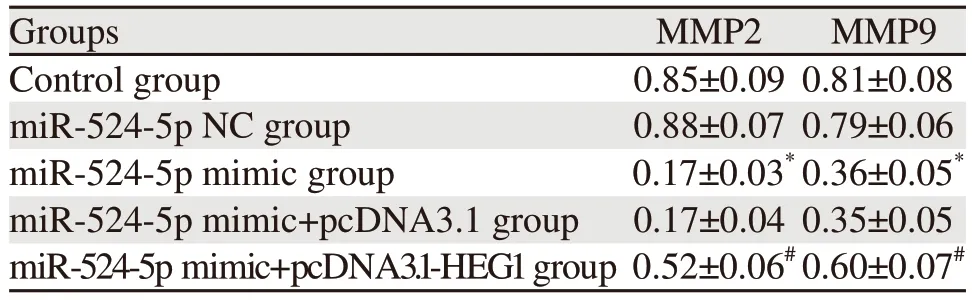
表5 各组KYSE30细胞中侵袭迁移相关蛋白表达量比较Table 5 Comparison of expression levels of invasionand migration-related proteins in KYSE30 cells among all groups
2.9 双荧光素酶报告基因检测结果
miR-524-5p可以靶向结合HEG1的3'UTR区域,见图7。双荧光素酶报告基因实验结果,miR-524-5p mimic组与WT-HEG1共转染组细胞荧光素酶活性显著低于miR-524-5p NC组与WT-HEG1共转染组(P=0.000),miR-524-5p mimic组与MUTHEG1共转染组的细胞荧光素酶活性与miR-524-5p NC组与MUT-HEG1共转染组差异无统计学意义(P>0.05),Control组、miR-524-5p NC组之间与WT-HEG1共转染和与MUT-HEG1共转染差异均无统计学意义(P>0.05),见表6。说明miR-524-5p可与HEG1的3'UTR区结合。

图7 miR-524-5p与HEG1 3'UTR结合位点Figure 7 Binding site of miR-524-5p to HEG1 3 UTR
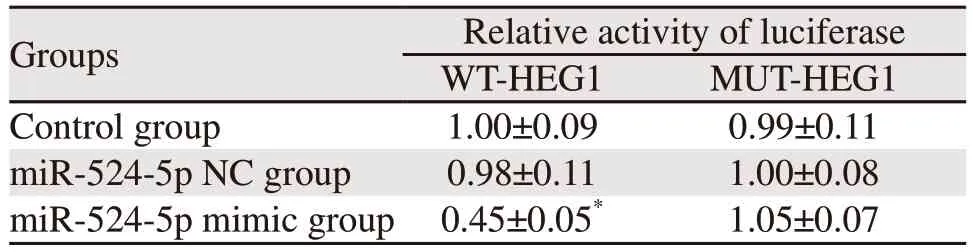
表6 miR-524-5p靶基因验证Table 6 Validation of miR-524-5p target gene
3 讨论
食管癌是致命性的恶性肿瘤之一,已发现多种miRNA可以通过靶向不同靶标来调节食管癌进展,如miR-33a-5p靶向DKK1抑制食管癌进展[9];miR-375通过阻断ERBB2/VEGFA通路抑制食管癌发展[10]等。miR-524-5p已被发现对多种肿瘤细胞的耐药性、迁移侵袭、EMT进展有抑制作用[11-13]。但尚未见miR-524-5p对食管癌细胞调节作用的相关性研究报道。本研究中首先通过miR-524-5p在食管癌四种不同细胞系和正常食管上皮细胞中的表达,确定了其在食管癌细胞中呈低表达。随后设置miR-524-5p过表达组探讨miR-524-5p对食管癌细胞增殖、迁移侵袭和EMT进程的影响。结果显示通过过表达miR-524-5p可以显著降低食管癌细胞的增殖能力和克隆形成,与以往研究的上调miR-524-5p可抑制胃癌细胞增殖具有一致性[14],证明了过表达miR-524-5p可抑制食管癌细胞的增殖。
完整的EMT癌细胞状态主要集中在复发癌组织中[15]。EMT是癌细胞侵袭和转移的根源,其发生过程主要表现为上皮标志蛋白E-cadherin下调,间质标志蛋白N-cadherin、Vimentin、Snail等上调[16-17]。EMT与恶性肿瘤的迁移、侵袭、化学耐药性相关[18]。因此,抑制癌细胞的EMT进程对于预防恶性肿瘤复发具有重大意义。miRNA可抑制恶性肿瘤的EMT进程,如miR-451抑制胶质瘤细胞的EMT和转移[19];miRNA-10a-5p抑制肝癌细胞的转移[20]。本研究结果显示,过表达miR-524-5p明显提升了KYSE30细胞的上皮标志蛋白E-cadherin表达水平,下调了间质标志蛋白N-cadherin、Vimentin、Snail的表达水平,表明过表达miR-524-5p抑制了KYSE30细胞EMT进程。癌细胞转移扩散是癌症患者死亡的主要原因,miR-524-5p过表达已被证明可以抑制乳腺癌细胞的侵袭和迁移[13]。MMP2、MMP9是与癌细胞侵袭和迁移密切相关的蛋白,抑制其表达可有效抑制癌细胞的转移扩散进程[21]。本研究划痕实验和Transwell实验结果均显示过表达miR-524-5p后,KYSE30细胞侵袭迁移能力减弱,且MMP2、MMP9蛋白表达下调,说明miR-524-5p过表达可抑制KYSE30细胞的侵袭迁移。
HEG1是一种新型黏蛋白样膜蛋白,与血管生成、胚胎发育及细胞-细胞连接密切相关,在促进肿瘤进展中发挥着重要作用。已有报道显示,HEG1在恶性间皮瘤[22]、肝细胞癌[7]、肺腺癌[23]中高表达,可作为肿瘤的诊断和治疗靶点。本研究通过GEPIA数据库对HEG1在EC中的表达进行分析发现HEG1在食管癌肿瘤组织中表达水平显著高于正常组织;进一步分析显示,HEG1在四种不同食管癌细胞系中的表达均高于正常食管上皮细胞,提示HEG1可能在食管癌中充当促癌基因。使用Stabase数据库对miR-524-5p的潜在靶基因进行预测,发现HEG1与miR-524-5p存在互补的结合位点,可能为miR-524-5p的下游靶基因。双荧光素酶报告基因检测证实,miR-524-5p可与HEG1的3'UTR区结合;qRT-PCR和Western blot结果显示,过表达miR-524-5p可下调HEG1表达,表明miR-524-5p可负向调控HEG1表达。因此本研究推测,HEG1可能为miR-524-5p调节KYSE30细胞恶性生物学行为的重要靶蛋白。为了验证此推测,本研究在过表达miR-524-5p的基础上采用质粒转染上调HEG1表达,结果显示上调HEG1表达可明显减弱过表达miR-524-5p对KYSE30细胞恶性生物学行为的抑制作用,提示过表达miR-524-5p可能通过下调HEG1抑制KYSE30细胞的增殖、EMT进程和侵袭迁移。
综上所述,miR-524-5p在食管癌细胞和组织中低表达,过表达miR-524-5p可以负向调节HEG1在食管癌细胞系KYSE30细胞中的表达,减轻KYSE30细胞的增殖、EMT进程和侵袭迁移能力。然而本研究仅开展了细胞实验,随后将在动物实验中进行验证,以期明确miR-524-5p在食管癌进展中的作用。
利益冲突声明:
所有作者均声明不存在利益冲突。

