ITPKB突变变异等位基因频率对弥漫性大B细胞淋巴瘤的预后预测价值
张玲珑,漆小龙,寇珍,热那古力·阿不来提,聂玉玲,木合拜尔·阿布都尔,翟顺生,安利,毛敏,李燕
0 引言
弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)是最常见非霍奇金淋巴瘤(non-Hodgkin's lymphoma, NHL),占所有NHL病例数的40%左右[1]。DLBCL是一种异质性疾病,二代测序(next-generation sequencing, NGS)技术从突变的角度揭示了DLBCL的这种异质性[2]。作为一种高度异质性的淋巴系统恶性肿瘤,DLBCL具有基因表达谱和基因改变的差异,导致临床病程和治疗反应的显著差异[3]。当前许多研究应用高通量测序(NGS)检测DLBCL的分子基因水平的异常,对DLBCL进行精确诊断、分类及预后判断以及指导精准治疗[4]。随着全基因组测序技术的日臻成熟以及成本的不断降低,对较多数量基因座位和较多数目品种等位基因序列变异同时检测成为可能[5]。越来越多的研究证实遗传因素在DLBCL预后中起重要作用,但大多数突变基因的变异等位基因频率(variant allele frequency, VAF)与临床相关性尚不清楚[6]。本研究旨在应用二代测序技术检测DLBCL患者ITPKB突变的VAF值,分析其与临床特征和预后的关系。
1 资料与方法
1.1 研究对象资料收集
本研究纳入了2014年6月—2020年12月新疆维吾尔自治区人民医院根据《中国弥漫性大B细胞淋巴瘤诊断与治疗指南(2013年版)》[7]初次诊断的155例弥漫性大B细胞淋巴瘤患者,获取患者完整的临床资料及石蜡包埋的肿瘤组织标本。患者临床特征资料主要包括年龄、性别、民族、LDH、COO分型、Ann Arbor临床分期、IPI预后评分、ECOG体能状态评分、大包块、结外受累的数量、疾病进展和生存等。数据分析中排除了入组前接受放、化疗,合并有其他血液系统肿瘤及恶性消耗性疾病患者。本研究经过新疆维吾尔自治区人民医院伦理委员会批准同意后开展,鉴于研究性质属于回顾性研究,故患者无需签署知情同意书。
1.2 NGS检测
全部患者的石蜡包埋肿瘤组织标本中提取基因组DNA,由南京世和基因生物技术股份有限公司采用安捷伦SureSelect Human All Exon Kit(美国Santa Clara公司产品)的靶向捕获方法进行测序,基因PANEL包括ITPKB在内的热点基因。在Illumina HiSeq平台对富集片段进行大规模并行测序,20×靶区覆盖率>90%,使用SNV/small indel完成检测、注释及统计,突变型VAF定义为变异读数除以总读数,以百分比形式报告。已知的单核苷酸多态性(SNPs)、拷贝数变异(CNV)突变均被排除在外。
1.3 VAF截断值
VAF是在基因位点突变的等位基因对应的读数的覆盖深度占这个位点总读数覆盖深度的比例。通过使用基于R语言的在线网页工具Cut off Finder(http://molpath.charite.de/cutoff/)来确定每个基于OS和PFS分层的个体基因的VAF最优突变截断点:通过Log rank检验比较每个截断点(高VAFvs.低VAF+野生型)分离的两组OS和PFS,并根据最低P值[8]选择最优VAF截断点。
1.4 随访
通过查阅电子病历资料及电话随访获取患者病情进展。随访截止日期为2023年12月31日。至截止日已死亡患者可视为完整数据。总生存期(OS)定义为从入组开始至因为任何原因引起的死亡时间或随访截止时间;无进展生存期(PFS)定义为从入组开始至疾病进展、复发、死亡或末次随访时间。生存期以月为单位。
1.5 统计学方法
计量资料用均数±标准差(±s)表示,计数资料用百分率(%)表示,正态分布使用t检验。通过基于R语言的网页工具Cut-off Finder(http://molpath.charite.de/cut-off/)探寻可以区分患者预后的最佳VAF截断值,队列的患者依据不同的VAF值分成对应的两组(高VAF组/低VAF+野生型组),R包生存期的函数survfit对依据不同VAF值分成的两组患者采用Log rank检验进行生存比较,Log rank检验P值最低时所对应的VAF值则为该基因的最佳VAF截断值[8]。Kaplan-Meier法绘制患者生存曲线,两组间生存差异显著性检验使用Log rank法比较。单因素和多因素Cox回归分析法分析ITPKB突变状态和突变VAF与PFS之间的关系。所有分析均使用SPSS 23.0统计学软件进行,双侧P<0.05为差异有统计学意义。
2 结果
2.1 155例DLBCL患者ITPKB突变VAF与临床特征的关系
155例患者共检测到475种基因突变,其中ITPKB突变的患者有29例(29/155, 18.71%)。通过对本研究入组的155例初诊DLBCL患者中ITPKB突变患者的VAF值分析发现,ITPKB突变患者VAF值为10.65%~55.81%,VAF值分布为正态分布(P=0.067),平均数为26.00%。t检验分析不同分组情况下VAF分布情况,结果显示ITPKB突变患者VAF值在大包块及结外受累数目的分组中差异有统计学意义(P=0.049,P=0.005),见表1。
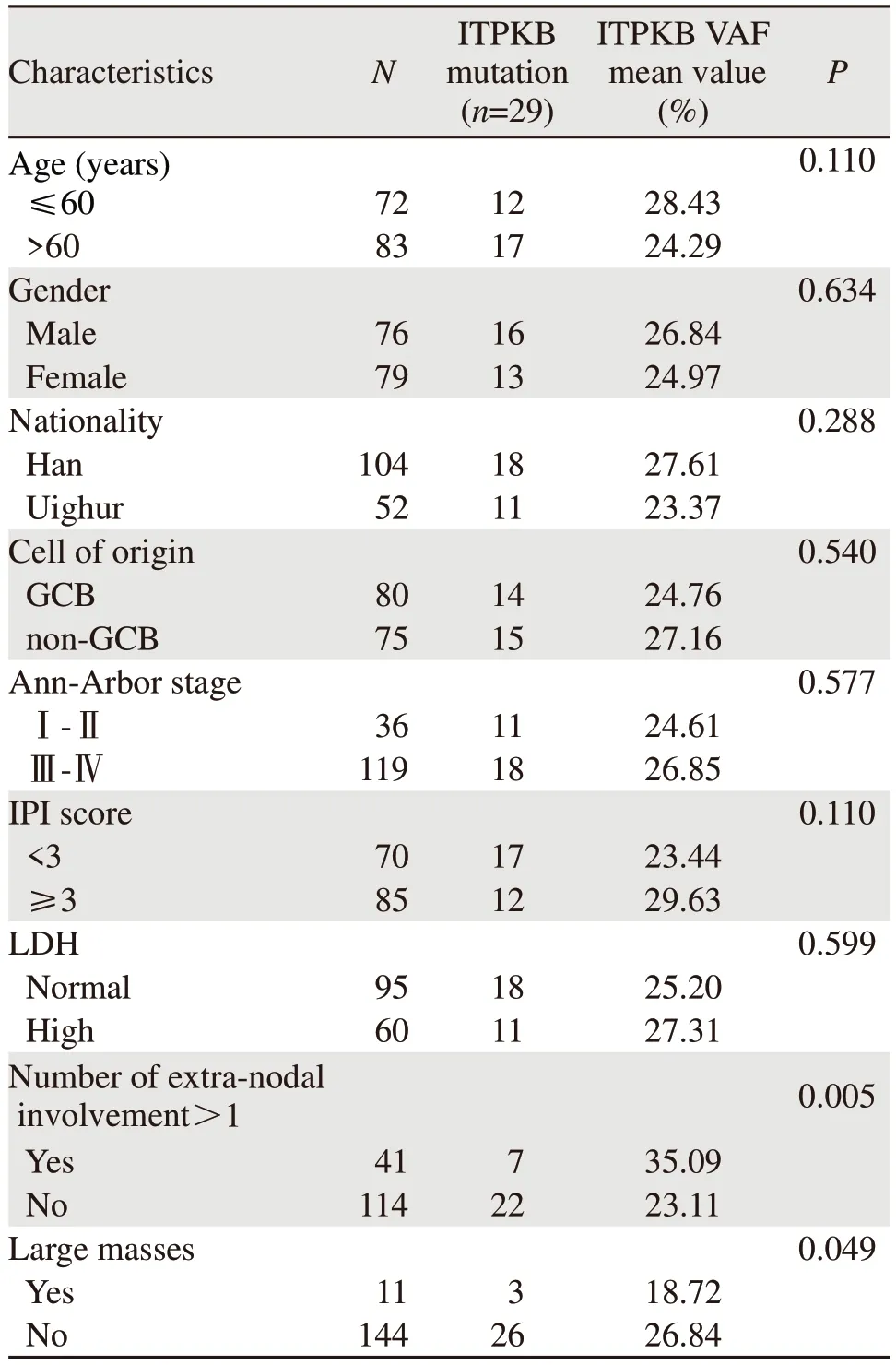
表1 155例DLBCL患者的ITPKB突变VAF与临床特征的关系 (n=155)Table 1 Relationship between ITPKB mutation VAF and clinical characteristics of 155 DLBCL patients (n=155)
2.2 DLBCL患者ITPKB突变VAF值与预后的关系
2.2.1 基于PFS和OS分层的ITPKB VAF临界值对预后的影响 通过基于R语言的网页工具探寻可以区分患者预后的最佳VAF截断值,队列的患者依据不同的VAF值分成对应的两组(高VAF组vs.低VAF+野生型组),研究结果显示,ITPKB为27.48%(HR=3.48, 95%CI: 1.70~7.13,P<0.001)。见图1A。借助基于R语言的网页工具Cut off Finder[8](http://molpath.charite.de/cutoff/),ITPKB突变没有可用的最佳VAF临界值(HR=2.06, 95%CI:0.88~4.85,P=0.09),见图1B。

图1 通过基于R语言的网络应用Cut-off Finder确定ITPKB突变的最佳VAF临界值对PFS(A)和OS(B)进行分层Figure 1 Determination of the optimal VAF threshold for ITPKB mutations by the R-language based web application Cut-off Finder, by which the optimal threshold is clearly stratified for PFS(A) and OS(B)
2.2.2 ITPKB与PFS之间的关系 ITPKB突变患者的PFS与未突变患者的PFS相比明显缩短(37.00个月vs.108.00个月;HR=1.643, 95%CI: 0.920~2.934,P=0.090),见图2A,但差异无统计学意义。进一步将ITPKB基因状态分为VAF≥28%、VAF<28%和野生型进行分析发现,ITPKB VAF<28%患者中位PFS与ITPKB野生型患者相比有延长趋势(未达到vs.108.00个月;HR=0.919, 95%CI: 0.393~2.147,P=0.850),见图2B。ITPKB VAF≥28%患者PFS比ITPKB野生型患者明显缩短(13.00月vs.108.00月;HR=3.551, 95%CI: 1.724~7.314,P<0.001),见图2C。ITPKB VAF≥28%患者PFS比ITPKB VAF<28%缩短(13.00个月vs.未达到;HR=2.997,95%CI: 1.041~8.624,P=0.036),见图2D。基于上述分组,进一步结合年龄、性别、COO分型、IPI、LDH等临床指标分别进行单因素、多因素Cox分析发现,在ITPKB突变与未突变组,ITPKB突变状态本身与PFS无关,non-GCB亚型是PFS的独立危险因素(HR=1.716, 95%CI: 1.042~2.826,P=0.034),见图3;当ITPKB基因状态在28%VAF临界值对PFS分层时,高ITPKB VAF(≥28%),是预后不良的独立预测因素。
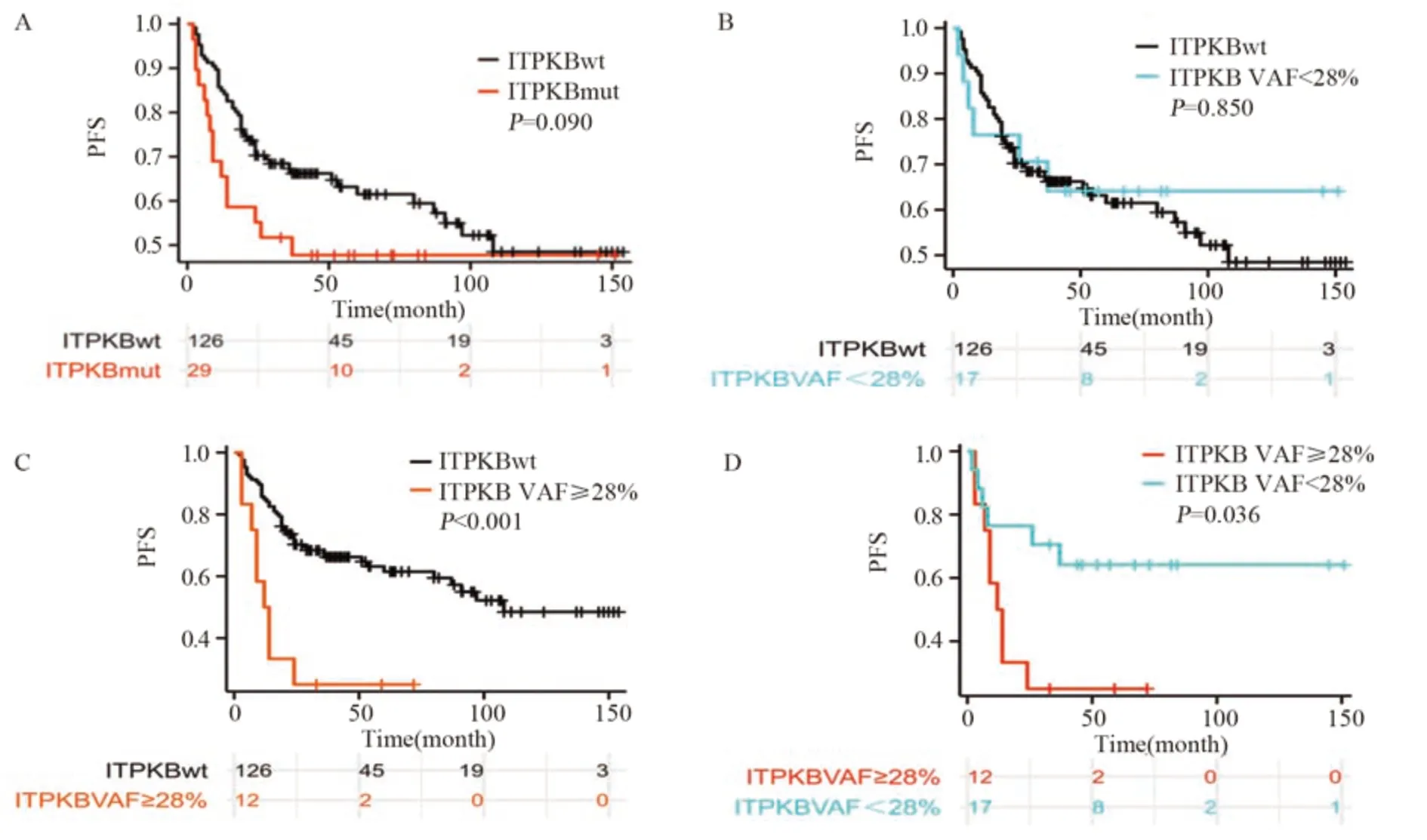
图2 无进展生存期(PFS)与ITPKB突变状态或变异等位基因频率(VAF)的关系Figure 2 Relationship between progression-free survival (PFS) and ITPKB mutation status or variant allele frequency (VAF)
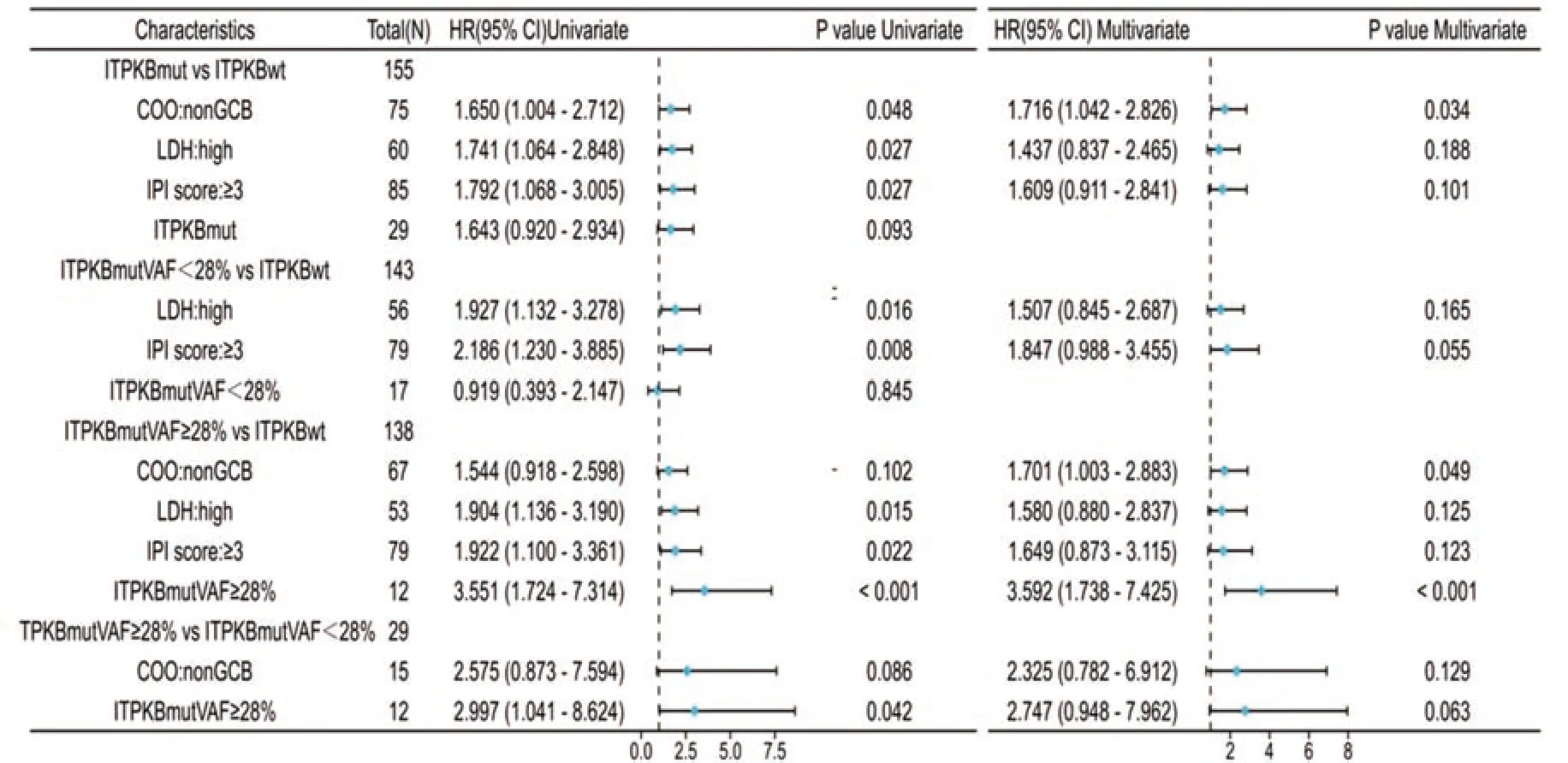
图3 ITPKB突变状态和突变VAF与PFS之间单因素和多因素Cox回归分析Figure 3 Univariate and multivariate Cox hazards analyses for PFS and ITPKB mutation status or mutation VAF
3 讨论
DLBCL传统的最重要的预后指标是基于临床指标的IPI评分,然而在临床实践中发现,即使某些DLBCL患者的传统预后指标相同,但他们的预后仍然存在较大的差异,这些差异可归因于肿瘤的分子学异质性。以往的研究发现很多预后相关基因,每种基因之间的不同表达可能影响患者的临床特征[9]。已有很多研究探索了基因突变状态及突变类型与DLBCL预后的关系。此外,国内外对于VAF与血液系统恶性肿瘤预后相关的研究越来越多,但有关VAF在DLBCL中的预后价值相关研究鲜有报道,本研究对相关问题进行探索性研究发现,DLBCL患者中ITPKB基因突变的高VAF与患者较短的PFS之间存在独立的关联,提示ITPKB突变的高VAF是DLBCL患者的一个独立危险因素。
ITPKB作为体细胞突变靶向的新基因在原发纵隔B细胞淋巴瘤(PMBL)中首次被发现[10]。有研究报道ITPKB可以影响B细胞的存活和功能,ITPKB缺乏使B细胞存活存在缺陷,导致B细胞谱系的特异性和内在发育改变以及对体内抗原无反应,其可以通过Rasa3-Erk信号通路介导B细胞的存活,控制促凋亡基因Bim的表达[11]。有研究发现ITPKB是急性髓系白血病(AML)的预后因素,而且首次报告ITPKB突变是AML患者总生存和无病生存的独立因素[12]。在一项关于原发性乳腺淋巴瘤(PBL)的研究中发现ITPKB作为一种高突变基因,有缩短总生存期(OS)和无进展生存期(PFS)的趋势,可能与预后不良相关[13]。近年来越来越多的机制相关研究表明ITPKB值得在DLBCL中进一步研究,如有研究发现ITPKB是顺铂耐药性癌症治疗干预重要的靶标,它的产物肌醇1,3,4,5-四基磷酸酯(IP4)在顺铂暴露后的氧化还原稳态中起关键作用,通过抑制ROS产生的酶NADPH氧化酶4(NOX4)降低了顺铂诱导的ROS,可促进顺铂耐药性肿瘤的生长[14]。
我们在当前研究中发现VAF水平较高的ITPKB突变的患者PFS较野生型ITPKB患者短,而VAF水平较低的患者则没有表现出缩短的趋势,与之相反的是,VAF水平较低的ITPKB突变的患者较野生型ITPKB患者PFS有延长,但二者的差异无统计学意义。进一步比较VAF水平较高的ITPKB突变患者与VAF水平较低的ITPKB突变患者的PFS,发现前者的PFS明显缩短,多因素分析表明ITPKB高VAF是预后不良的独立预测因素。目前的我们的研究进一步证实了以往的研究,同时也突出了ITPKBVAF在DLBCL的预后价值。
本研究表明,ITPKB的突变与DLBCL的生存之间的关系可能受到突变VAF的影响。这些发现使我们认识到基因突变的VAF值在DLBCL预后预测中的潜在价值。然而某些基因的VAF高突变与疾病之间关系更详细的机制目前还尚不清楚。因为我们的研究样本量少、缺乏外部验证等,所以具有一定的局限性,除了突变状态和突变VAF以外,其他突变特征如突变位点、突变类型(单核苷酸多态性、拷贝数变异等)也可能是影响DLBCL临床和预后的重要因素,我们需要结合它们之间的潜在联系,在此基础上扩大样本量,通过进一步的研究证实我们当前的发现,并探索各种突变特征在DLBCL中的意义。
总之,本研究表明ITPKB突变对DLBCL患者PFS的影响高度依赖其突变VAF,ITPKB基因突变高VAF是DLBCL患者PFS的独立危险因素。ITPKB突变的VAF在DLBCL患者中具有预后预测价值。
利益冲突声明:
所有作者均声明不存在利益冲突。

