双膦酸盐类药物对区域骨代谢加速过程中巨噬细胞极化状态的影响
郭珍珍 程筠 黄文霞
双膦酸盐(bisphosphonates, Bps)类药物是一类化学合成药物, 主要作用于骨组织并影响骨代谢, 在临床中主要应用于抗代谢骨病, 如骨质疏松症、恶性肿瘤引发的高钙血症和骨痛症等[1,2]。近年来, 双膦酸盐类药物在癌症患者中预防癌症骨转移的应用逐渐增多, 与此同时, 与双膦酸盐类药物相关的区域骨代谢加速的报道也逐渐增多。由双膦酸盐引起的颌骨坏死(bisphosphonates-related osteonecrosis of jaw, BRONJ) 的机制尚不完全清楚, 对于双膦酸盐类药物相关性区域骨代谢加速的治疗以及预防都还需要进一步研究。
1 材料与方法
1.1 实验动物 选择40 只雌性SD 大鼠, 体重(200±20) g, 购自于斯贝(北京)生物技术有限公司, 获得实验动物许可证号。将大鼠随机分为空白对照组、ZA 组、IL-17 组、laq 组, 每组10 只。
1.2 方法
1.2.1 实验仪器及试剂 双膦酸盐类药物(唑来膦酸)、Micro CT、X 射线牙机片、3%过氧化氢溶液、4%多聚甲醛、PBS、3% BSA、兔抗大鼠CD68 抗体、兔抗大鼠INOS 抗体、兔抗大鼠CD206、山羊抗兔免疫球蛋白G(IgG)、大鼠抗鼠IL-17 单克隆抗体、拉喹莫德。
1.2.2 实验方法 ZA 组、IL-17 组、laq 组腹腔注射唑来膦酸建立动物模型, 空白对照组腹腔注射等量生理盐水。对四组大鼠行颌骨拔牙术, IL-17 组大鼠给予抗大鼠IL-17 中和抗体, laq 组大鼠给予拉喹莫德。拔牙术后第8 周处死大鼠, 取完整骨固定, 实施X 线检查与Micro-CT 扫描, 分析其骨代谢情况。
1.3 统计学方法 采用SPSS25.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 模型建立
2.1.1 拔牙创愈合情况 空白对照组大鼠拔牙创愈合情况良好, 无死骨形成, 骨代谢尚可。见图1A。ZA 组、IL-17 组、laq 组大鼠均发生了不同程度的黏膜愈合不良, 骨面暴露, 拔牙创延迟愈合, 拔牙窝空虚。见图1B。
2.1.2 骨代谢情况 空白对照组BRONJ 发病率为0(0/10), ZA 组为80%(8/10), IL-17 组为30%(3/10), laq组为60%(6/10), IL-17 组、laq 组较ZA 组的发病率呈现了下降的趋势。见图2A。ZA 组、IL-17 组和laq 组大鼠拔牙创部位的BV/TV 均明显低于空白对照组, 差异具有统计学意义(P<0.05)。说明ZA 组、IL-17 组和laq 组大鼠骨代谢较快。见图2B。

图2 四组大鼠骨代谢情况
2.2 骨密度情况 X 线片与Micro-CT 检查显示BRONJ 大鼠拔牙创出现明显骨密度降低, 拔牙窝空虚,拔牙创内成骨不良并伴有死骨形成;空白对照组中的大鼠颌骨黏膜愈合良好, 骨密度正常, 骨代谢稳定。见图3。
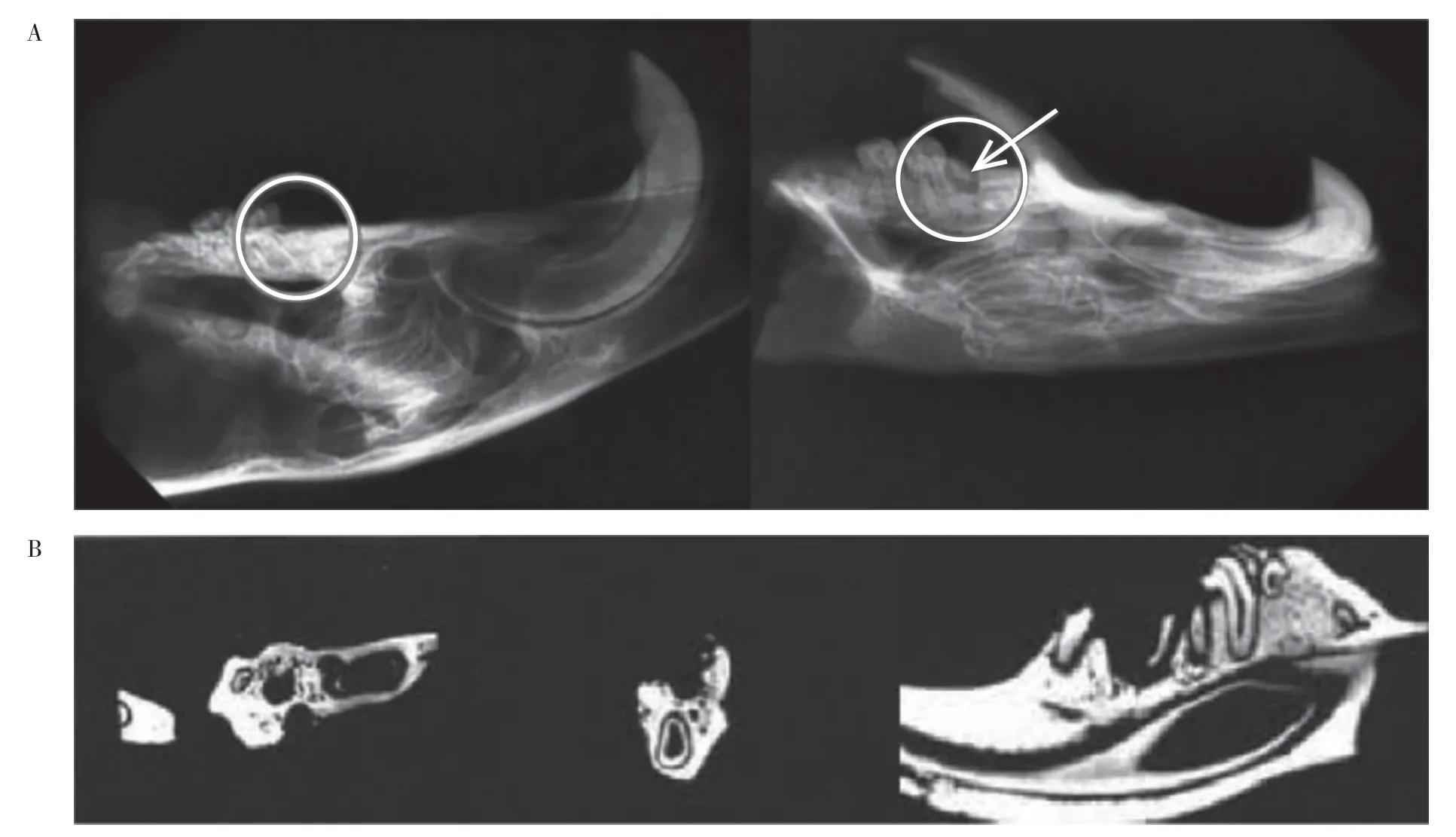
图3 大鼠颌骨影像学检查
2.3 唑来膦酸有助于巨噬细胞向M1 型极化, 阻断或抑制IL-17 活性可抑制巨噬细胞向M1 型细胞极化相比于空白对照组大鼠, BRONJ 大鼠中观察到大量CD68+巨噬细胞浸润, 同时, iNOS+巨噬细胞也大量出现, 而CD206+巨噬细胞却呈现了明显降低的趋势。ZA组、IL-17 组和laq 组中的CD68+巨噬细胞、iNOS+巨噬细胞、CD206+巨噬细胞的表达量均与空白对照组呈现出明显差异;ZA 组分别与IL-17 组和laq 组相比较,3 种细胞的数量也呈现差异, 说明唑来膦酸不仅引起大量巨噬细胞的浸润, 还可促进巨噬细胞向M1 型细胞极化;阻断或抑制IL-17 活性能够减少巨噬细胞浸润,并抑制巨噬细胞向M1 型细胞极化;相比较空白对照组大鼠, 在BRONJ 大鼠中iNOS 阳性巨噬细胞明显占优势, M1 型细胞与 M2 型细胞的比例更为凸显, 说明M1 型巨噬细胞在大鼠形成BRONJ 的过程中具有促进作用, 是大鼠发病的重要环节。
3 讨论
双膦酸盐类药物被认为是治疗骨科相关疾病的一线药物。双膦酸盐最早用于纺织业和石油工业, 在20 世纪60 年代, 国外学者发现了其药理活性。骨的主要矿物组分为羟基磷灰石[Ca10(PO4)6(OH)2, HA], 双膦酸盐能够通过与羟基磷灰石结合抑制其溶解来防止钙化, 因此认为该类药物能够对骨骼疾病发挥潜力作用[3-5]。同时, 在医疗技术的不断深入研究下, 相关治疗药物得到研发与应用, 且亲和力高, 毒副作用小, 能够针对Paget 病、骨质疏松症、恶性肿瘤骨转移相关的高钙血症进行有效治疗, 取得了不错效果, 其中一类患者则为骨质疏松症妇女。
与常规治疗比较, 双膦酸盐治疗可更大程度降低骨特异性碱性磷酸酶(BALP)、Ⅰ型胶原C端肽(CTX-Ⅰ)水平, 有利于骨代谢功能改善。唑来膦酸是一种双膦酸盐, 具有非常高的药理活性。对于破骨细胞而言, 能够选择性地对唑来膦酸加以吸收, 并且能够抑制其的活性, 这使得细胞凋亡作用变得更明显, 而破骨细胞也会变的更少, 抑制骨吸收。除此以外, 唑来膦酸也能够与羟基磷灰石结晶相融合, 影响骨骼表明吸附能力, 生物活性降低, 骨吸收量减少。
唑来膦酸和其他双膦酸盐能够通过抑制破骨细胞活性来抑制骨质流失。一些证据描述了辅助性T 细胞17(Th17)与M1 巨噬细胞之间的紧密相互作用, 但是这些相互作用是否参与唑来膦酸盐介导的IL-17 增加尚不清楚。最近的研究表明, 细胞因子信号传导抑制因子3(SOCS3)可以抑制促炎性M1 巨噬细胞表型, 而SOCS3 缺乏则通过增加促炎性细胞因子白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、白细胞介素-12(IL-12)、白细胞介素-23(IL-23), 从而为Th1 和Th17 细胞的分化提供了微环境[6,7]。有趣的是, 唑来膦酸已被证明可以诱导M2 型肿瘤相关巨噬细胞(TAM)趋向M1 型, 并通过抑制巨噬细胞中SOCS3 的表达来增强促炎性细胞因子的产生。这些发现可以解释唑来膦酸至少部分通过促进M1 巨噬细胞极化和激活来驱动Th17 分化的机制。然而, 值得注意的是, 微生物菌群及其生物膜是颌骨坏死(ONJ)的共同特征, 也可能影响巨噬细胞和Th17 细胞的分化和功能。需要通过进一步的研究来描述唑来膦酸和口腔微生物菌群如何能够共同或独立地调节ONJ 中Th17、M1/M2 巨噬细胞和其他类型免疫细胞之间的复杂网络。
除唑来膦酸外, 最近的临床试验还报道了用地诺单抗治疗的患者, 该药物是针对骨质疏松症和某些癌症患者普遍指定用作抗吸收药的抗核因子κB(NF-κB)配体的人类受体激活剂的单克隆抗体(RANKL)。越来越多的证据表明, 在肿瘤微环境中激活M1 巨噬细胞可以促进炎症反应, 将其作为癌细胞免疫监视的机制[8-10]。具有M2 巨噬细胞特征的肿瘤相关巨噬细胞(TAM)可以抑制免疫反应并促进肿瘤细胞的血管生成和转移, 从而促进癌症进展或减轻炎症, 并促进伤口愈合。最近, 体外和体内研究均表明, TAM 可能是双膦酸盐类药物的潜在靶标, 可能是通过操纵肿瘤微环境中的巨噬细胞表型来实现的, 并且通过类似机制, 炎症持续时间延长, 导致炎症加剧。对于接受大剂量静脉内双膦酸盐预防和治疗骨骼相关并发症的癌症患者,使用其他抗肿瘤药物[包括糖皮质激素(地塞米松)]、化疗药和(或)抗血管生成药会带来额外的风险。因此,应进一步探讨双膦酸盐和这些抗肿瘤药是否对免疫系统有任何协同作用, 特别是对Th17 细胞和M1/M2 巨噬细胞之间的相互作用有影响, 因为这些免疫细胞可能起“双刃”剑的作用, 会在肿瘤微环境中增强抗肿瘤免疫力和炎症反应。这种机制无意中导致了炎症的延长, 从而延迟了愈合或表现为BRONJ 的骨坏死。
综上所述, 双膦酸盐类药物会对区域骨代谢加速过程中巨噬细胞极化状态造成影响, 临床应用时需要加以重视。

