心外膜脂肪组织在心力衰竭中的研究进展
张瑶 王鑫 王鹏 李瑾
(1.山西医科大学第二临床医学院,山西 太原 030000; 2.山西医科大学第二医院,山西 太原 030000)
尽管现代医疗水平不断提升,但心血管疾病(cardiovascular disease,CVD)仍是全球人口死亡的主要原因。心力衰竭(heart failure,HF)是各种CVD的终末阶段,随着中国人口老龄化加剧,HF的患病率不断升高。心外膜脂肪组织(epicardial adipose tissue,EAT)是与心肌和冠状动脉直接接触的内脏脂肪库,具有高度可塑性,其分泌的脂肪因子和促炎因子对心脏和冠状动脉的代谢有直接影响。通过最近新的非侵入性成像方式测量,其厚度和体积已被证实与CVD的发病和进展相关。有研究表明,在发生HF时,EAT可通过促炎、促纤维化等多种机制影响心脏功能。
1 EAT的解剖和生理
在人类的心脏周围存在两种脂肪组织,为EAT和心包脂肪组织(pericardial adipose tissue,PAT)。EAT主要位于房室间沟和室间沟,是介于心肌和心包之间的脂肪库,与心肌之间无筋膜相隔并由冠状动脉的分支直接供血。而PAT由内脏层和壁层心包之间的脂肪组织组成。这些解剖上不同的脂肪组织覆盖了约80%的心脏表面。在生理条件下,EAT约占心脏质量的20%[1]。EAT由多种细胞组成,包括脂肪细胞、神经细胞、炎症细胞、基质细胞、血管细胞和免疫细胞,由于组成复杂,EAT可发挥多种生理作用。
EAT所特有的解剖结构可保护冠状动脉,避免冠状动脉受到动脉脉搏波和心脏收缩引起的扭转[1]。其次,它所释放的因子对心肌具有血管自分泌和旁分泌作用,并且在冠状动脉疾病的病理机制中具有潜在作用[2]。生理条件下,心肌能量代谢来自冠状动脉血液的游离脂肪酸,心肌细胞总能量的60%~70%来自脂肪酸氧化[3]。而EAT可为邻近的心肌细胞提供游离脂肪酸,根据心脏的需求起到缓冲的作用,保护心脏避免其受到高水平脂肪酸或能量底物缺乏的损害[4]。与其他脂肪库相比,EAT具有更高的脂肪生成率和分解率[5],EAT吸收游离脂肪酸的能力较高,而葡萄糖利用率较低,这表明EAT的代谢活动具有高度可塑性。EAT不仅代谢活跃,也是脂肪因子的主要来源,脂肪因子的分布取决于组织的抗炎或促炎状态,可调节心脏功能和形态[5]。在低氧化应激条件下,正常心外膜脂肪细胞主要分泌脂联素,这是一种抗炎性脂肪因子,可增加脂肪组织中的游离脂肪酸氧化,提高胰岛素敏感性,与动脉粥样硬化斑块易损性和冠状动脉疾病相关[6]。这种细胞因子对肝脏和心脏等不同器官也有抗脂肪变性和抗纤维化作用,可保护心肌细胞,最大限度地减少冠状动脉和心肌的炎症和纤维化,降低不良临床事件的概率[7]。Iacobellis等[8]首次表明人类EAT表达脂联素,并且在冠心病患者EAT中的表达显著降低,证实了EAT的代谢活性调节作用。EAT区别于其他内脏脂肪组织的特点之一是它可表达棕色脂肪组织相关的关键蛋白,可能保护心脏免受低温的损害[9]。EAT与心肌之间的相互作用是单向或双向的,还是这些组织之间根本没有相互作用仍具有争议,需更进一步的研究。
2 EAT的测量
EAT的厚度可通过超声心动图测量,它对于提供最大厚度非常有用,并且具有无创、廉价、易得、准确、可重复的优点。但也具有一定的局限性,它只能测量EAT的厚度,无法反映出EAT的绝对量,并且由于EAT分布不均匀和声学窗口较差,结果不太准确[10];超声操作者的技术也会对结果产生影响。严重肥胖的患者会使超声结果准确性降低,而计算机断层扫描(computed tomography,CT)和磁共振成像(magnetic resonance imaging,MRI)可对EAT体积定量和定位。MRI是金标准,但缺点是成本较高且耗时长。CT成本高,具有辐射。正电子发射计算机断层扫描可评估炎症活动,但其具有微创、不易获得且价格昂贵的缺点。新的成像指标CT脂肪衰减指数可作为血管周围脂肪炎症的标志物评估其炎症状态[11]。EAT的评估应成为临床实践的一部分,用来辅助临床工作,帮助识别更易患CVD的患者,并提供相关的临床和诊疗信息。
3 EAT与HF
HF是一种复杂的临床疾病,是由多种原因导致的心肌收缩和舒张功能受损。HF的分类依据左室射血分数(left ventricular ejection fraction,LVEF)可分为射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)(LVEF≤40%),中间范围射血分数心力衰竭(heart failure with mid-range ejection fraction,HFmrEF)(LVEF为41%~49%),射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)(LVEF≥50%)。HFrEF的主要特征是心肌细胞的丢失和拉伸,多发生在心肌梗死之后,导致收缩功能受损,心室明显扩大和重塑。相反,HFpEF通常与全身炎症或代谢紊乱有关,可直接损害冠状动脉微血管内皮功能。而HF患者中,约50%的患者为HFpEF。至今为止的研究可得出EAT主要与HFpEF的发展有关,但也参与HFmrEF和HFpEF的发生和发展。
最近的研究表明,EAT在代谢紊乱和主要不良心血管事件的发生及发展中起着重要作用。van Woerden等[12]使用MRI检查了HFmrEF和HFpEF患者及健康对照组的EAT。结果表明,在体重指数相似的情况下与对照组相比,HF组的总EAT体积和心室EAT体积显著增加,而两组之间的心房EAT体积无差异。这些结果表明,并非肥胖本身,而是脂肪分布可能导致HF的发生。而在HFrEF患者中,EAT含量低于健康个体的情况更多[13],这可能与左心室重塑有关。如冠状动脉疾病、肥胖和糖尿病等合并症也会影响HFrEF患者EAT的体积。严重的HFrEF患者可表现为弥漫性全身性脂肪减少,因此EAT的体积也是减少的。研究[14]表明,测量EAT厚度有助于对HF患者或HF风险增加患者进行分类。最近的一项研究[15]也显示,HF患者局部EAT与局部心脏结构和功能密切相关,因此更好地了解EAT在HF发病机制中的作用可为HF开辟新的治疗道路。
EAT通过多种机制影响HF情况下的心脏功能,如炎症增加、脂质沉积、自主神经失调和纤维化。EAT分泌各种类型的脂肪因子,如瘦素、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、脂联素等,EAT中的脂肪因子显著高于皮下脂肪组织[16]。在HF时,EAT分泌的脂肪因子可扩散到血管的外膜、中膜和内膜,并与内皮细胞和血管平滑肌细胞相互作用,EAT还可通过旁分泌和扩散的方式直接将脂肪因子释放到心肌和冠状动脉,从而影响心脏功能。如前所述,生理条件下的脂联素通过抗炎、抗肥厚、抗纤维化和提高胰岛素敏感性的作用来保护心血管组织。但脂联素的积累也参与了代谢功能障碍和HF的进展[17]。脂联素通过激活AMPK信号抑制缺氧-复氧条件下的肥大信号传导和细胞凋亡。当PPAR-α/AMPK通路失活时,脂联素会导致脂肪毒性,加剧胰岛素抵抗,降低慢性HF患者脂联素受体1、脂肪酸和葡萄糖代谢酶的表达[18]。此外,脂联素被认为可增强胰岛素刺激的Akt磷酸化,并通过与脂联素受体1和脂联素受体2相互作用启动AMPK和p38激酶活化,可使葡萄糖摄取和脂肪酸氧化增强以改善HF。EAT和心肌之间无筋膜相隔,过多的EAT衍生脂肪酸可被心肌细胞吸收,导致脂质异位沉积。进而发展为心肌细胞紊乱、功能障碍和细胞凋亡,最终导致HF的发生和发展。HEpEF患者的心肌内脂肪含量明显比HFrEF患者或无HF的个体高[19]。高脂肪积累会使脂肪因子的水平升高,增强心脏组织的促炎活性。
EAT也可通过内源性的肾上腺素能和胆碱能神经,经由神经激素机制参与HF的发病机制。EAT分泌的肾上腺髓质素是一种血管活性肽,由环磷酸腺苷、一氧化氮、肾脏前列腺素系统和血管内皮生长因子介导,具有利钠和血管生成的作用,包括去甲肾上腺素和肾上腺素。肾上腺髓质素通过刺激一氧化氮合成和拮抗血管紧张素Ⅱ、内皮素-1的作用扩张血管,还可诱导血管内皮生长因子生物表达,促进HF中必需的血管生成。有研究[17]表明,HF患者EAT中去甲肾上腺素水平是皮下脂肪组织的5.6倍,是血浆中水平的2倍。因此EAT的分泌异常与HF的病理发展有关。在HFrEF患者中,肾上腺髓质素生物合成的活性增加会使心肌中肾上腺髓质素累积,并使收缩功能恶化。
EAT分泌的miRNA属于非编码RNA,功能性miRNA参与HF的发病机制,如心脏重构、心肌肥厚、心肌细胞凋亡和缺氧。此外,miRNA目前被认为是HF的循环生物标志物。人类EAT中的巨噬细胞已被确定为分泌miRNA的主要来源[17]。EAT分泌的miRNA似乎通过旁分泌或内分泌信号传导的方式直接干扰心肌细胞,因此这些miRNA也可能是心脏代谢疾病发展过程中的积极参与者。来自脂肪组织的miRNA通过脂肪细胞的发育、增殖、分化、胰岛素抵抗和脂肪代谢在调节葡萄糖和脂质代谢方面发挥重要作用。有研究[20]发现miRNA-21与转化生长因子-β途径相关而增加心肌纤维化。miRNA-23b是一种抗凋亡因子[21],与左心室重塑有关。由于EAT主要存在于大型哺乳动物中,从健康个体中无法获得,因此目前对EAT相关miRNA的研究相对缺乏。但EAT分泌的miRNA可能有助于反映早期EAT功能障碍和心脏病进展(见图1)。
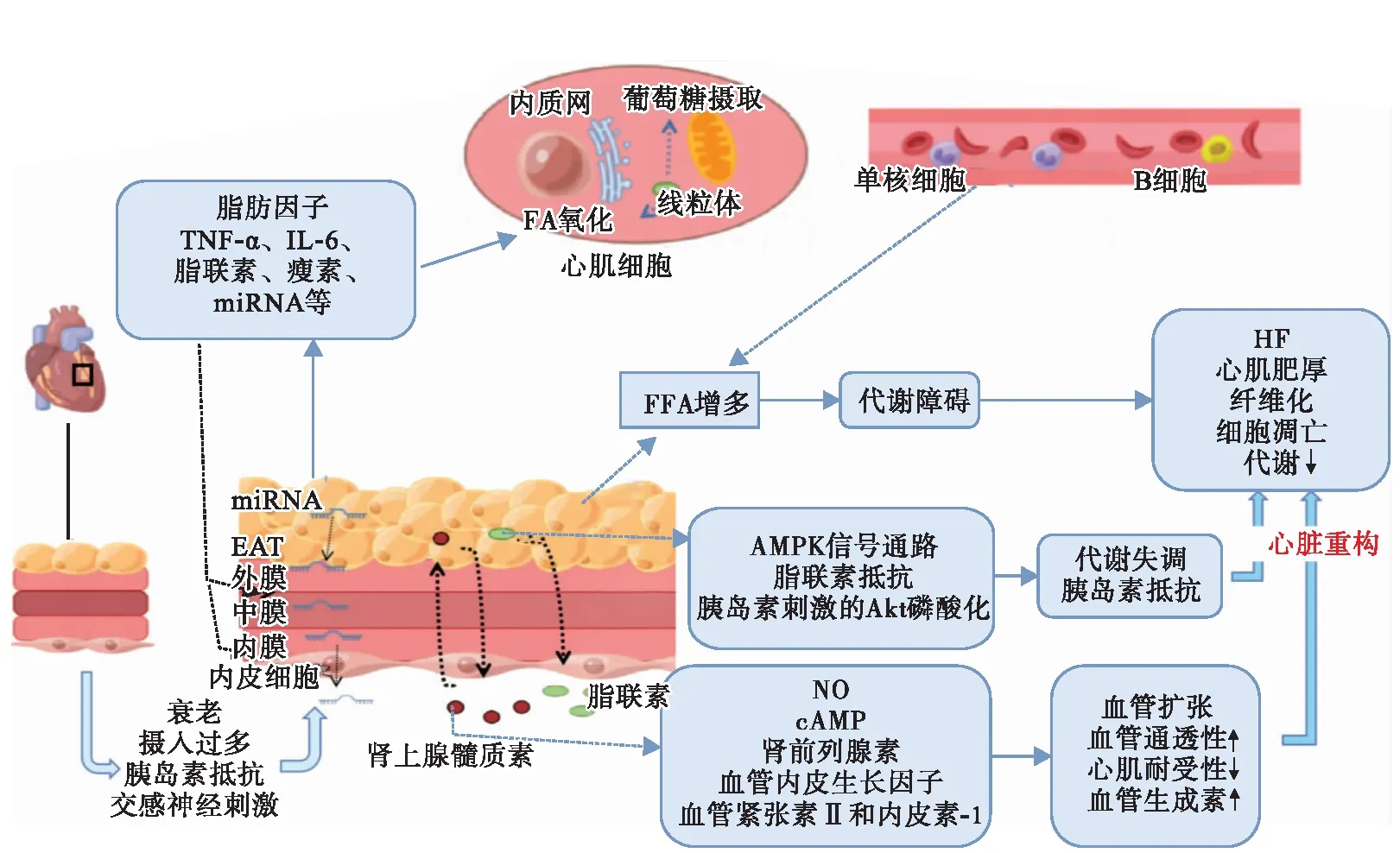
注:FA,脂肪酸;FFA,游离脂肪酸;NO,一氧化氮;cAMP,环磷酸腺苷。
4 EAT的治疗
4.1 减肥和手术
有研究[22]表明,阻力和耐力训练都会降低EAT的体积,表明体育锻炼对EAT有调节作用,并可降低CVD的风险。另一种减少EAT体积的方法是饮食[23]。20例严重肥胖的受试者接受了为期6个月限制饮食的减肥计划,超声心动图显示EAT厚度减少了33%[24]。有小组研究[25]调查减重手术对EAT的影响,经超声心动图评估,51例患者术后2年EAT厚度减少31%。由此可见改变生活方式(如健康饮食和运动)和减重手术对EAT和心血管健康的改善是非常明显的,但患者依从性差异较大,很难达到理想效果。因此,对EAT的调节还需着眼于药物治疗。
4.2 他汀类药物
他汀类药物治疗冠心病患者的临床益处是公认的。随着临床研究的不断完善,发现他汀类药物的作用范围逐渐扩大,包括其抗炎、对EAT的调节、抗心律失常和改善心肌纤维化的作用。Alexopoulos等[26]证明,他汀类药物治疗可降低EAT的体积,并且强化治疗比中等强度治疗效果更好。Raggi等[27]指出,他汀类药物可使CT中的EAT衰减降低,并且独立于其降脂作用,这间接表明降低了EAT炎症。如HFpEF动物模型[28]所示,他汀类药物还可改善心肌纤维化,同时也与HF患者发病率和死亡率的降低相关[29]。除他汀类药物外,有研究[30]表明降血脂药前蛋白转换酶枯草溶菌素9抑制剂也可使EAT厚度明显降低。
4.3 二甲双胍
二甲双胍是应用最广泛的治疗糖尿病的药物。其机制是激活腺苷一磷酸活化蛋白激酶调节能量稳态并抑制合成代谢途径。Ziyrek等[31]表明,二甲双胍单药治疗3个月后,EAT厚度减少10%。
4.4 胰高血糖素样肽-1受体激动剂
胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor,GLP-1R)激动剂是主要用于治疗2型糖尿病和肥胖症的可注射药物,可提供降血糖以外的心血管益处。内脏脂肪减少是GLP-1R激动剂利拉鲁肽的非降糖作用之一。在2型糖尿病和肥胖症患者中,GLP-1R激动剂相对于减轻体重更能降低EAT厚度[32]。相关研究[33]发现,EAT表达GLP-1R,而皮下脂肪不表达。因此,激活EAT中的GLP-1R可减少局部脂肪生成,提高脂肪利用率,诱导棕色脂肪分化,并调节肾素-血管紧张素-醛固酮系统[34]。这些代谢变化可能有助于GLP-1R激动剂对心血管系统的有益作用。
4.5 选择性钠-葡萄糖共转运蛋白2抑制剂
选择性钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose co-transporter 2 inhibitors,SGLT2i)主要在肾脏中表达,其作用主要是增加钠和葡萄糖的排泄,从而降低血糖水平,适用于HFpEF和HFrEF的治疗,且与糖尿病状态无关。心血管结局试验[35]表明,SGLT2i治疗可降低主要不良心血管事件、心血管死亡和HF的风险。SGLT2i可在临床上显著降低EAT厚度或体积,部分不依赖于体重减轻。SGLT2i促进了脂肪酸底物转变,导致脂肪酸氧化、脂肪分解和酮体生成增加,并改善了心肌葡萄糖代谢[36]。HF时,心肌胰岛素介导的葡萄糖摄取和线粒体氧化代谢受损[37],心肌对脂肪酸和葡萄糖的氧化能力降低,心肌酮的利用率增加。这种底物的选择提高了耗氧量,可更好地为心脏供能。SGLT2i可诱导EAT脂解,并有助于改善心肌代谢。EAT是脂肪酸和脂质的主要来源,如果脂肪酸和脂类过多和储存,由于其特殊的解剖结构,可能会渗透底层心肌并导致HF[19]。因此,SGLT2i可通过增加EAT脂解和酮体氧化来降低心肌内脂质含量。SGLT2i还改善了EAT的炎症状态[38]。它们已被证明对HF和内皮功能障碍有效[39]。但还需进一步研究来阐明SGLT2i对EAT的作用机制。
5 总结
随着近年来对EAT的不断了解,EAT已成为了一个可测量、可改善的心血管危险因素,为心血管风险分层提供了定性价值。当前可利用超声心动图、CT和MRI等非侵入性成像技术对EAT进行评估。EAT是一个具有生物功能的内脏脂肪组织,可调节全身代谢,并且EAT可通过多种机制介导HF的发生和发展,通过调节EAT的厚度和体积可发挥其保护心脏的潜力和功能,为CVD的药物治疗开辟一条新的途径。但仍需进一步的研究证实调节EAT可能是HF的潜在治疗靶点,这可能是未来EAT研究的重点和热点。

