Brd2 通过Wnt/β-catenin 信号通路调控小鼠C2C12 成肌细胞的分化
夏瑞雪 张小涵 胡亚军 赵 冰 李益明 于 敏△
(1复旦大学基础医学院生物化学与分子生物学系 上海 200032; 2复旦大学代谢分子医学教育部重点实验室 上海 200032;3复旦大学附属华山医院内分泌科 上海 200040)
骨骼肌约占健康人体重的40%,是机体最重要的组成部分之一,对生理稳态的维持起着重要的调控作用[1]。骨骼肌具有高度的可塑性和强大的再生能力,轻度受损后通常可以在2~3 周内恢复正常的结构和功能。骨骼肌干细胞也被称为卫星细胞(satellite cells,SCs),分布在肌膜和基底层之间,通常处于静息状态,接收损伤环境发出的各种信号刺激后被激活,甚至可以迁移至受损部位,重新进入细胞周期后大量增殖,部分子细胞恢复至静息状态,维持自身细胞群的稳定,另一部分通过分化、融合和进一步发育形成具有收缩能力的肌纤维,修复受损组织[2-4]。大量研究表明Wnt/β-catenin 信号通路参与胚胎骨骼肌发育和成体骨骼肌的再生过程,调控卫星细胞和成肌细胞的发育分化[5-9]。深入探究Wnt 通路在骨骼肌发育和再生中的信号传导机制及其互作的调控网络,将为相关肌肉疾病的治疗提供更多的思路和可能性。
溴结构域蛋白2(bromodomain containing 2,Brd2)属于溴结构域和超末端结构域(bromodomain and extraterminal domain,BET)蛋白家族,在哺乳动物体内广泛表达。它作为转录调控因子特异性结合乙酰化的组蛋白,组装成转录复合体发挥转录激活或抑制的功能,在染色质重塑、早期胚胎发育、前脂肪细胞分化、脂肪组织的糖脂代谢以及肿瘤的发生和发展等过程中具有重要功能[10-15]。BET 家族的抑制剂能够抑制成肌细胞的分化,但Brd2 是否发挥调控作用尚不清楚[16]。本研究使用骨骼肌体外研究常用的小鼠C2C12 成肌细胞系,探究Brd2 对其分化能力的影响及分子作用机制,对解析骨骼肌发育及再生的调控机制具有重要意义。
材 料 和 方 法
主要材料小鼠C2C12 成肌细胞为本实验室前期保存,DMEM 高糖培养基购自美仑生物技术有限公司,胎牛血清购自美国HyClone 公司,马血清购自以色列BI 公司,Brd2 抗体(#5848)和Phospho-β-Catenin(Ser33/37/Thr41)抗体(#9561)购自美国Cell Signaling Technology 公 司 ,Myog 抗 体(ab1835)购自美国Abcam 公司,Desmin 抗体(WL0174)购自万类生物科技有限公司,MyHC 抗体(MAB4470)购自美国R&D Systems 公司,β-catenin 抗体(17565-1-AP)、α-tubulin 抗体(HRP-66031)、CoraLite488 荧光基团(SA00013-1)和HRP标记的二抗(SA00001-1,SA00001-2)均购自美国Proteintech 公司。
数据集和数据库基因表达综合数据库(Gene Expression Omnibus,GEO)由美国国立生物技术信息中心创建,收录全球范围内研究者上传的微阵列芯片、二代测序以及其他形式的高通量基因组数据,对公众免费开放。使用GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/)中的数据集GSE11681和GSE13608 进行基因表达分析。
C2C12 细胞培养及诱导分化使用生长培养基(DMEM 高糖培养基+10%胎牛血清+青/链霉素混合液)对C2C12 细胞进行普通的增殖培养,当细胞密度达到80%~90% 时,更换为分化培养基(DMEM 高糖培养基+2%马血清+青/链霉素混合液)诱导成肌分化,每2 天换液1 次。
细胞转染在293T 细胞中进行Brd2 过表达和RNA 干扰慢病毒的包装,过滤后收集上清,分装保存于-80 ℃冰箱。待C2C12 细胞密度达到30%~40%时,加入适量病毒上清及终浓度为8 μg/mL 的聚凝胺(polybrene),37 ℃培养48 h。更换为含有5 μg/mL 嘌呤霉素的DMEM 高糖培养基筛选1 周,获得稳定表达的细胞株。
细胞免疫荧光实验诱导C2C12 细胞分化至第4 天,弃去培养基,PBS 清洗3 次,每次5 min。用4%多聚甲醛室温固定10 min,PBS 清洗3 次。再加入免疫染色通透液室温穿孔10 min,PBS 清洗3 次。5%的BSA 室温封闭30 min,一抗4 ℃过夜孵育,二抗室温避光孵育1 h。DAPI 染细胞核10 min,PBS清洗3 次,然后用荧光显微镜(日本Olympus 公司,型号:IX51S8F3)采集图像。
Western blot 检测使用RIPA 裂解液提取细胞总蛋白,BCA 法进行蛋白定量。SDS-PAGE 电泳分离蛋白后,300 mA 恒流湿转,把蛋白质转移到PVDF 膜上。5%脱脂奶粉室温封闭1 h 左右,再加一抗4 ℃过夜孵育。加二抗室温孵育1 h 后,使用ECL 化学发光液显色,在全自动化学发光图像分析系统(上海天能公司,Tanon5200 系列)中采集并保存图像。
qRT-PCR 检测Trizol 法提取细胞总RNA,参照试剂盒(武汉爱博泰克公司,货号RK20429)说明书反转录为cDNA,然后进行荧光定量PCR 反应,采用2-ΔΔCt法计算目的基因相对表达量。引物序列如下所示,GAPDH:上游序列5'-CATGGCCTTCCGTGTTCCTA-3',下游序列5'-TGCCTGCTTCACCACCTTCT-3';Sfrp1:上游序列5'-GCTCAACAAGAACTGCCACA-3',下游序列5'-CTCGGGGAACTTGTCACATT-3';GSK3β:上游序列5'-CCACATGCTCGGATTCAGGC-3',下游序列5'-TGTCCACGGTCTCCAGCATTAGTAT-3'。
转录组测序胰酶适度消化后收集细胞,委托晶能生物公司进行转录组测序。Trizol 法提取总RNA,使用琼脂糖凝胶电泳和Nanodrop 超微量分光光度计检测RNA 的完整性和纯度,建库后在Illumina Novaseq 6000 测序平台进行高通量测序分析。使用R 语言,调用DESeq2 软件包(4.1.1 版本)在不同样本组之间筛选差异表达基因,并用clusterProfiler 包(3.14.3 版本)和org.Mm.eg.db 包(3.10.0 版本) 进行富集分析和ID 转换。然后用ggplot2 包(3.3.6 版本)对结果进行可视化,阈值满足|log2(fold Change)|≥1 及P≤0.05。
统计学处理使用GraphPad Prism 8.0 和Image J 软件计算和作图,多组间比较采用单因素方差分析,两组间比较采用非配对t检验,P<0.05 为差异有统计学意义。
结 果
Brd2 在肌营养不良患者的骨骼肌组织中低表达选取GEO 数据库中分别包含2A 亚型肢带型肌营养不良(GSE11681)和2 型强直性肌营养不良(GSE13608)患者的骨骼肌组织芯片数据进行分析,结果显示与健康人相比,Brd2 在这些患者的骨骼肌组织中表达水平较低,提示Brd2 可能在骨骼肌再生过程中发挥一定的作用(P<0.001,图1)。
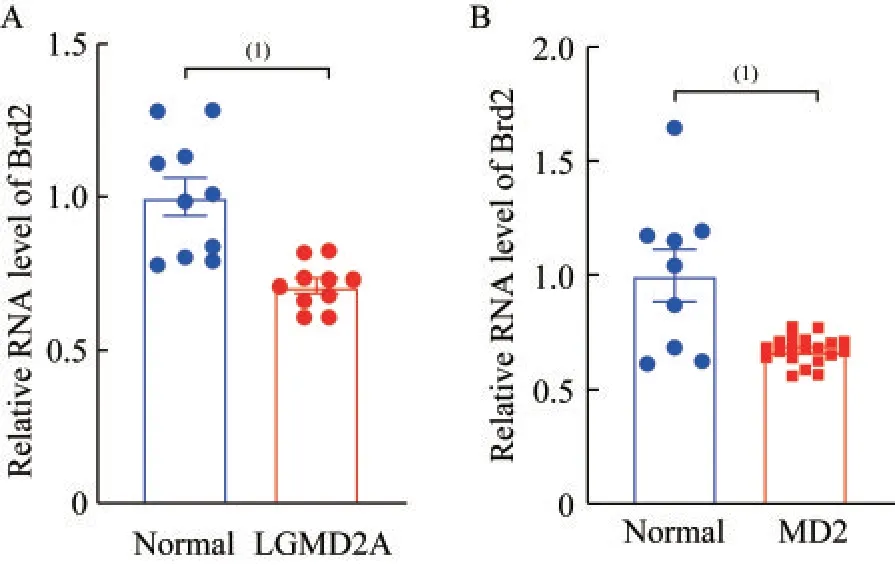
图1 Brd2 在两类肌营养不良症患者的骨骼肌组织中低表达Fig 1 Brd2 expressed lowly in patients with two types of muscular dystrophy
Brd2 在小鼠C2C12 成肌细胞分化过程中的表达模式使用含2% 马血清的分化培养基诱导C2C12 细胞后,第4 天在显微镜下观察到有长条形的肌管形成(图2A)。利用Western blot 实验检测C2C12 细胞成肌分化不同时期Brd2 和分化标志物Myog 的表达情况,结果显示Brd2 蛋白表达水平在诱导分化第2 天时显著升高,第8 天时显著降低;Myog 蛋白表达水平随诱导时间呈先升高后降低的趋势,并且在第4~8 天时均呈高表达(图2B)。
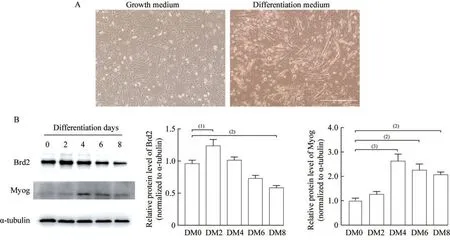
图2 Brd2 在小鼠C2C12 成肌细胞分化过程中的表达模式Fig 2 Expression pattern of Brd2 in the process of mouse C2C12 myoblast differentiation
敲低Brd2 抑制小鼠C2C12 细胞成肌分化为进一步探究Brd2 对C2C12 细胞成肌分化能力的影响,当C2C12 细胞密度达70%~80%时更换为分化培养基,诱导第4 天Western blot实验结果显示,敲低Brd2 后,成肌标志分子Myog 和Desmin 蛋白表达水平显著降低(PBrd2<0.01,PMyog<0.01,PDesmin<0.05,图3A)。同时,细胞免疫荧光染色实验结果显示,敲低Brd2 后C2C12 细胞分化形成的肌管数目显著减少,统计结果显示shScramble 对照组(pcdh 空载体包装的慢病毒)肌管融合指数约为9.42%,敲低Brd2 的实验组肌管融合指数约为3.46%(P<0.01,图3B)。

图3 敲低Brd2 后抑制小鼠C2C12 成肌细胞的分化Fig 3 Knock-down of Brd2 inhibited mouse C2C12 myoblast differentiation
过表达Brd2 促进C2C12 细胞成肌分化诱导第4 天的Western blot 实验结果显示,过表达Brd2后,成肌标志分子Myog 和Desmin 蛋白表达水平显著升高(P<0.05,图4A),生成的肌管显著增多,统计结果表明Ctrl-Vector 对照组肌管融合指数约为9.04%,OE-Brd2 过表达实验组约为16.00%(P<0.001,图4B)。
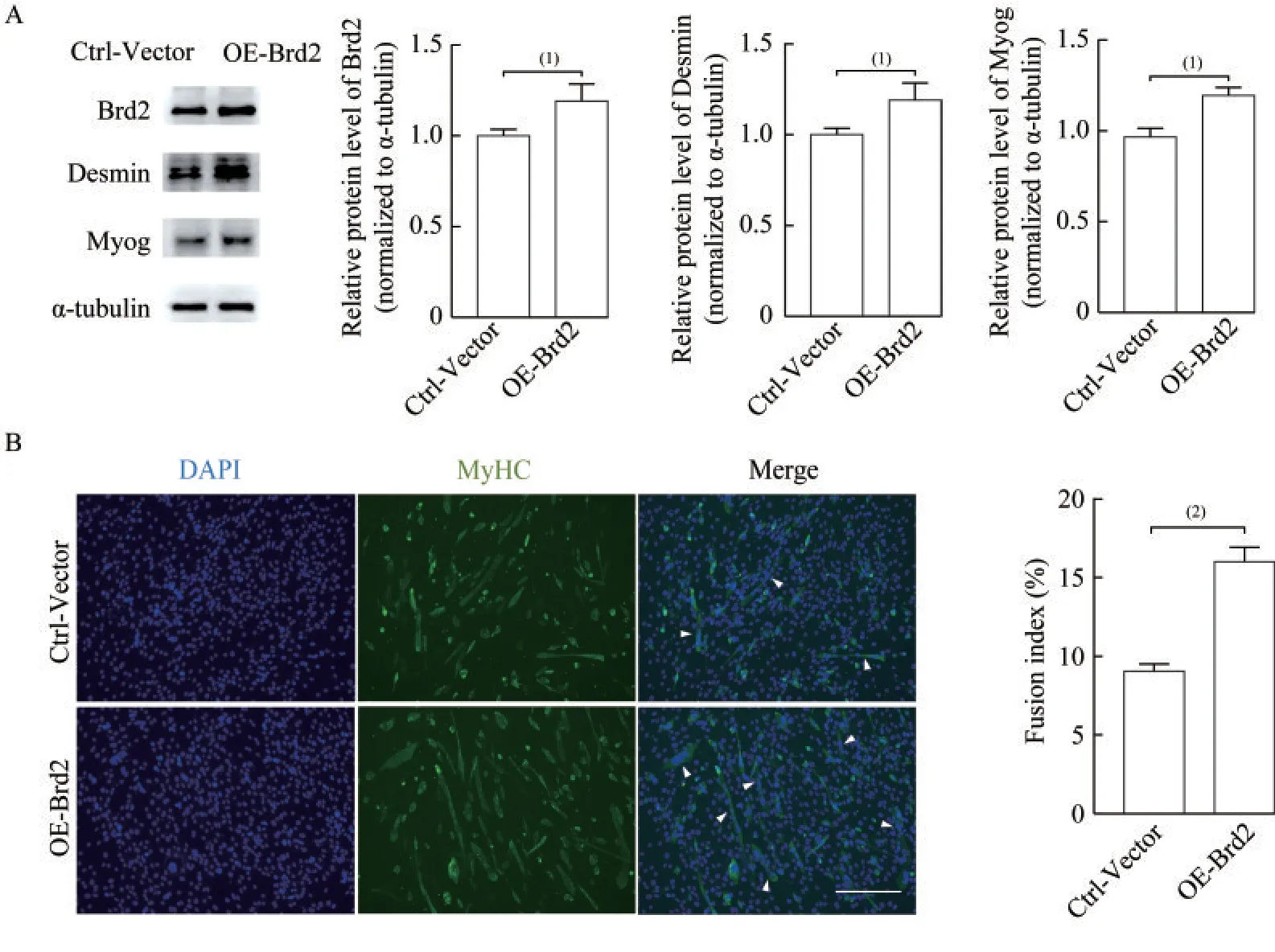
图4 过表达Brd2 后促进小鼠C2C12 成肌细胞的分化Fig 4 Overexpression of Brd2 promoted mouse C2C12 myoblast differentiation
转录组测序分析敲低Brd2 后对C2C12 细胞进行转录组测序,利用DESeq2 软件筛选差异表达基因(|log2(fold Change)|≥1 和P≤0.05),结果显示上调的差异表达基因有111 个,下调的差异表达基因有59 个(图5A)。对差异基因进行GO 功能分析,选择前4 位进行可视化展示,结果显示在细胞组分方面,差异基因表达产物主要存在于细胞间连接、轴突部分、极化生长部位和生长锥等;在分子功能方面发现主要富集于结合类固醇、结合蛋白质C 末端、结合辅肌动蛋白和构成肌肉组分等;在生物学过程方面发现主要参与肌细胞和肌管分化以及对成纤维细胞生长因子的细胞响应等(图5B)。KEGG 通路富集分析显示,Wnt 信号通路被显著富集(图5C),且Wnt 通路抑制因子Sfrp1 和GSK3β 表达上调。RT-qPCR 实验验证发现,敲低Brd2 后Sfrp1 的mRNA 表达水平显著升高(P<0.001),GSK3β 上调水平无显著差异(图5D)。

图5 转录组测序结果分析及验证Fig 5 Analysis and verification of RNA-Seq results
Wnt/β-catenin 信号通路验证体外诱导C2C12细胞成肌分化3 天,利用Western blot 实验检测Wnt/β-catenin 通路中关键信号分子β-catenin 的活性,结果显示与对照组相比,shBrd2 敲低组细胞的β-catenin 磷酸化(Ser33/37/Thr41)水平上调(P<0.01)、β-catenin 蛋白总量减少(P<0.05,图6A);OE-Brd2 过表达组β-catenin 磷酸化水平下调(P<0.01)、β-catenin 蛋白总量增加(P<0.05,图6B)。

图6 小鼠C2C12 成肌细胞分化过程中Brd2 对Wnt/β-catenin 通路中关键信号分子的影响Fig 6 Effect of Brd2 on key signaling elements in Wnt/β-catenin pathway during mouse C2C12 myogenic differentiation
Wnt3a 是Wnt/β-catenin 信号通路的激动剂,诱导第5 天时,敲低Brd2 可以抑制Wnt3a 对C2C12 细胞成肌分化的促进作用,其中分化标志物Myog 的蛋白表达水平得到部分恢复(图7A),同时在普通光学显微镜下也观察到肌管数目有所增加(图7B)。

图7 敲低Brd2 抑制Wnt3a 对小鼠C2C12 细胞成肌分化的促进作用Fig 7 Knock-down of Brd2 inhibited the promotion effect of Wnt3a on mouse C2C12 myogenic differentiation
讨 论
Brd2 作为重要的转录调控因子,参与机体的生长发育和生理代谢,影响胚胎的早期发育过程。敲除Brd2 的胚胎无法存活,神经管发育出现缺陷[10-11]。Brd2 在外胚层谱系的形成和维持中也发挥关键的调控作用[13,17]。我们实验室前期发现Brd2 也可以调控前脂肪细胞的分化以及小鼠的脂肪分解进程[14,18]。骨骼肌是机体最大的代谢器官之一,其功能异常会影响机体正常的生命活动,甚至导致死亡,但Brd2 在骨骼肌中的作用尚不清楚。
骨骼肌受损后主要通过SCs 进行修复,但在许多病理情况下其再生能力会下降[19]。基因遗传变异可以损害SCs 的功能,是引发肌营养不良疾病的因素之一。研究发现,PAX7、MYMK和DMD等不同的基因突变都能诱导SCs 发生病变,影响SCs 的活性和成肌能力[20-22]。我们利用GEO 数据库分析了两类肌营养不良患者和正常人骨骼肌组织的芯片数据,发现Brd2 在肌营养不良患者的骨骼肌中低表达;在成肌细胞体外分化过程中,分化标志分子Myog 在分化后期第4~8 天时均呈高表达,Brd2 蛋白表达水平随诱导时间呈先上升后下降趋势,诱导第2 天时表达升高,第8 天时表达降低,初步提示Brd2 可能影响了成肌细胞的分化能力,在骨骼肌再生过程中发挥正向调控作用。Myog 属于生肌调节因子(myogenic regulatory factors,MRFs)家族,是肌肉特异性转录因子。MRFs 被认为是骨骼肌生长发育和成肌细胞增殖和分化过程中关键的调控因子,各成员的表达具有时序性。Myog 是肌管和肌纤维形成的必需因子,在分化后期高表达,主要参与调控成肌细胞的融合和分化。Brd2 和Myog 在诱导分化过程中的表达模式不一致,二者可能不存在直接的调控关系,详细的分子作用机制仍需要更深入的探索。
为进一步探究Brd2 是否影响成肌细胞的分化能力,我们使用慢病毒介导的基因过表达和RNA干扰技术,在C2C12 细胞中分别敲低和过表达Brd2,结果发现Brd2 可以促进成肌细胞的分化。敲低Brd2 后,对C2C12 细胞进行转录组测序,KEGG分析发现Wnt 信号通路被显著富集,负调控因子Sfrp1 和GSK3β 的表达上调。
Wnt 通路在进化过程中高度保守,是生物体内最重要的调节网络之一[23]。大量研究显示,经典Wnt/β-catenin 信号通路的激活能够促进成肌细胞的分化,β-catenin 是关键的效应分子,能够进入细胞核内调控靶基因的转录,GSK3β 属于丝氨酸/苏氨酸蛋白激酶家族,是细胞内多个信号通路重要的组成部分,在Wnt/β-catenin 通路起负向调控作用。当缺乏Wnt 信号时,β-catenin 的Ser33、Ser37 和Thr41位点可被GSK3β 磷酸化,β-catenin 再经β-TrCP 泛素化后最终被蛋白酶体降解[9]。Sfrp1 蛋白在结构上与Frizzled 受体相似,因而能够竞争性结合Wnt配体,阻断Wnt/β-catenin 下游通路的激活[24]。
经RT-qPCR 实验验证,敲低Brd2 后Sfrp1 的mRNA 表达水平上调,GSK3β 则无显著差异。但GSK3β 是否可能受翻译或翻译后水平的调控,例如磷酸化和蛋白质降解过程等,仍有待深入探究。诱导C2C12 成肌细胞分化第5 天时,Western blot 实验检测发现敲低Brd2 后β-catenin 磷酸化(Ser33/Ser 37/Thr41)水平上调、蛋白总量减少,说明Wnt/β-catenin 信号通路被抑制;而过表达Brd2 后,Wnt/β-catenin 通路被激活。同时,在分化培养基中添加Wnt 信号通路激动剂Wnt3a,能够部分恢复敲低Brd2 的C2C12 成肌细胞分化能力。上述结果表明Brd2 可能通过调控Sfrp1 的表达和Wnt/β-catenin信号通路的活性影响C2C12 细胞的成肌分化过程。但Brd2 怎样作用于Wnt 通路以及是否影响分化相关的其他调控网络,具体的分子机制仍不十分清楚。作为表观调控因子,Brd2 是否直接调控Sfrp1等的表达也是后续研究的重点。
本研究初步发现Brd2 通过Wnt/β-catenin 信号通路促进成肌细胞的分化,未来拟构建小鼠肌肉损伤修复模型并开展体内实验,进一步明确Brd2 在骨骼肌再生中的作用,以期为骨骼肌相关疾病的治疗提供可能的靶点和理论依据。
作者贡献声明夏瑞雪 数据采集,论文构思、撰写和修订。张小涵,胡亚军 数据采集和整理。赵冰 论文审阅和修订。李益明 论文修订,实验指导。于敏 论文构思和修订,实验设计。
利益冲突声明所有作者均声明不存在利益冲突。

