响应面法优化酶辅助碱法提取香榧饼粕蛋白工艺研究
廖晖,吴峰华
(浙江农林大学,浙江 杭州 311300)
香榧(Torreyagrandiscv. Merrili)又称榧子、真榧、细榧等,红豆杉科榧树属常绿乔木,为我国珍稀经济树种之一,已有1 300多年的栽培历史。香榧是一种营养价值较高的坚果,其食用部位为种仁,研究表明,香榧种仁中油脂含量高达42.61%~54.39%,其中80%为不饱和脂肪酸[1];蛋白质含量为10.43%~14.29%,含有17种氨基酸,且必需氨基酸总量约占总氨基酸含量的40%[2-3]。香榧饼粕是香榧子制油后产出的副产物,通常用于动物饲料和农业肥料,经济效益低。但冷榨饼粕压榨条件温和,色泽浅、抗营养因子含量低、蛋白变性程度低,是一种极具开发价值的优质蛋白质资源。
目前,碱法是提取植物蛋白主要方法之一,具有操作简单、效率高、低成本等优点。碱溶液不仅能破坏细胞壁,引起纤维素和半纤维素组分和结构的改变,而且可以增加蛋白质的溶解度[4]。但传统碱法容易引起氨基酸结构的变化,使蛋白质变性,从而造成蛋白质的营养品质和必需氨基酸含量的下降,并且随着pH值、温度和提取时间的增加而加剧[5-6]。酶法辅助提取蛋白质是通过糖酶降解细胞壁中的多糖,破坏细胞骨架结构,增加细胞内蛋白质的溶出[7]。研究表明,酶辅助碱法具有提取能耗低、回收率高、溶剂用量少、对蛋白破坏程度小等特点[8-9]。本研究以香榧饼粕为原料,考察纤维素酶、半纤维素酶、果胶酶、木聚糖酶等细胞壁降解酶对蛋白质提取率的影响,比较碱法与酶辅助碱法所提取蛋白的优劣。在此基础上,优化酶辅助碱法提取蛋白工艺,旨在开发出一条绿色高效的高品质蛋白制备新途径。
1 材料与方法
1.1 材料与试剂
香榧产自浙江丽水市松阳县三都乡水竹村;植物提取复合酶制剂(主要包含纤维素酶、半纤维素酶、果胶酶等,纯度≥99%),购自成都万象宏润生物科技有限公司;果胶酶(30 000 U·g-1)、木聚糖酶(100 000 U·g-1)、纤维素酶(10 000 U·g-1)、半纤维素酶(5 000 U·g-1),购自上海麦克林生化科技有限公司;石油醚(分析纯,沸点30~60 ℃)、氢氧化钠(分析纯)、盐酸(分析纯)、考马斯亮蓝R-250(分析纯),购自国药集团化学试剂有限公司。
1.2 仪器与设备
TDL-40B-Ⅱ低速大容量离心机,上海安亭科学仪器厂;PHSJ-3F 实验室pH计,上海精密科学仪器有限公司;LC-ES-60SH 电动搅拌器,上海力辰邦西仪器科技有限公司;T6 新世纪型紫外可见分光光度计,北京普析通用仪器有限责任公司;AL104 电子天平,梅特勒-托利多仪器(上海)有限公司;HWS-24 电热恒温水浴锅,上海一恒科学仪器有限公司;FD-1A-80冷冻干燥机,北京博医康实验仪器有限公司;GL-3250C磁力搅拌器,海门市其林贝尔仪器制造有限公司;质谱仪,AutoflexⅢ型,日本岛津仪器有限公司。
1.3 方法
1.3.1 原料预处理方法
将香榧剥壳后,取香榧仁进行冷榨。饼粕处理方法:将香榧饼粕粉碎成粉后过60目筛,加入5倍的石油醚,在室温下用磁性搅拌器搅拌提取2 h,然后将其过滤、弃去上清液后收集沉淀,以上过程重复操作3次后所得的沉淀物在室温下置于通风橱挥干1 h后得脱脂粉。然后放入45 ℃的烘箱中干燥,使其含水量下降至5%后放入塑封袋放置于4 ℃的冰箱保存备用。
1.3.2 香榧蛋白提取工艺
酶辅助碱法提取工艺流程:香榧饼粕粉末(4 g)→添加蒸馏水(料液比1∶10)→调节pH→加酶→一定温度水浴搅拌(100 r·min-1)酶解→95 ℃灭酶10 min→调节溶液pH值至9→50 ℃水浴搅拌(100 r·min-1)提取1 h→离心(8 000 r·min-1,10 min)分离→香榧蛋白提取液。
碱法提取工艺流程:香榧饼粕粉末(4 g)→添加蒸馏水(料液比1∶10)调节溶液pH至9→50 ℃水浴搅拌(100 r·min-1)提取3.5 h→离心(8 000 r·min-1,10 min)分离→香榧蛋白提取液。
1.3.3 蛋白提取率的计算
蛋白质含量采用凯氏定氮法进行测定,蛋白提取率按以下公式计算:
Y=100m1/m2。
式中,Y为提取率,%;m1为提取液蛋白质量,g;m2为香榧粕蛋白质量,g。
1.3.4 酶预处理辅助碱法单因素试验
酶的筛选:控制料液比为1∶10,酶添加量为1.0%,酶解时间2 h,碱提时间1 h,比较纤维素酶、半纤维素酶、木聚糖酶、果胶酶、复合酶制剂在其最适酶解pH值和温度条件下的蛋白提取率,优选提取率高的酶进行单因素试验及响应面优化设计。
优选出最优酶后,分别对4个单因素进行梯度试验。包括:酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%)、酶解温度(10、20、30、40、50 ℃)、酶解pH(4.4、4.7、5.0、5.3、5.6)和酶解时间(0.5、1.0、1.5、2.0、2.5、3.0 h)。
1.3.5 蛋白提取响应面试验
在单因素试验基础上,根据Box-Behnken试验原理,采用响应面分析法进行优化,以蛋白提取率为指标,设计四因素三水平的响应面试验(表1)。

表1 响应面实验设计因素与水平
1.3.6 氨基酸含量分析
采用GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,略作修改。将100 mg样品与10 mL 6 mol·L-1盐酸放入水解管中混合,滴加苯酚2~3滴,摇匀封口。密封的水解管在110 ℃下水解22 h。水解后,将水解液转移至比色管中进行稀释和振动混匀。准确吸取水解液1.0 mL,置于60 ℃真空干燥箱中干燥,干燥后用1 mL水溶解残渣,重复操作两次。在液相色谱仪分析样品之前,需要进行衍生化。最后采用高效液相色谱仪进行分析。
1.4 数据分析
每组实验3次重复,实验结果以n±SD表示,采用Microsoft Excel 2016进行数据整理和图形绘制,Design-Expert 8.0.6.1用于响应面试验设计及分析,使用SPSS 24.0 中的单因素Tukey 检验进行显著性分析(P<0.05 表示差异显著)。
2 结果与分析
2.1 最优酶的筛选
植物细胞壁主要由纤维素和多糖类物质组成,蛋白质被纤维类物质包裹在其中。利用细胞破壁酶处理植物组织,可降解植物细胞壁的纤维素骨架,使植物细胞壁崩溃,细胞壁内的有效成分游离,提高胞内物质的提取率[10]。由图1可知,在相同条件下,木聚糖酶对香榧蛋白的提取率最高,较半纤维素酶高了10.8百分点,较纤维素酶和混合酶制剂的提取率高了24.1百分点和27.9百分点,果胶酶提取率最低,比木聚糖酶低了35.6百分点。故选择木聚糖酶作为最优酶进行试验。
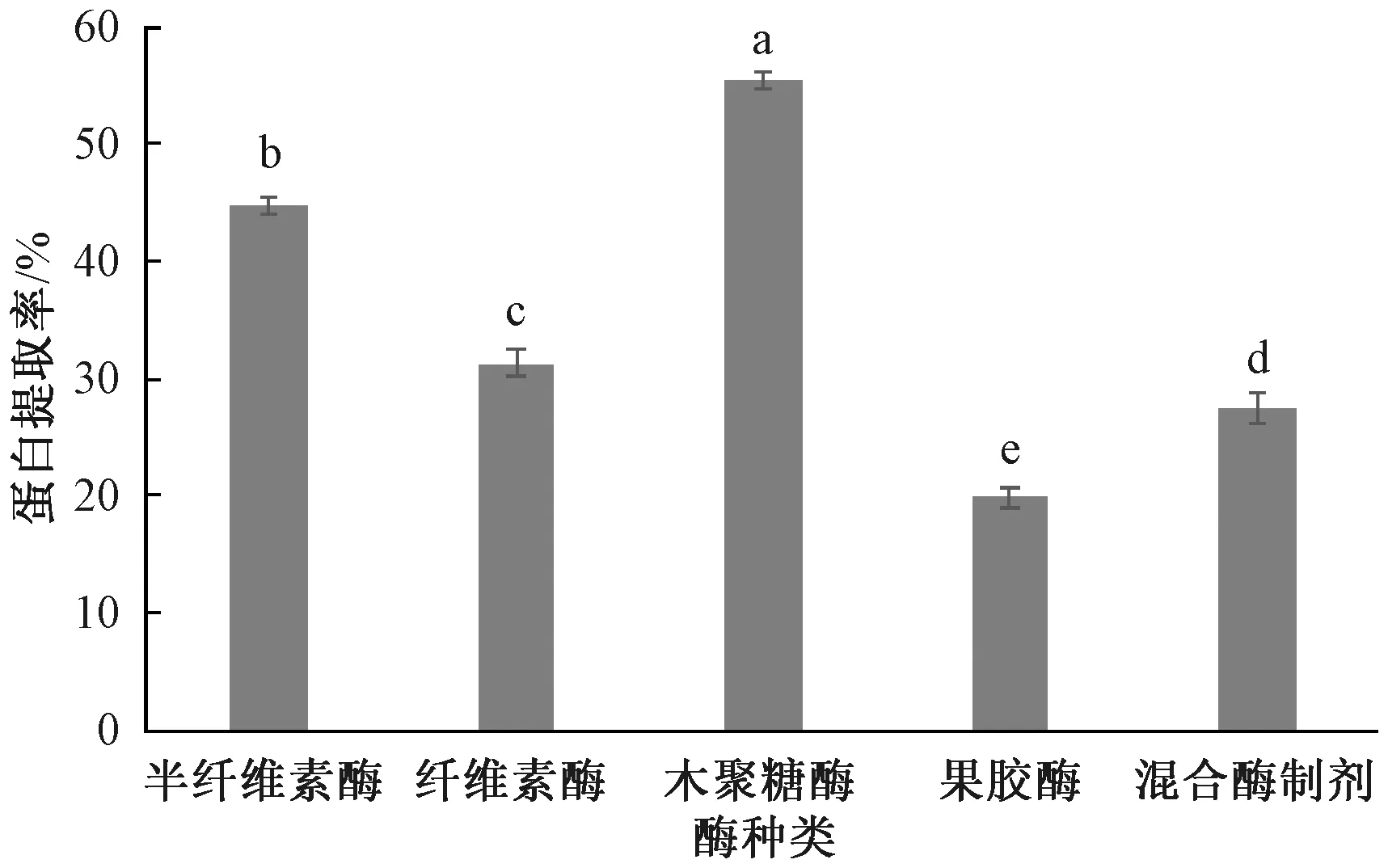
同组柱上无相同小写字母表示不同处理间差异显著(P<0.05),图2~5同。
2.2 提取工艺单因素试验结果
2.2.1 木聚糖酶添加量对蛋白提取率的影响
由图2可知,随着酶添加量的增加,蛋白质提取率不断增加,当添加量为1.0%时提取率达到最高,为68.9%。这是因为随着木聚糖酶添加量的增加,酶浓度增大,酶与底物接触机会相应增大,提高蛋白提取效率。但当木聚糖酶添加量超过1%后,蛋白提取率开始下降,这是因为过量的酶浓度作用,酶会将底物包裹而减少了酶解作用[11]。故选择酶的添加量为1.0%。

图2 木聚糖酶添加量对蛋白提取率的影响
2.2.2 温度对蛋白提取率的影响
由图3可知,随着酶解温度的升高,蛋白提取率升高,在50 ℃时达到最高点,提取率为71.4%。这是因为木聚糖酶受外界温度变化影响大[12]。在低温时,酶活性会被抑制,导致提取率较低,在未达到最适温度时,随着温度增加,被活化的分子数增加,分子间反应几率增加,促进酶促反应。但当温度超过50 ℃时,蛋白提取率反而下降。这是因为高温条件会造成酶的失活,影响蛋白提取率。此外,温度过高会引起蛋白质发生热变性,部分溶解的蛋白质会发生交联聚合,蛋白质的溶解度降低使得蛋白质得率降低[13]。故选择酶解提取温度为50 ℃为宜。

图3 提取温度对蛋白提取率的影响
2.2.3 pH值对蛋白提取率的影响
由图4可知,pH值对蛋白提取率的影响呈现出先上升后下降的趋势。当pH值较低时,蛋白质提取率随着pH值增大而增大,当pH值达到5.0时,提取效果最佳,为70.3%。这是因为木聚糖酶在最适pH值时,酶活性强,有利于细胞壁的破裂,pH值偏高或偏低均使酶活性减弱,影响提取率[14]。故酶解pH值选择5.0为宜。
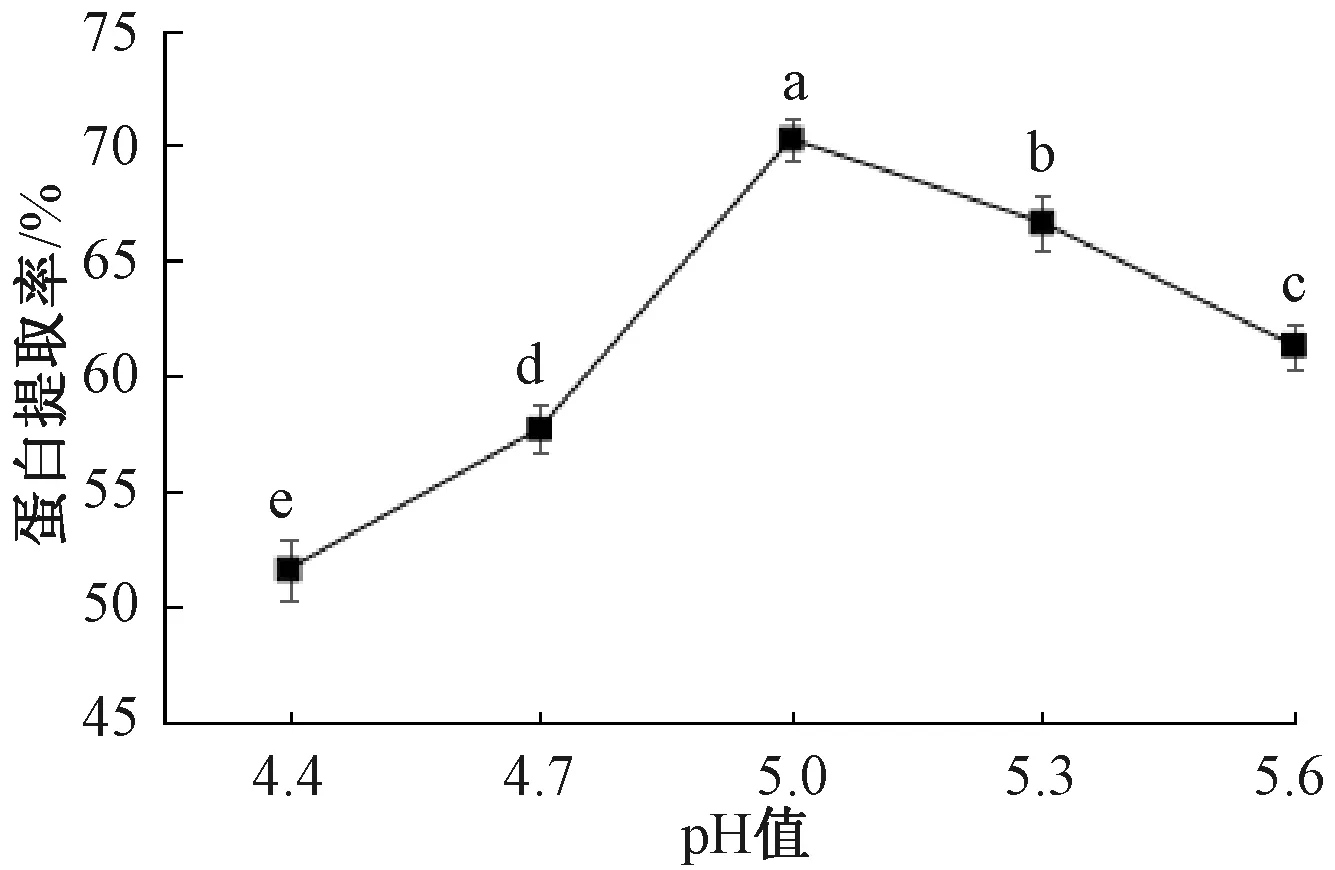
图4 pH值对蛋白提取率的影响
2.2.4 酶解时间对蛋白提取率的影响
由图5可知,在酶解时间0.5~2.0 h时,蛋白提取率随着时间的增加呈显著上升趋势,这是因为随着时间的延长木聚糖酶与底物反应逐渐完全[15],当时间达到2.0 h时,提取率达到了65.1%;当酶解时间为3.0 h时,蛋白提取率为68.5%,仅比2.0 h的提取率增加了3.4百分点。综合考虑生产效率和蛋白质得率来看,继续延长时间对蛋白提取意义不大,而且还会随着时间的增加导致蛋白质变性,发生凝集沉淀[16],因此选择酶解时间为2.0 h。

图5 酶解时间对蛋白提取率的影响
2.3 提取工艺响应面试验结果
选择木聚糖酶添加量、酶解温度、酶解pH值、酶解时间为响应因素,蛋白提取率为响应值,运用Box-Behnken试验设计原理,进行响应面试验,试验结果见表2。

表2 香榧蛋白提取Box-Behnken实验设计及结果
设木聚糖酶添加量为A,酶解温度为B,酶解pH值为C,酶解时间为D,对表2试验数据进行逐步回归多次拟合,可得提取率(Y)二次多项式方程:
Y= 75.16+4.08A+0.20B+3.73C-2.76D-2.83AB+0.060AC+0.10AD-4.35BC-5.78BD+0.68CD-4.26A2-9.33B2-6.29C2-8.86D2。
由表3可知,提取率的回归模型极显著(P<0.001);失拟项F值为3.66,表明模型拟合度良好,能较好解释响应中的变异。同时模型的决定系数R2=0.982 7,说明模型拟合程度良好,该模型能解释98%响应值的变化;校正决定系数R2Adj=0.965 5,说明试验结果有96.55%受试验因素的影响;失拟项P值不显著(0.111 2>0.05),说明试验无失拟因素存在,表明预测值与实测值之间具有高度相关性,残差均由随机误差引起。因此,可以用此回归模型对蛋白提取率进行分析和预测。
方差分析中的显著性检验可以判断自变量对因变量的影响。由表4和图6可知,B、C和D对蛋白提取率的影响极显著(P<0.01),而A影响不显著(P>0.05);模型中的交互项BC和BD对蛋白提取率的影响极显著(P<0.000 1),AB影响高度显著(P<0.01),而AC、AD和CD影响不显著(P>0.05);模型中的二次项A2、B2、C2和D2对蛋白提取率的影响均达极显著水平(P<0.000 1)。

图6 不同因素对香榧蛋白提取率影响的响应面图

表4 蛋白质中氨基酸含量组成 单位:mg·g-1
通过Design-Expert 8.0.6.1软件对回归模型进行数学分析获得最佳工艺为木聚糖酶添加量1.26%、酶解温度48.85 ℃、酶解pH值5.10、提取时间2.45 h,在此条件下,预测的蛋白提取率最大理论值为76.97%。
2.4 香榧蛋白提取验证实验
为了方便实际操作,将条件调节为木聚糖酶添加量1.30%、酶解温度49 ℃、酶解pH 值5.1、提取时间2.5 h,并结合料液比1∶10(g·mL-1),pH 9.0碱提1 h,对香榧饼粕中蛋白进行提取验证试验。3次平行试验得到实际平均蛋白提取率为76.13%,与理论值相比,其相对误差为1.09%,小于5%,因此,该法优化得到的蛋白提取工艺条件准确可靠,且与碱提3.5 h蛋白提取率(77.82%)效果相当,有效减少了碱提时间,可以作为工业化应用的依据。
2.5 蛋白质中氨基酸含量分析
蛋白质中的必需氨基酸含量的高低及构成比例直接反映了蛋白质的优劣[17]。对两种方法提取的蛋白质中的氨基酸组成进行了分析,由表4可知,酶辅助碱法与碱法所提取的蛋白中均含有此次检测的17种氨基酸,并包含7种必需氨基酸,色氨酸因碱性条件下水解未能检测出。两种方法所提取蛋白中的总氨基酸含量相近,必需氨基酸/总氨基酸平均值均高于WHO/FAO的推荐值(36%),但酶辅助碱法所提取蛋白中的必需氨基酸/总氨基酸平均值(43.26%)显著高于碱法所提取的蛋白中的必需氨基酸/总氨基酸平均值(39.58%)。这主要是因为用碱溶解蛋白质时间太长会导致-OH和-SH的脱氢和脱硫,导致一些氨基酸的含量降低[18]。赵素斌等[19]对燕麦麸蛋白的研究中也发现,与碱法相比,同等条件下酶辅助碱法所提取蛋白的必需氨基酸/总氨基酸更高。因此,酶辅助碱法切实地优化了所提取香榧蛋白的营养价值。
3 结论
本文以香榧饼粕作为研究对象,以蛋白提取率为判定标准,从几种常见的破壁酶中筛选出木聚糖酶为蛋白提取最优酶。通过单因素试验和Box-Behnken设计优化,考察了影响蛋白提取率的4个因素,得到的最佳提取工艺参数为料液比1∶10(g·mL-1)、木聚糖酶添加量1.30%、酶解温度49 ℃、酶解pH值5.1、酶解时间2.5 h,在此条件下蛋白提取率为76.13%,与碱法所得蛋白提取率接近,但所提取的蛋白较碱法所提取的蛋白更为优质。利用酶辅助碱法提取香榧蛋白,方法操作和仪器设备简单,反应条件温和,蛋白提取率高。缩短了常规碱性提取的持续时间,减少了蛋白质损伤和不期望产物形成的可能,明显提高了被提取的香榧蛋白的质量。

