圣草酚调控MAPK和Nrf2/HO-1信号通路缓解非酒精性脂肪肝的作用及机制Δ
王楷扬 ,袁 烈 ,宋 燚 ,刘庆龙 ,钟佩伶 ,李文军 ,蔡永青 ,李小丽 ,曾梦华 ,陈剑鸿 #(.陆军特色医学中心药剂科,重庆 0002;2.重庆医科大学药理学系,重庆 0006;3.药物代谢研究重庆市重点实验室,重庆 0006;.重庆医科大学附属第三医院药剂科,重庆 020;.重庆医科大学附属第一医院胃肠外科,重庆 0006)
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种较为常见的慢性肝脏疾病。当肝脏中脂质沉积超过肝脏质量的5%,同时排除过量饮酒或其他已知的肝脏疾病诱因时,即可判定为NAFLD[1]。目前统计的数据表明,世界范围内NAFLD 的发病率约为25%[2]。而我国随着经济社会的发展,不同地区的NAFLD发病率自1990年以来也逐渐升高[3]。NAFLD最典型的特征是脂质的积累和沉积。脂质在肝脏中不断积累,会引起肝脏炎症;同时,随着脂质沉积的进一步增加,脂滴逐渐在肝脏中形成,导致肝纤维化甚至肝硬化的发生[4]。NAFLD 已成为威胁人类健康的危险因素之一,而目前尚无有效的治疗方法,因此寻找有效的治疗药物迫在眉睫。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)相关信号通路是一类高度保守的信号通路,由3个亚群组成,包括细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun 氨基末端激酶(c-JunN-terminal kinase,JNK)和p38丝裂原活化蛋白激酶(p38 MAPK),在细胞增殖、应激、炎症和凋亡中发挥着核心作用[5]。当NAFLD发生后,由于肝脂质沉积诱发了肝脏炎症,MAPK 信号通路可能会被激活[6]。MAPK通路的活化可以使核转录因子红系2 相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)磷酸化,促进Nrf2 的核转位或增加Nrf2 的表达,继而促进Nrf2的下游基因血红素加氧酶1(heme oxygenase-1,HO-1)的转录表达。抑制MAPK相关信号通路表达,可使机体氧化应激水平或炎症水平降低,从而延缓NAFLD 的发生发展[6―7]。
圣草酚化学名为3',4',5,7-四羟二氢黄酮,是一种天然二氢黄酮类化合物,广泛存在于蔬菜、水果和中药中,特别是在柑橘类水果中的含量最为丰富。在北美,印第安人常使用富含圣草酚的植物作为药物治疗气喘、过敏性鼻炎、风湿等疾病[8]。随着对圣草酚研究的进一步深入,其被发现具有抗炎、抗氧化、抗肿瘤、保护神经系统等多种药理活性[8]。同时,也有研究表明圣草酚能够缓解胰岛素抵抗[9],对抗糖尿病引发的肝损伤[10]。本研究拟用C57BL/6J 小鼠构建NAFLD 体内模型,用HepG2 细胞构建NAFLD 体外模型,探究圣草酚缓解NAFLD的作用,并从MAPK和Nrf2/HO-1信号通路角度初步探究其可能的作用机制,为圣草酚的进一步开发利用提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有:AE163型电子分析天平(瑞士Mettler Toledo公司)、IX51型荧光倒置显微镜(日本Olympus 公司)、TDL-5A 型离心机(上海菲恰尔分析仪器有限公司)、Multiskan 型全波长酶标仪(美国Thermo Fisher Scientific 公司)、Mini-PROTEAN 型垂直电泳设备电泳仪(美国Bio-Rad公司)。
1.2 主要药品与试剂
圣草酚对照品(批号20201011,纯度≥98%)为重庆医科大学附属第三医院药剂科刘松青教授课题组惠赠;丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、甘油三酯(triglyceride,TG)和丙二醛(malondialdehyde,MDA)检测试剂盒(批号分别为20220506、20220504、20220506、20220508)均购自南京建成生物工程研究所;兔源过氧化物ERK、兔源磷酸化ERK(p-ERK)、兔源JNK、兔源磷酸化JNK(p-JNK)、兔源Nrf2、兔源HO-1、兔源β-肌动蛋白(β-actin)一抗均购自美国Cell Signaling 公司;辣根过氧化物酶标记的山羊抗兔IgG二抗购自北京中杉金桥生物技术有限公司;活性氧(reactive oxygen species,ROS)检测试剂盒(批号BB22041)购自上海贝博生物科技有限公司;BCA 定量试剂盒(批号020123230510)购自上海碧云天生物科技有限公司;尼罗红染色试剂购自美国Sigma公司。
1.3 动物
本研究所用动物为SPF 级健康C57BL/6J 小鼠,共16 只,雄性,6~8 周龄,体重18~22 g,购自重庆医科大学实验动物中心,动物生产许可证号为SCXK(渝)2018-0003。所有小鼠均饲养于重庆医科大学实验动物中心,饲养环境温度为(22±2)℃、相对湿度为55%、12 h 光照/12 h 黑暗循环。经过1 周基础饲料适应性喂养后进行后续实验。本研究经陆军军医大学动物伦理委员会审核批准,伦理批件编号为AMUWEC20223914。
1.4 细胞系
人肝癌HepG2 细胞系(货号CL-0103)购自武汉普诺赛生命科技有限公司,经STR鉴定正确。
2 方法
2.1 体内实验
2.1.1 动物分组、造模与给药
将16 只小鼠按照体重随机分为4 组,分别为对照组、NAFLD 模型组和圣草酚低、高剂量组(50、100 mg/kg)[11],每组4 只。对照组小鼠提供常规饲料进行喂养,其余3组小鼠提供高脂饲料喂养4周诱导NAFLD模型[12];在预处理4周后,采取腹腔注射方式(0.01 mL/g)进行给药,每日1次,连续6周。对照组小鼠每日注射生理盐水,NAFLD 模型组小鼠每日注射玉米油,圣草酚低、高剂量组小鼠每日分别注射相应剂量的圣草酚玉米油溶液。
2.1.2 动物一般情况观察
实验过程中,每日观察小鼠状况,每周记录小鼠体重变化,每2日称定并记录小鼠进食饲料的质量。
2.1.3 动物标本采集与处理
给药结束后,各组小鼠禁食不禁水24 h,经眼球取血,以3 000 r/min离心10 min,分离血清,-20 ℃冰箱中保存。取血后,脱颈处死小鼠,取出肝脏,用冷生理盐水冲洗,用滤纸吸干后对小鼠肝脏大体进行观察并拍照。称定肝脏质量,取部分肝组织用4%多聚甲醛固定,其余组织分装在EP管内,置于-80 ℃冰箱中保存。
2.1.4 血清中AST、ALT和TG水平测定
取冻存的血清,常规解冻后,按照相应试剂盒说明书操作,检测小鼠血清中AST、ALT和TG水平。
2.1.5 肝组织病理变化观察
取“2.1.3”项下经固定处理的肝组织,进行常规石蜡包埋切片(4 μm)后行常规苏木素-伊红(HE)染色,在荧光倒置显微镜下观察肝组织病变情况。
2.1.6 肝组织中Nrf2、HO-1蛋白表达检测
采用Western blot 法进行检测。取“2.1.3”项下冻存的小鼠肝组织,使用高通量匀浆机将肝组织研磨后,加入Western及IP细胞裂解液提取总蛋白,采用BCA法测定总蛋白浓度。将蛋白高温变性后,取40 μg 变性蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(电压80 V、电泳时间20 min;电压120 V、电泳时间40 min),湿法转膜(电流 400 mA、转膜120 min),加入5%脱脂奶粉封闭2 h;使用TBST 洗膜3 次、5 min/次,加入Nrf2、HO-1 和β-actin 一抗(稀释比例均为1∶1 000),4 ℃孵育过夜;TBST 洗膜,加入对应二抗(稀释比例1∶8 000),ECL化学发光显影。采用ChemiDoc XRS凝胶成像系统进行信号扫描,并使用Image J 软件对扫描的蛋白条带灰度值进行定量分析。以目的蛋白与内参蛋白(β-actin)条带灰度值的比值表示目的蛋白的相对表达水平。
2.2 体外实验
2.2.1 细胞培养及分组、造模、给药
使用含10%胎牛血清和1%青霉素-链霉素的DMEM完全培养基,在37 ℃、5% CO2的湿润培养箱中培养细胞,取对数生长期细胞用于实验。体外实验设置5个组,分别为正常对照组、NAFLD 模型组和圣草酚低、中、高浓度组,每组设置3个复孔。正常对照组细胞正常培养,NAFLD模型组使用0.5 mmol/L油酸处理细胞,诱导体外NAFLD模型[13]。圣草酚低、中、高浓度组在使用0.5 mmol/L 油酸处理细胞的同时,根据培养体系,分别加入浓度为0.05 mmol/L 的圣草酚母液(使用二甲基亚砜溶解),使培养体系中圣草酚终浓度分别为50、100、150 μmol/L[11]。处理24 h 后,收取细胞样本,冻存于-80 ℃冰箱中。
2.2.2 细胞中脂质沉积观察
采用尼罗红染色法进行观察。取HepG2 细胞进行铺板(1×105个/孔),按 “2.2.1”项下进行分组、处理细胞,然后用4%多聚甲醛固定30 min,按照尼罗红染色试剂操作说明进行染色,最后在荧光倒置显微镜下观察细胞中脂滴沉积情况,如有脂滴沉积可见细胞内有绿色高亮荧光。
2.2.3 细胞中TG、MDA和ROS水平测定
取“2.2.1”项下冻存的细胞样本,复温,以功率300 W超声(超声5 s 间隔30 s,重复5 次)破碎细胞,按照试剂盒说明书操作,测定细胞中TG、MDA和ROS水平。
2.2.4 细胞中MAPK和Nrf2/HO-1信号通路蛋白表达检测
取“2.2.1”项下冻存的细胞样本,复温后加入蛋白裂解液,冰上裂解30 min提取总蛋白,采用BCA法测定蛋白浓度。将蛋白高温变性后,取40 μg 蛋白上样,参照“2.1.6”项下方法检测细胞中MAPK和Nrf2/HO-1信号通路相关蛋白的表达。其中,ERK、p-ERK、JNK、p-JNK、Nrf2、HO-1 和β-actin(内参)一抗的稀释比例均为1∶1 000,二抗的稀释比例为1∶8 000。使用Image J软件分析蛋白条带灰度值,以目标蛋白与内参蛋白条带灰度值的比值表示目标蛋白的表达水平,以p-ERK 与ERK、p-JNK与JNK蛋白表达的比值分别表示ERK、JNK蛋白的磷酸化水平。
2.3 统计学方法
采用Graphpad Prism 8.0 软件进行统计分析。计量资料以±s表示,多组间均数比较采用单因素方差分析,两组间均数比较采用LSD-t检验。检验水准α=0.05。
3 结果
3.1 体内实验结果
3.1.1 小鼠体重和肝脏质量测定结果
与对照组比较,NAFLD模型组小鼠体重、肝脏质量均明显升高(P<0.01)。与NAFLD模型组比较,圣草酚低、高剂量组小鼠体重、肝脏质量均显著降低(P<0.01)。结果见表1。
表1 各组小鼠的体重和肝脏质量测定结果(±s,g)

表1 各组小鼠的体重和肝脏质量测定结果(±s,g)
a:与对照组比较,P<0.01;b:与NAFLD模型组比较,P<0.01。
组别对照组NAFLD模型组圣草酚低剂量组圣草酚高剂量组n4 4 4 4体重32.63±0.83 44.55±1.34a 32.43±1.32b 30.20±1.55b肝脏质量1.24±0.08 1.68±0.10a 1.11±0.06b 1.08±0.08b
3.1.2 小鼠血清中AST、ALT和TG水平测定结果
与对照组比较,NAFLD 模型组小鼠血清中AST、ALT 和TG 水平显著升高(P<0.01);与NAFLD 模型组比较,圣草酚低、高剂量组小鼠血清中ALT、TG 水平和圣草酚高剂量组小鼠血清中AST 水平均显著降低(P<0.01)。结果见表2。
表2 各组小鼠血清中AST、ALT 和TG 水平测定结果(±s,n=4)
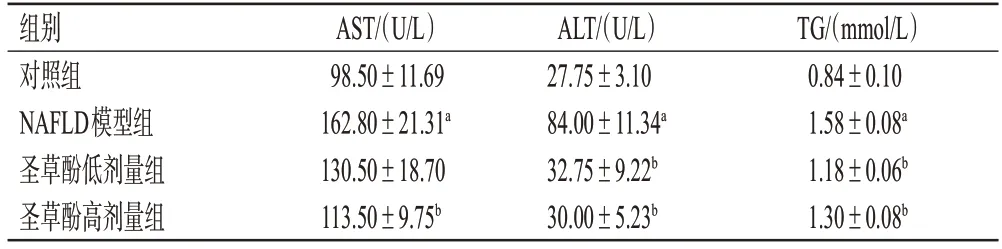
表2 各组小鼠血清中AST、ALT 和TG 水平测定结果(±s,n=4)
a:与对照组比较,P<0.01;b:与NAFLD模型组比较,P<0.01。
组别对照组NAFLD模型组圣草酚低剂量组圣草酚高剂量组AST/(U/L)98.50±11.69 162.80±21.31a 130.50±18.70 113.50±9.75b ALT/(U/L)27.75±3.10 84.00±11.34a 32.75±9.22b 30.00±5.23b TG/(mmol/L)0.84±0.10 1.58±0.08a 1.18±0.06b 1.30±0.08b
3.1.3 小鼠肝脏大体观察结果
对照组小鼠肝脏表面光滑,呈深红色,质地柔韧;NAFLD模型组小鼠肝脏体积明显增大,表面呈浅红色,同时可见灰白色小结节;圣草酚低、高剂量组小鼠肝脏与NAFLD 模型组比较,体积明显减小,表面红润,质地柔韧,灰白色小结节数量减少。结果见图1。
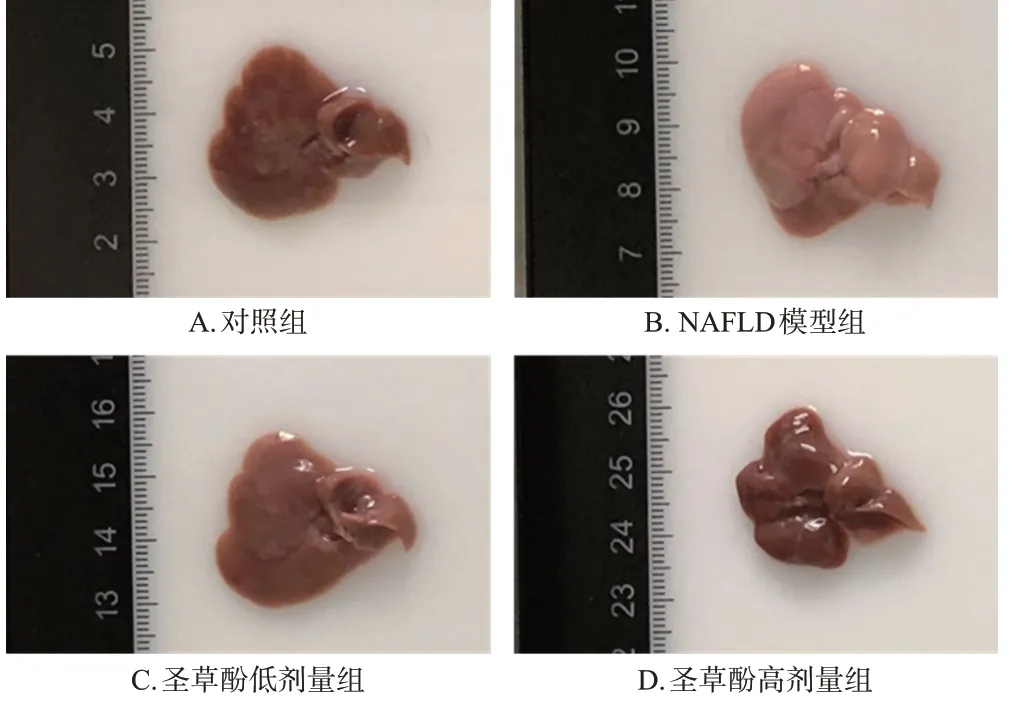
图1 各组小鼠肝脏大体形态观察结果
3.1.4 小鼠肝组织病理观察结果
对照组小鼠肝小叶结构清晰,肝组织结构正常,肝细胞索在中心静脉周围呈放射状排列,细胞质均匀,未出现脂肪空泡;NAFLD模型组小鼠肝组织发生病理性改变,出现大量脂滴沉积形成的空泡;与NAFLD模型组比较,圣草酚低、高剂量组小鼠肝组织病理变化得到显著改善,脂滴沉积形成的空泡数量显著减少。结果见图2。
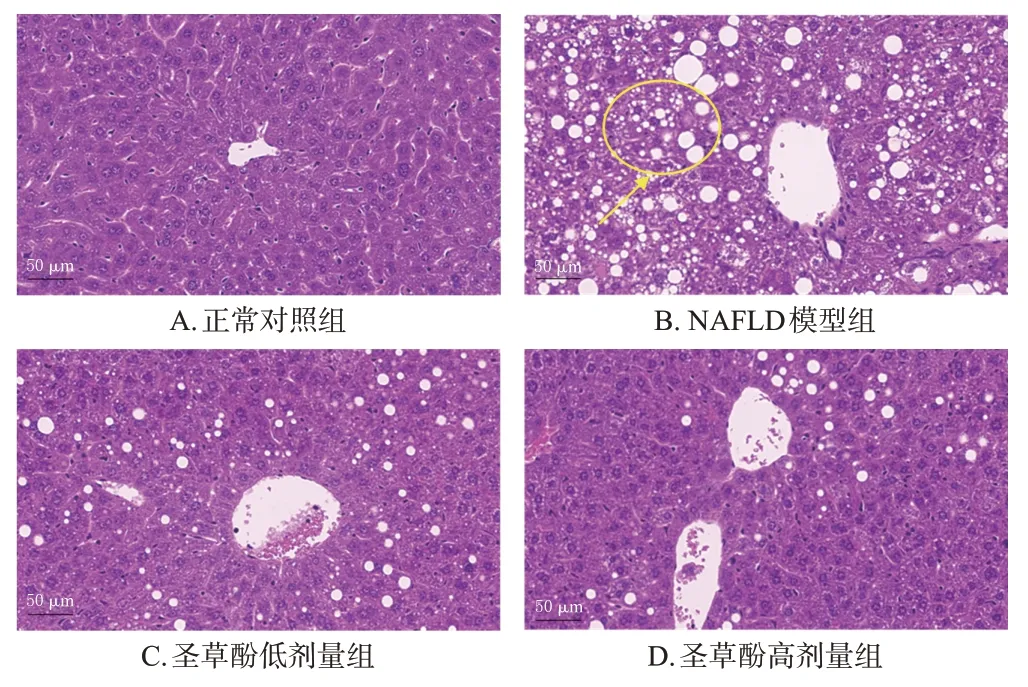
图2 各组小鼠肝组织病理形态观察结果(HE染色)
3.1.5 小鼠肝组织中Nrf2、HO-1蛋白表达测定结果
与对照组比较,NAFLD模型组小鼠肝组织中Nrf2、HO-1 蛋白表达水平显著升高(P<0.01);与NAFLD 模型组比较,各给药组小鼠肝组织中Nrf2、HO-1蛋白表达水平均进一步升高(P<0.01)。结果见图3、表3。
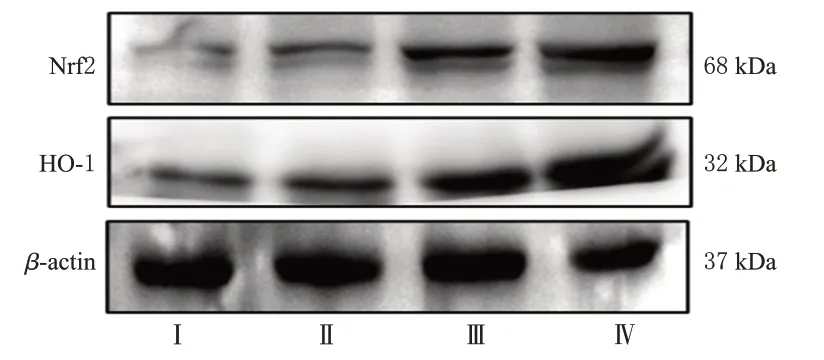
图3 各组小鼠肝组织中Nrf2、HO-1蛋白表达的电泳图
表3 各组小鼠肝组织中Nrf2、HO-1蛋白表达水平测定结果(±s,n=4)

表3 各组小鼠肝组织中Nrf2、HO-1蛋白表达水平测定结果(±s,n=4)
a:与对照组比较,P<0.01;b:与NAFLD模型组比较,P<0.01。
组别对照组NAFLD模型组圣草酚低剂量组圣草酚高剂量组Nrf2/β-actin 1.00±0.00 1.49±0.04a 2.28±0.11b 4.62±0.19b HO-1/β-actin 1.00±0.00 1.12±0.04a 1.76±0.02b 4.20±0.78b
3.2 体外实验结果
3.2.1 细胞中脂质沉积观察结果
正常对照组细胞中未见尼罗红特异性染色的高亮脂滴(荧光强度11.10±0.21);NAFLD 模型组细胞中可见尼罗红特异性染色呈现的绿色荧光高亮区域,且荧光强度(76.73±0.93)显著高于正常对照组(P<0.01);与NAFLD 模型组比较,圣草酚低、中、高浓度组细胞中脂质沉积减少,荧光强度(分别为24.11±1.63、24.88±0.69、24.88±0.30)均显著降低(P<0.01)。结果见图4。
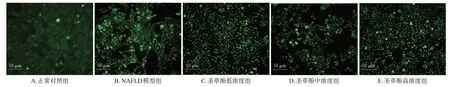
图4 各组细胞的尼罗红染色观察结果(×200)
3.2.2 细胞中MDA、ROS和TG水平测定结果
与正常对照组比较,NAFLD 模型组细胞中MDA、ROS 和TG 水平显著升高(P<0.01);与NAFLD 模型组比较,各给药组细胞中MDA、ROS 和TG 水平均显著降低(P<0.05或P<0.01)。结果见表4。
表4 各组细胞中MDA、ROS和TG水平测定结果(±s,n=3,nmol/mg port)
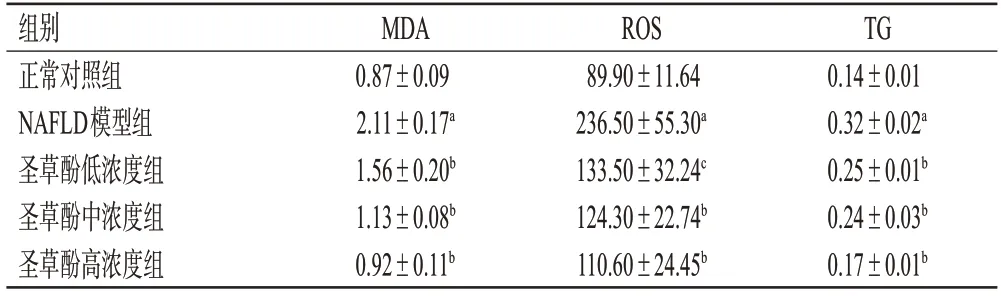
表4 各组细胞中MDA、ROS和TG水平测定结果(±s,n=3,nmol/mg port)
a:与正常对照组比较,P<0.01;b:与NAFLD模型组比较,P<0.01;c:与NAFLD模型组比较,P<0.05。
组别正常对照组NAFLD模型组圣草酚低浓度组圣草酚中浓度组圣草酚高浓度组MDA 0.87±0.09 2.11±0.17a 1.56±0.20b 1.13±0.08b 0.92±0.11b ROS 89.90±11.64 236.50±55.30a 133.50±32.24c 124.30±22.74b 110.60±24.45b TG 0.14±0.01 0.32±0.02a 0.25±0.01b 0.24±0.03b 0.17±0.01b
3.2.3 细胞中MAPK和Nrf2/HO-1信号通路相关蛋白表达水平测定结果
与正常对照组比较,NAFLD 模型组细胞中ERK、JNK磷酸化水平显著上调(P<0.01),Nrf2、HO-1蛋白表达水平显著下调(P<0.01)。与NAFLD模型组比较,圣草酚低、中、高浓度组细胞中ERK、JNK磷酸化水平均显著下调(P<0.01),Nrf2、HO-1蛋白表达水平均显著上调(P<0.01)。结果见图5、表5。
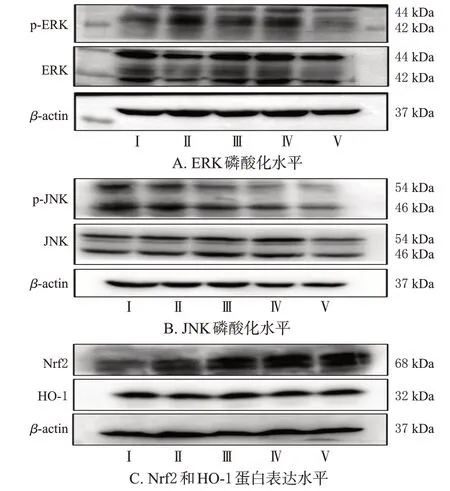
图5 各组细胞中MAPK和Nrf2/HO-1信号通路相关蛋白表达检测的电泳图
表5 各组细胞中MAPK和Nrf2/HO-1信号通路相关蛋白表达水平测定结果(±s,n=3)
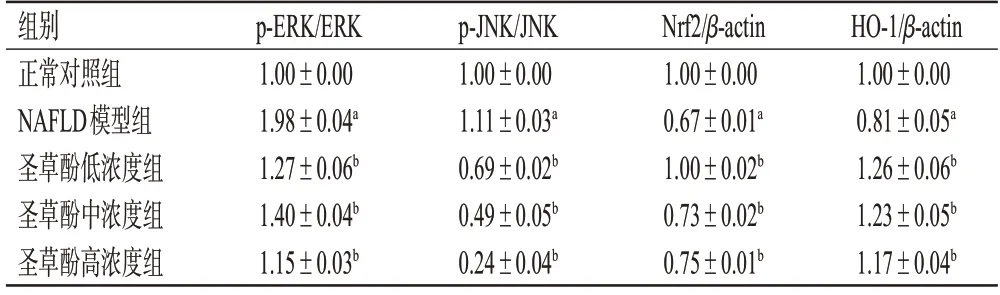
表5 各组细胞中MAPK和Nrf2/HO-1信号通路相关蛋白表达水平测定结果(±s,n=3)
a:与正常对照组比较,P<0.01;b:与NAFLD模型组比较,P<0.01。
组别正常对照组NAFLD模型组圣草酚低浓度组圣草酚中浓度组圣草酚高浓度组p-ERK/ERK 1.00±0.00 1.98±0.04a 1.27±0.06b 1.40±0.04b 1.15±0.03b p-JNK/JNK 1.00±0.00 1.11±0.03a 0.69±0.02b 0.49±0.05b 0.24±0.04b Nrf2/β-actin 1.00±0.00 0.67±0.01a 1.00±0.02b 0.73±0.02b 0.75±0.01b HO-1/β-actin 1.00±0.00 0.81±0.05a 1.26±0.06b 1.23±0.05b 1.17±0.04b
4 讨论
NAFLD 不仅是肝病致残和死亡的重要原因,而且与代谢综合征、2型糖尿病、动脉硬化性心脑血管疾病和肝癌的高发密切相关。因此,迫切需要发现其治疗靶点并开发有效的治疗药物来防治NAFLD。体内实验结果显示,圣草酚给药后能够缓解高脂饲料诱导的NAFLD模型小鼠肝脏中的脂质堆积,降低其体重、肝脏质量及血清中AST、ALT水平;体外实验结果也显示,使用圣草酚处理后同样能够减少HepG2细胞内脂质沉积,同时降低胞内ROS、MDA 和TG 水平。体内外实验结果表明,圣草酚能够缓解NAFLD。
研究表明,肝脏内脂质沉积变性会导致ROS 过表达,进而激活MAPK 信号通路,诱发氧化应激促进NAFLD 的发展[14]。另有文献报道,抑制MAPK 信号通路后会使Nrf2/HO-1信号通路激活,进而发挥抗炎、抗氧化等作用[15―16]。ERK 和JNK 信号转导通路是MAPK 信号转导通路中的经典通路[17],抑制ERK、JNK 的蛋白表达和磷酸化能够缓解炎症和氧化应激[18]。Nrf2 是细胞调节抗氧化应激反应的重要转录因子[19]。当出现氧化应激时,Kelch 样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein-1,Keap1)构象改变,从而使Nrf2从Keap1-Nrf2复合物中解离出来,由细胞质转位到胞核,启动下游的抗氧化应答元件,从而上调细胞的抗氧化因子HO-1 等细胞保护蛋白的活性,以避免氧化应激对肝的损伤[19―20]。在体内外研究中,笔者通过相关实验验证了圣草酚给药后能够有效抑制细胞中ERK、JNK的活性,上调模型动物/细胞中Nrf2、HO-1的表达。该结果表明,圣草酚能够抑制MAPK 信号通路,进而激活Nrf2/HO-1信号通路发挥抗氧化应激的作用,从而缓解NAFLD。
综上所述,笔者通过体内外NAFLD 模型初步验证了圣草酚缓解NAFLD 的效果,且其作用可能与抑制MAPK 信号通路,进而激活Nrf2/HO-1 信号通路发挥抗氧化应激有关。但本研究尚未通过加入抑制剂等方式进行反向验证,机制方面尚需进一步确证。同时,本研究还存在着动物样本量较少的局限性,需要在后续研究中进一步扩大样本量,从而进一步确证圣草酚缓解NAFLD的作用及机制。

