不同程度颈部透明层增厚胎儿进行染色体拷贝数检测的必要性分析
杨兴坤,周晓强,杜佳月,吴水娟,陈淑芬,朱晓丹,李 超,周雅思,郭明娟
(1.佛山市妇幼保健院胎儿研究所妇女儿童医学研究中心,广东 佛山 528000;2.佛山市妇幼保健院产前诊断中心,广东 佛山 528000)
胎儿颈部透明层(nuchal translucency,NT)指胎儿颈椎水平矢状切面皮肤至皮下软组织之间的最大厚度,反映在影像图上即为胎儿颈后皮下组织内无回声带。胚胎在淋巴系统健全之前,少部分淋巴液积聚在淋巴囊或淋巴管形成NT。NT 增厚与胎儿染色体异常和胎儿结构异常密切相关,并且染色体异常的发生率随着NT厚度的增加而升高[1]。
研究表明,NT增厚除了跟胎儿染色体非整倍体有关外,还跟染色体微缺失/微重复综合征密切相关[2]。目前,细胞遗传学检测的“金标准”是染色体核型分析,但其分辨率有限,仅能检出5~10 Mb以上的染色体结构异常,并且需要人工操作的步骤较多,检测周期长,可能因为细胞培养失败而无法获得核型分析结果[3]。传统的细胞遗传学技术不能检测染色体拷贝数变异(copy number variants,CNVs),临床上检测CNVs的常用技术是染色体微阵列分析技术和DNA高通量测序技术[4-7]。
目前,对于仅有NT 增厚单一指标胎儿的研究比较少,且不同程度NT增厚和染色体CNVs的关系尚不明确。因此,本研究收集了514 例孕妇,对胎儿绒毛或羊水同时进行核型分析和或DNA高通量测序技术检测,通过比较染色体异常检出率的差异,分析不同NT值胎儿进行介入性产前诊断的必要性,以及不同程度NT增厚的胎儿,是否有必要同时行染色体核型分析和染色体拷贝数检测。
1 材料与方法
1.1 研究对象
选取2017 年1 月—2022 年5 月在佛山市妇幼保健院进行介入性产前诊断且符合以下条件孕妇514 例为研究对象:①单胎;②夫妇无地中海贫血;③预产期年龄≥35 岁(高龄)或单纯NT 增厚不伴发结构畸形且预产期年龄<35 岁。将单纯因“高龄”进行产前诊断的孕妇228 例分为A 组,2.5 mm≤NT<3.0 mm 不伴结构畸形且非高龄孕妇106 例分为B 组,NT≥3.0 mm 不伴结构畸形且非高龄孕妇180 例分为C 组。A 组年龄为(39.0±2.8)岁,B组年龄为(28.0±3.7)岁,C组年龄(28.0±3.8)岁。
1.2 标本采集及处理
按照常规手术操作规范,每位孕妇抽取羊水30 mL,分装于3 支无菌离心管内,每管约10 mL,4 ℃保存备用。
1.3 染色体核型分析
将20 mL 羊水样本1 140 g 离心8 min 后,取沉淀细胞分别接种于2个培养瓶中,每瓶含5 mL羊水细胞培养基(广州达晖),置于37 ℃、CO2体积分数为5%的培养箱(美国Thermo Forma 3111 型)中培养。培养8 d 后收获细胞,进行染色体制备及G 显带,步骤如下:羊水细胞1 370 g 离心6 min,弃上清,留约0.1 mL;37 ℃低渗5 min,加1 mL固定液(甲醇∶冰醋酸体积比=3∶1)预固定;1 370 g 离心6 min,去上清,加入6 mL 固定液(同前)固定两次;1 370 g 离心6 min,去上清液,加入新鲜固定液(同前)3~4 滴,气泡冲匀,即可进行滴片。滴2 滴已混匀的细胞悬液于冰水浸过的玻片上,70 ℃烤片机上烤干,烤干后放入60 ℃烤箱,过夜。从烤箱中取出玻片,放至室温。放入消化液中作用10~20 s 取出,蒸馏水漂洗。Giemsa染液染色2~5 min,用自来水冲洗,晾干。采用德国徕卡GSL-120全自动扫描仪进行扫描,应用自兴AI分析软件(Release MCA 2.4)进行分析。常规计数20个分裂相,分析5 个核型,嵌合体时计数100 个细胞,根据人类细胞遗传学国际命名体制标准进行核型分析诊断。
1.4 羊水DNA高通量测序分析
取10 mL 羊水样本采用DNeasy Blood and Tissue Kit(德国QIAGEN 公司)提取羊水中细胞DNA,提取步骤按照说明书进行。然后采用染色体CNVs 检测试剂盒(北京贝瑞和康公司,KR2000),按照说明书进行操作。即将50 ng 全基因组DNA 随机消化为180 bp左右的片段,采用酶反应方法将打断后的DNA小片段末端补平,连接接头;采用磁珠纯化的方法进行片段选择和纯化,从而得到DNA文库。由北京贝瑞和康医学检验实验室有限公司在Illumina Next Seq500测序平台(美国Illumina公司)对DNA文库进行测序。本检测仅针对片段大小为100 kb 以上的CNVs 进行致病性分析,CNVs 的临床意义参考2015 版美国医学遗传学和基因组学学会(American Society of Medical Genetics and Genomics,ACMGG)的遗传变异分类[8]。对于CNVs 测序数据的解释,通过检索以下公共数据库进行:DGV(http://dgv.tcag.ca/);DECIPHER(http://decipher.sanger.ac.uk/)和OMIM(http://omim.org/)。将CNVs 分为3类:良性CNVs(benign CNVs,bCNVs)、致病性未知CNVs(variants of uncertain significance CNVs,VUS CNVs)及致病性CNVs(pathogenic CNVs,pCNVs)。
1.5 统计学分析
应用SPSS 23.0 软件进行分析,采用卡方检验分析组间差异,P<0.05为差异具有统计学意义。
2 结 果
2.1 染色体核型和拷贝数检测结果
514例样本,共检测出非整倍体42例(8.17%),致病性CNVs 8 例(1.56%),意义不明突变10 例(1.95%)。在高龄组的228 例中,检测出非整倍体6 例(2.63%),致病性CNVs 3 例(1.32%),意义不明的突变5 例(2.19%),214 例未见异常;在2.5 mm≤NT<3.0 mm 组的106例中,检测出非整倍体5例(4.72%),101例未见异常;在NT≥3.0 mm组的180例中,检测出非整倍体31 例(17.22%),致病性CNV5 例(2.78%),意义不明的CNVs 5 例(2.78%)。染色体核型和拷贝数检测结果见表1,18例有临床意义的CNVs测序结果见表2。
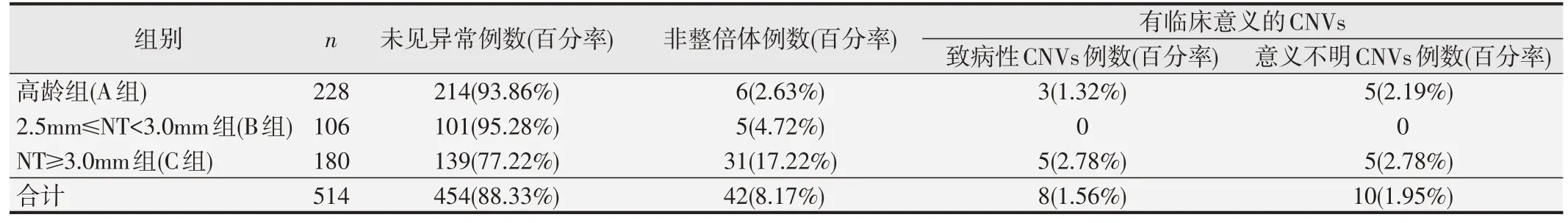
表1 514例样本染色体核型和拷贝数检测结果

表2 18例有临床意义的样本CNVs测序结果
2.2 染色体非整倍体及有临床意义CNVs 检出率的比较
结果见表3。比较高龄组(A 组)、非高龄且不合并结构异常,2.5 mm≤NT <3.0 mm 组(B 组)和NT≥3.0 mm 组(C 组)组间非整倍体及致病性CNVs 检出情况的差异,结果表明3 组间总体差异具有统计学意义(χ2=37.920,P<0.01);A 组和B 组间非整倍体检出率差异无统计学意义(P>0.05),而C组非整倍体检出率高于A组和B组,差异具有统计学意义(P<0.05)。有临床意义的CNVs(包括致病性和意义不明CNVs)检出率在A组和B 组、A 组和C 组之间差异无统计学意义(P>0.05),而C组高于B组,差异具有统计学意义(P<0.05)。
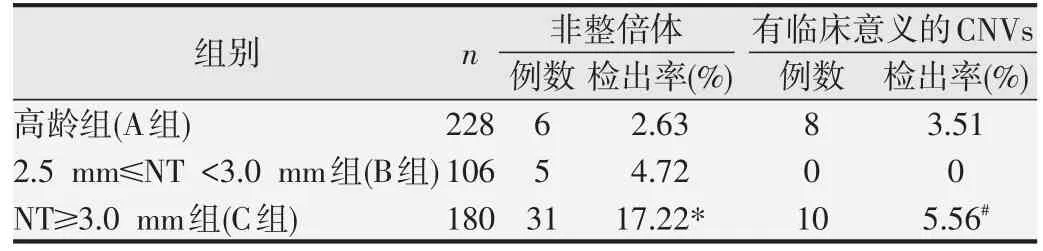
表3 非整倍体和有临床意义的CNVs检出情况的比较
3 讨 论
目前,关于NT 增厚的截断值一直存在争议,临床上一般将NT≥3.0 mm 或NT≥3.5 mm 视为NT 增厚[9-11],有研究提出根据第99 百分位NT 值即3.5 mm来判定是否存在NT 增厚[1,12],也有研究认为NT 的截断值定为3.0 mm[13],NT 厚度为2.5~2.9 mm 定为临界厚度较为合理[14]。另外,对于胎儿2.5 mm≤NT<3.0 mm 的孕妇是建议进行介入性产前诊断还是无创性非整倍体筛查,以及这部分胎儿是否需要在检测染色体非整倍体的同时检测染色体CNVs 是临床争议的重点。因为介入性产前诊断有一定的流产、宫内感染等不可避免的风险,并且染色体CNVs 检测的费用相对昂贵。然而,目前针对这部分人群进行的研究较少,并且现有研究未去除主要混杂因素[15-16],因此本文重点针对这部分人群进行了探讨,并且去除了高龄及胎儿结构异常这两个主要混杂因素。
国内有研究针对1 461 例高龄孕妇进行基因组拷贝数分析,结果显示,致病性染色体异常样本检出率为2.33%(34/1 461)[17],而本研究中高龄组染色体致病性染色体异常检出率为3.95%,较文献报道高1.62%,可能和抽样误差有关。另《中华人民共和国母婴保健法实施办法》中明确规定:预产期年龄超过35岁的孕妇,医师应当对其进行介入性产前诊断。因此,在本研究中,设置了单纯高龄组作为对照组,单纯NT 增厚组(非高龄且不合并结构异常,B 和C 组)作为实验组,比较不同程度NT 增厚在非整倍体和有临床意义CNVs 检出情况是否存在差异,这样就排除了孕妇高龄因素及胎儿结构异常对NT 增厚的影响,得到的结果更客观地反映了不同NT 厚度胎儿染色体异常的情况。本研究研究结果显示,2.5 mm≤NT<3.0 mm 组非整倍体检出率(4.72%)和高龄组(2.63%)相比,差异无统计学意义,说明2.5 mm≤NT<3.0 mm的非整倍体发生率和高龄人群相当,很有必要进行胎儿染色体核型分析。NT≥3.0 mm 组(180 例)的非整倍体检出率为17.22%,其检出率明显高于高龄组和2.5 mm≤NT<3.0 mm 组(P<0.05),应当建议其进行介入性产前诊断。因此,随着NT 值增加,染色体非整倍体的发生概率也随之增加,本结果与其他研究一致[18-19]。
在本研究中,2.5 mm≤NT<3.0 mm 组的孕妇未检测出致病变异或致病性未知CNVs,高龄组致病变异或致病性未知CNVs的检出率3.51%,两组间差异无统计学意义(P>0.05)。然而,NT≥3.0 mm 组中致病变异或致病性未知CNVs 的检出率为5.56%,显著高于2.5 mm≤NT<3.0 mm 组(P<0.05)。因此,2.5 mm≤NT<3.0 mm组的孕妇不一定需要同时检测染色体CNVs,但要跟孕妇交代残余风险;而对NT≥3.0 mm组,应建议同时检测染色体非整倍体及CNVs。
另外,本研究中共8例检出9个pCNVs,其中有3例检出16p13.11 微重复综合征相关的pCNVs,该综合征所在重复区域为神经认知障碍(自闭症、智力障碍、多发性先天畸形)易感区,患儿可能表现出行为异常、发育迟缓、先天性心脏病、骨骼异常等。还有3 例检测出与22q11 重复综合征相关的片段重复,该综合征存在外显不全的情况,患儿表型从正常或几乎正常到严重,变化较大。此综合征最常见的临床症状有智力障碍(97%)、精神运动发育迟滞(67%)、生长受限(63%)等。另外,22q11 重复综合征患者可表现出不同程度的DiGeorge 综合征(DGS)或腭心面综合征(velocardio- facial syndrome,VCFS)表型如腭咽发育不全、腭裂、先天性心脏病、耳聋、肾生殖系统畸形、胸腺缺如、无脾、认知障碍等。还有1 例检测到1 号染色体q21.1 至q21.2 区域重复0.86 Mb,该片段重复相关的疾病为1q21.1微重复综合症,重复片段包含该综合症的关键基因GJA5,GJA8,此综合症有外显不全的情况,患者可从正常到不同程度的智力障碍、轻度特殊面容、心脏结构异常、癫痫、脊柱弯曲、轻度生殖器异常和自闭症等临床症状。另有1 例检出两个pCNVs:Xp2.31 缺 失1.58 Mb 和10q26.13-q26.3 缺失9.52 Mb,X染色体p22.31处缺失区域,包含类固醇硫酸盐(steroid sulphatase,STS)基因的全部,该基因的缺失与类固醇硫酸酯酶缺乏症相关,为X染色体隐性遗传,男性患者主要表现为皮肤异常(鱼鳞癣),部分女性携带者在臂及胫前可见轻度鳞屑。10 号染色体q26.13-q26.3处缺失9.52 Mb区域,覆盖了10q26缺失综合征约60%区域。该综合征患者主要的临床表现为特殊面容、身材矮小、智力障碍、发育迟缓,隐睾症(男)和张力减退等。另外,值得一提的是,此例患者在染色体核型分析中发现10 号染色体长臂大片段缺失,在高通量测序分析中除了检测到该缺失外,还检测到X染色体上存在另一个致病性缺失片段,这说明染色体不同部位大片段异常和微缺失/微重复可同时存在,单纯行染色体核型分析可能会漏诊微缺失微重复异常。因此,如果临床上发现一些先证者,染色体核型异常不能很好地解释临床表现时,有必要进一步进行染色体CNVs的检测。总之,这9个pCNVs中的7例与心脏发育相关,此结果与已有研究结果相符:胎儿心脏结构异常可引起颈静脉血流发生不同程度的变化,导致静脉血流受阻,造成颈静脉压力升高,进而发生颈淋巴管回流障碍,多余的淋巴液聚集于颈项部,从而造成NT增厚[20]。
此外,本研究共检出10 例不确定意义变异(VUS CNVs)胎儿,即依据目前对人类基因组的了解和现有的数据库无法准确解释的基因组变异,无足够证据来确定其临床意义,有待于在以后的研究中明确其致病性[21]。这10 例不确定意义变异病例中,9 例活产,另外1 例选择了引产,活产病例随访未发现发育异常,这就提示我们,对于意义不明的病例,需要专业的遗传咨询医生和孕妇及其家属充分沟通,建议孕妇及其丈夫进行染色体CNVs 检测,明确胎儿染色体微缺失来源,充分评估变异可能的风险,避免不必要的引产,另外对意义不明变异胎儿出生的随访也很重要,可以帮助临床医生积累更多可靠资料,为相关遗传变异的遗传咨询提供依据。
综上所述,NT厚度目前作为孕早期产检常规项目之一,是筛查严重致畸致残性疾病的重要指标。对发现NT 增厚的胎儿,如果不合并其他高危因素,应根据NT厚度,为孕妇提出合理的进一步检测建议。

