肌肉干细胞获取及体外扩增方法的研究进展
薛 冉,施欢笑,丁子健,孙平新,李文林*,汪 超*
(海军军医大学细胞生物学教研室,上海 200433)
骨骼肌是人体质量最大的组织,对支持机体运动、呼吸等机能具有重要作用。肌肉损伤时有发生,战斗伤害、交通事故、手术切除、衰老、疾病等均可造成不同程度的骨骼肌功能受损[1]。骨骼肌具有显著的再生能力[2],其再生能力依赖于损伤后有效的卫星细胞(satellite cells,SCs)扩增、分化以产生能够重建受损纤维的成肌细胞,以及自我更新补充肌肉干细胞库,应对随后的损伤和修复。但在一些重大肌肉损伤或肌肉相关疾病中,SCs 代偿能力有限,骨骼肌损伤修复过程难以为继。现有治疗方法主要针对骨骼肌损伤时坏死、炎症、再生以及纤维化的病理过程进行对症治疗,如注射生长因子疗法、远红外线温热疗法以及中医按摩与针刺等[3],这些方法虽然能够缓解患者的痛苦,但常导致肌纤维沉积和瘢痕组织的形成,疗效不尽人意。近年来,以肌肉干细胞为基础的移植疗法取得飞速发展,并在临床前研究中展现确切的疗效。然而,供体肌肉干细胞的稀缺以及体外培养体系的欠缺仍然是限制肌肉损伤相关疾病细胞疗法的主要瓶颈因素。本文着眼于肌肉干细胞移植的多个环节,综述归纳了人肌源性肌肉干细胞的来源、分析影响其体外扩增的因素及优化手段,以期为肌肉损伤干细胞疗法的研究提供参考。
1 肌肉干细胞移植疗法的理论基础及局限性
骨骼肌纤维受损影响其结构和功能,导致肌肉收缩功能受限,疼痛和再损伤概率也大大增加。骨骼肌损伤按照发生机制可分为疲劳性肌肉损伤、神经源性肌肉损害、大体积肌肉缺失(volumetric muscle loss,VML)、撕裂伤和钝挫伤[3]。
骨骼肌损伤后的修复过程可分为炎症期、修复期和组织塑形期[4]。炎症期为骨骼肌损伤的前3 d,此阶段损伤部位组织肿胀,肌纤维发生坏死和降解,大量中性粒细胞和巨噬细胞浸润,众多炎症介质参与受损部位炎症反应;组织修复期,此阶段位于肌纤维肌膜和基底膜之间处于静止状态的SCs激活并离开基板,不对称分裂产生Pax7+Myf5-卫星细胞和MyoD+成肌细胞[2],Pax7+Myf5-卫星细胞进一步补充“干细胞池”,而MyoD+成肌细胞在肌生成素作用下增殖分化,相互融合或与受损肌纤维融合以重建肌纤维的完整性和功能;组织重塑期为肌肉损伤后2周~2月,此阶段成纤维细胞分泌大量细胞外基质蛋白,损伤部位骨骼肌纤维化。骨骼肌纤维化及瘢痕组织机化促进损伤愈合,但纤维组织过度增殖则造成肌肉收缩功能受限。骨骼肌修复的3 个时期顺序发生,但又相互交织,紧密联系(图1)。SCs能够与损伤肌纤维融合的特性为基于肌肉干细胞的细胞移植疗法提供了理论基础。
小鼠实验表明,SCs 可以被分离,能在供体小鼠肌纤维中有效定植并恢复SCs的生态位,仅移植900个SCs就可以改善杜氏肌萎缩症(Duchenne muscular dystrophy,DMD)和老龄小鼠的肌肉功能[4-5],这些研究为SCs 提供了明确的临床前疗效证据。然而,DMD患者的早期SCs移植,尤其是在体外扩增分化形成的成肌细胞,并不能表达足够的肌营养不良蛋白,对患者肌肉力量的恢复作用微乎其微[6]。后续研究[7]表明,临床试验失败的原因在于细胞移植后存活率较低,迁移到供体组织的能力有限。虽然新鲜分离的SCs可以原位移植和自我更新并提供新的肌核来源,但当SCs 在体外培养时,这种能力迅速丧失[2]。此外,肌肉的再生潜力还受到自体SCs缺乏和同种异体细胞免疫排斥的影响[7]。因此,供体来源的稀缺和体外稳定自我更新体系的缺乏是目前肌肉干细胞移植疗法临床应用亟待突破的瓶颈。
2 损伤肌肉细胞移植疗法的细胞来源
骨骼肌受损后在一定程度上可以再生,但恢复的速度较慢。目前在骨创外科临床医学和生物学研究中,依然在寻求能够促进骨骼肌再生和功能恢复的治疗方法。临床上骨骼肌损伤后处理遵循“PEACE & LOVE”原则——P:protect 保护,E:elevate 抬高,A:avoid 避免使用抗炎类药,C:compress 压迫,E:educate 患者教育;L:load 负荷,O:optimism 乐观,V:vascularisation 血管功能性活动,E:exercise 锻炼[8]。但这些方法无法重建适当的细胞和分子微环境,导致骨骼肌功能恢复不完全。干细胞具有自我复制能力和多向分化潜能,通过干细胞移植增强肌肉细胞再生的方法为肌肉相关疾病的治疗带来了希望(图2)。
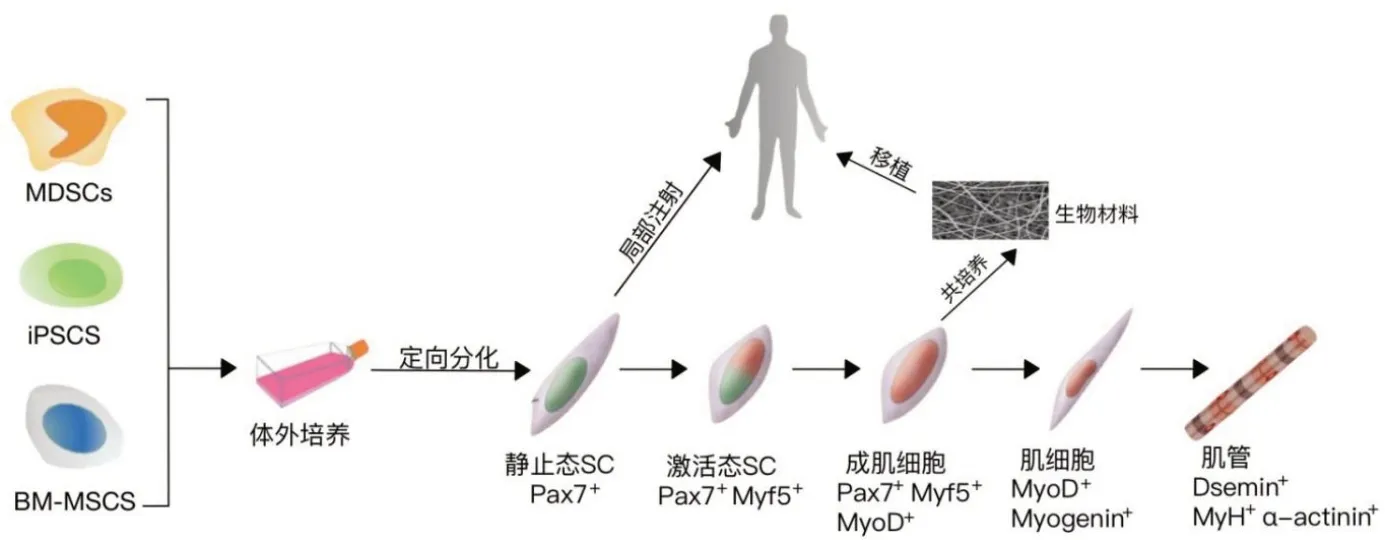
图2 肌肉干细胞修复损伤策略示意图
2.1 卫星细胞
卫星细胞(SCs)是第一个被作为治疗肌肉营养不良的候选细胞类型。SCs 正常情况下处于静止状态,在肌肉损伤或疾病等应激条件下被激活。SCs被激活后离开基板并上调MyoD、Pax7和Myf5 的表达,生成用于肌肉再生的成肌细胞[9]。SCs 在肌肉再生中起着至关重要的作用,将SCs肌肉注射到DMD动物模型中,其与宿主细胞融合形成新的或杂交肌纤维,从而恢复抗肌萎缩蛋白的表达[6]。对DMD 患者而言,移植基因矫正的自体SCs 是减少宿主对供体细胞免疫排斥的理想方法。在一项I/IIa期临床试验中,对12例眼-咽部肌萎缩症患者自健处肌肉提取自体成肌细胞,于上咽部肌肉的12~20 个不同部位实施注射,每人平均注射1.78亿个自体成肌细胞,注射后患者的吞咽功能和生活质量均有明显改善[10]。
将一块正常的肌肉移植到DMD 患者萎缩肌肉周围,移植部位肌肉收缩特性几乎恢复正常[11]。但由于难以克服组织间神经再支配和血运重建及伦理问题,这种治疗方法难以深入临床。VanDusen 等[12]使用低血清含量的肌肉生长培养基培养SCs,细胞最终形成无支架的三维功能性骨骼肌单元,并在大鼠VML模型中进行实验,与未接受治疗时相比,植入骨骼肌单元后大鼠肌肉收缩张力显著增强。基于SCs的骨骼肌组织工程发展领域广阔,但骨骼肌中SCs稀缺,难以分离及纯化,且在培养过程中易失去再生特性,在血液系统传送时无肌肉归巢能力[13]。为克服以SCs 为基础的细胞移植治疗的局限性,研究人员开发了其他具有肌源性分化潜能的干细胞群,用于细胞移植以缓解创伤或疾病引起的肌肉损伤和损失。
2.2 肌源性干细胞
肌源性干细胞(muscle derived stem cells,MDSCs)是成人骨骼肌内高度未分化的多能干细胞,属于SCs上游细胞,具有肌肉生成及造血潜能。与成肌细胞相比,肌源性干细胞具有较高的增殖和体外自我更新能力,在体外连续扩增30代后仍保持肌肉生成潜能[14];且具备多能性和免疫赦免特性,能够显著提高干细胞移植效果。
MDSCs局部肌肉注射或静脉注射于mdx小鼠中,可见表达抗肌萎缩蛋白的肌纤维与部分肌肉融合,且抗肌萎缩蛋白阳性肌纤维数量是注射用SCs的10倍[15]。DMD是累及全身骨骼肌的肌肉疾病,与局部肌肉注射相比,经循环注射有利于移植细胞分布于更多肌肉组织,为全身性肌肉疾病的治疗提供了更有效的方法[16]。Klimczak 等[17]开展的一项临床研究中,将体外培养的正常MDSCs 高密度注射于一名DMD 患者,并结合使用他克莫司进行免疫抑制,移植后18个月仍能检测到供体来源的抗肌萎缩蛋白的表达。
2.3 间充质干细胞
间充质干细胞(mesenchymal stromal cells,MSCs)是来源于人体中胚层的一类成体多能干细胞,广泛存在于骨髓、胎盘、脂肪组织、骨骼肌、皮肤、牙髓和外周血等组织中[18]。其中骨髓是最早发现的,也是最主要的MSCs来源。MSCs可表达和分泌一系列调控免疫炎症反应与血管生成及影响细胞存活、增殖和迁移的生物活性物质[19],使其具有抗炎组织修复等功能,因此在细胞治疗及再生医学等领域具有宽广的应用前景。
目前MSCs 在体外与SCs 共培养时并不与肌纤维发生融合,而是通过旁分泌方式释放多种生物活性因子刺激SCs分化,也可以作用于SCs 生态位其他细胞以减少炎症介质浸润[19]。其中从脂肪组织中分离出来的脂肪来源的间充质干细胞(adipose derived mesenchymal stem cells,ADSCs)被认为是组织再生中最有前途的干细胞群之一[6]。且ADSCs 具有取材容易、增殖能力强、适宜大规模培养及自体移植等优点。Rodriguez等[20]首次对ADSCs用于体内骨骼肌再生进行了报道,发现移植至假肥大型肌营养不良小鼠骨骼肌的ADSCs能够恢复抗肌萎缩蛋白的表达,改善肌肉萎缩状况。
2.4 人多能干细胞
人多能干细胞(human pluripotent stem cells,hPSCs)包括人类胚胎干细胞(human embryonic stem cells,hESCs)和诱导多能干细胞(induced pluripotent stem cells,iPSCs)。hPSCs自我更新能力强,具有多向分化潜能。导入特定外源基因使体细胞去分化、重编程产生的胚胎干细胞样iPSCs,具有hPSCs的特性。其中体细胞可来源于皮肤活检获得的成纤维细胞或从尿液中获得的肾上皮细胞[21]。应用患者来源的iPSCs 及衍生细胞,在临床层面提供个性化的再生治疗方案,可避免移植排斥反应的发生。基于iPSCs的骨骼肌再生策略包括直接移植iPSCs衍生的肌源性祖细胞和体外工程骨骼肌构建[22]。Filareto 等[23]将iPSCs 制成细胞单层薄片移植到mdx小鼠的肌肉中,采用免疫组织化学联合放射自显影术观察肌萎缩蛋白表达情况,结果表明iPSCs植入mdx小鼠成功,在体内逐渐分化为成熟的表达肌萎缩蛋白的肌细胞。
运用小分子化合物调控iPSCs 向骨骼肌分化的相关信号通路,可优化iPSCs 定向分化方案,诱导骨骼肌细胞生成并融合成多核肌管,分化形成人类骨骼肌类器官[24]。近年来,利用小分子化合物获取肌肉干细胞的研究取得阶段性进展。其中最具里程碑意义的是Chal等[25]工作,该实验室基于发育过程中肌发生的表达模式,使用成分明确的小分子化合物及细胞因子,实现了多能干细胞向肌肉祖细胞的定向分化。该方案首先将多能干细胞诱导为体节中胚层细胞,再诱导为Pax3阳性的肌肉祖细胞,MyoD 阳性的成肌细胞,最终可以富集大量肌纤维和Pax7阳性的肌肉干细胞[26]。开发和优化生成iPSCs 及其衍生细胞的标准化方案,将进一步推进iPSCs的临床应用。
3 肌肉干细胞体外扩增培养体系
SCs 成肌分化潜力高,但体外有效扩增方法缺乏。研究发现[2],调节SCs维持静止状态的关键因素包括肌肉发育相关的信号通路、培养器皿的基质刚度、干细胞生态位成分等;多种信号通路协调SCs招募、增殖和分化,外在的信号级联以及内在的转录因子指导干细胞的自我更新和新肌纤维产生[27]。目前研究以维持SCs静止态为目标,通过改进培养基的生物化学及物理特性,以获得足够数量和质量的SCs用于肌肉修复再生[28]。
3.1 生物化学因素
SCs 通常处于静止状态,特征性表达转录因子Pax7,维持自我更新。传统的培养方法易导致SCs细胞Pax7表达丢失、自发分化、衰老及再生潜能丧失,细胞无法长期维持干性[29]。多种信号通路被证实在调节SCs静止和激活状态的平衡中发挥重要作用[30]。因此,在培养基中添加靶向控制肌源性分化信号通路的小分子化合物以维持SCs不成熟状态,并增强其移植后的自我更新能力。如受体酪氨酸激酶抑制剂CEP-701,通过抑制SCs 中的RET 信号,在纳摩尔范围内即可增加体外培养的SCs数量并增强其肌肉移植潜力[31]。
3.1.1 p38 MARK 信号通路调节成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFR)酪氨酸激酶在协调细胞外信号与SCs 内部调控网络中起着重要作用。SCs 表达FGFR1和FGFR4,其中,FGFR1阻止细胞终末分化。FGFR1激活的胞内信号包括调节SCs增殖和不对称分裂的细胞外信号调节激酶和p38α/β MAPK 信号通路[32],p38α/β MAPK 信号通路介导SCs 从静止状态到增殖状态的转变,以及体内的肌源性分化。
p38 MAPK 抑制剂可以通过抑制p38 MAPK 信号来降低MyoD转录因子的活性。研究[32]发现,使用p38 MAPK小分子抑制剂(如SB202190、SB203580和SB706504)可以显著提高SCs在体外的扩增能力。体内移植实验中,这些稳定扩增的SCs可以补充内源的干细胞池,单次移植即可修复多轮的肌肉再损伤,并促进肌力的恢复[33-34]。Arjona等[35]研究发现,组蛋白去乙酰化酶6 抑制剂TubA 抑制细胞周期中促进细胞分化信号基因的表达,基因集合富集分析发现,实验组Cdk1、Plk4和p38 MAPK表达水平较对照组下降,经TubA处理的SCs在体外维持静止状态,并提高体内移植能力。
3.1.2 Notch 信号通路调节Notch 信号是多种组织干细胞的调节因子,肌SCs生态位中的Notch信号调节SCs的增殖、分化和自我更新[36]。Notch 信号通路的激活是由Delta 型、Jagged 型配体家族与Notch跨膜受体结合启动的,其结果是Notch受体裂解释放胞内结构域(Notch intracellular domain,NICD),NICD在特定酶作用下从胞质移位到细胞核进而激活转录因子CSL,引起靶基因表达[36]。
Notch 信号通过诱导细胞外成分的表达及抑制分化以维持SCs的静止状态。研究[37]发现,在Notch信号的调控下,静止状态的SCs高表达miRNA-708,miRNA-708通过靶向黏着斑相关蛋白转录来拮抗细胞迁移,从而调节细胞静止和自我更新。此外,Notch信号诱导SCs分泌V型胶原蛋白,增强细胞间黏附及塑造细胞外基质生态位微环境,调节SCs静止状态[26]。
3.1.3 蛋白激酶PKCθ调节SCs 可进行对称或不对称分裂,分裂方式受Par 极性蛋白复合物(Par3/Par6/aPKC)的定位、生态位微环境及纺锤体定位的影响[38]。蛋白激酶Cθ(protein kinase C theta,PKCθ)属于PKCs 家族,是一种丝氨酸和苏氨酸激酶,调节SCs 增殖与分化。在PKCθ缺失情况下,Pard3 极性蛋白的定位发生改变,促进SCs进行对称分裂及自我更新。例如,在疾病的晚期,缺乏PKCθ的mdx小鼠SCs活性仍较高,能够促进肌肉的损伤修复[39]。Benedetti 等[40]在SCs 培养基中添加PKCθ的抑制剂C20,可显著增加Pax7+/MyoD-细胞比例,即促进肌肉干细胞的自我更新而减少其定向分化。
3.2 物理因素
细胞外培养体系是一个复杂的结构,受基质刚度、体外培养气相、细胞外基质组成成分等影响。基质刚度影响细胞增殖、分化等生理活性,基质弹性是培养中SCs命运的强力调节因子。常用的刚性塑料培养皿限制干细胞扩增,与刚性基质(约106 kPa)不同,软水凝胶基质的硬度类似于肌肉组织弹性(12 kPa),不仅提高SCs体外培养存活率,还可广泛促进肌肉再生[41]。Madl 等[42]利用新研发的光反应水凝胶基质系统,证实细胞外基质的力学属性以及基质刚度对SCs生物学行为具有重要影响。细胞外基质由胶原蛋白、纤维连接蛋白和层黏连蛋白等组成,提供支持SCs增殖及自我更新的组织结构。层黏连蛋白为SCs 生态位的关键组成部分,研究发现添加重组层黏连蛋白-E8 的培养基不仅支持小鼠和人SCs 的扩增,且提高其移植潜力[43]。此外,培养皿温度也是影响细胞增殖分化的重要因素。冰冷处理方案(ice-cold treatment,ICT)可用于细胞传代,且不损害SCs 增殖和分化潜力,还可获得足够数量和质量的SCs。Benedetti 等[44]利用ICT 分离纯化SCs,即将铺满细胞的培养皿在冰上处理15~30 min,SCs纯度提高至95%~100%。
氧张力也是干细胞生态位的一个重要特性。不同组织部位氧张力不同,造血干细胞生态位为1%~6%,间充质干细胞生态位为2%~8%,而肾髓质和骨髓部位氧含量仅为1%。大多数培养皿氧含量与大气氧含量(20%)相同,而实际上组织内部氧含量要低得多,通常是2%~9%。细胞长期处于20%的氧含量环境可导致DNA损伤和细胞凋亡,而低氧已被证明可以防止有氧代谢引起的氧化应激。Duguez等[45]发现,与使用5%氧气浓度培养的SCs 相比,20%氧浓度导致SCs 来源的成肌细胞增殖减弱,其机制在于高氧导致线粒体的过度激活。Liu等[46]的研究表明,进一步降低培养皿氧含量(至1%)可提高静止状态的成肌细胞比例,减少分化,促进自我更新。
4 问题和展望
肌肉损伤在日常生活及军事训练中发生率高,目前临床治疗以对症和支持治疗为主,干细胞移植疗法为患者带来新的希望。SCs 作为肌肉再生的主要贡献者,获取足够数量的未分化人肌源性祖细胞并有效的扩增是该疗法应用于临床的关键。干细胞成肌分化是多种信号通路交互作用的复杂过程,除利用小分子化合物外,培养基的物理特性对维持SCs处于静止状态也至关重要。骨骼肌的再生还需要适当的康复运动,结合慢跑或高强度的间歇康复训练,可以促进再生肌肉周围血管化和神经支配,减少生物材料移植后的纤维化。
尽管干细胞疗法似乎是骨骼肌损伤的理想治疗方法,但仍存在着伦理和移植后免疫排斥等诸多问题。肌损伤治疗过程复杂,需要生物学、材料科学和医学等多方面研究汇聚,形成一套系统性的治疗方案,用于临床试验及研究。骨骼肌组织工程的进一步发展将可能为骨骼肌功能丧失的患者带来新的治疗选择。

