利用传感器技术探究高铁酸钾分解净水原理
周兴璐
(无锡市藕塘中学,江苏 无锡 214000)
K2FeO4是一种氧化性极强的氧化剂,比高中阶段常见的KMnO4、O3、Cl2等氧化剂的氧化能力还强[1].作为氧化剂,它具有活性强、选择性高等特点,同时其还原产物为Fe(OH)3,对环境无害,可以吸附水中杂质,所以它是一种集氧化、杀菌、吸附、絮凝等功能为一体的新型高效多功能净水剂,因而备受人们关注.正因如此,近年来,以高铁酸钾为背景的高考试题频频出现,现行的高中化学教材中对高铁酸钾的性质没有加以介绍,也没有相关的净水演示实验,遇到以上问题,学生对K2FeO4分解净水原理认识不清.因此,本文希望基于传感器技术,通过数字化实验,能够简便、快捷、准确地探究出影响高铁酸钾分解净水原理的相关因素,并得到其净水的最佳反应条件,使课堂演示高铁酸钾分解净水实验成为可能.
1 实验部分
1.1 实验设计思路
K2FeO4在水溶液中分解, 其离子方程式为:
4Fe(OH)3↓+8OH-+3O2↑
本实验利用溶解氧传感器对高铁酸钾分解净水原理进行探究[2].通过手持数字传感器技术实时进行实验数据采集并处理,让学生观察到高铁酸钾在净水过程中的分解进程.通过定量测定反应过程中溶解氧含量变化,分析浓度、温度、催化剂、溶液酸碱性等条件对分解净水效率的影响,并得到高铁酸钾净水的最佳条件.
1.2 实验装置
实验装置如图1所示.

图1 实验装置示意图
1.3 实验探究
1.3.1浓度大小对高铁酸钾分解反应的影响
实验1:用移液枪量取20 mL蒸馏水于小烧杯中,按图1所示连接好装置,打开计算机相关软件,点击“开始”采集数据.待数据稳定后,用电子天平分别称取质量为0.02 g、0.04 g、0.08 g K2FeO4固体加入其中,配成1 000、2 000、4 000 mg/L三种不同浓度的高铁酸钾溶液进行实验,得到溶解氧含量变化曲线(如图2所示),并用红色激光笔照射.
由图2曲线可知,不同浓度的高铁酸钾溶液,其分解速率不同.高铁酸钾浓度越大,分解产生的O2越多.表明浓度越大,高铁酸钾溶液分解速率越快,越容易生产O2.根据勒夏特列原理,反应物浓度大,有利于平衡正向移动,使溶液中溶解氧含量增多.
由实验可知,不同浓度的高铁酸钾溶液分解后得到的氢氧化铁微粒状态有所不同.浓度越大,生成的氢氧化铁越多,易形成沉淀;浓度较小时,生成氢氧化铁含量较少,易形成氢氧化铁胶体,有利于溶液中杂质沉降.因此,适当浓度的高铁酸钾溶液,有利于形成氢氧化铁胶体,提高净水效率.
1.3.2高铁酸钾分解过程中温度和酸碱性变化
实验2:称取质量为0.04 g的K2FeO4固体于含20 mL蒸馏水的小烧杯中,同时连接溶解氧、温度、pH传感器,得到溶解氧含量、温度、pH变化情况,如图3所示.
如图3所示,在反应过程中,溶液中的溶解氧含量不断增加,溶液碱性不断增强,而溶液温度却变化不大.说明在整个反应过程中分解的高铁酸钾不多,并且由于溶剂水的含量较多,比热容大,使得温度变化不明显,但溶解氧传感和pH传感器的器灵敏度比温度传感器的灵度大得多,因此可以检测出溶液中溶解氧含量和酸碱性变化,但检测不出溶液温度变化.
1.3.3溶液酸碱性对高铁酸钾分解反应的影响
实验3:向蒸馏水中加入少量KOH或浓硫酸,用pH传感器检测溶液pH,分别制成pH为5、7、11的水溶液.
实验4:用移液枪分别量取20 mL不同pH的水溶液于小烧杯中,同时连接溶解氧传感器,另称取三份质量均为0.04 g的K2FeO4固体于小烧杯中,得到溶解氧含量变化曲线,如图4所示.

图4 不同pH对高铁酸钾分解净水过程的影响
由图4可知,在不同pH水溶液中高铁酸钾的稳定性不同,碱性越强,高铁酸钾溶液越稳定,碱性越弱,高铁酸钾越容易分解.这是因为高铁酸钾在水溶液中分解成O2和OH-,在碱性条件下,生成物氢氧根浓度增大,根据勒夏特列原理,有利于平衡逆向移动,抑制高铁酸钾分解;而在弱碱性条件下,氢离子浓度相对较大,消耗生成的氢氧根使其浓度减小,有利于平衡正向移动,促进高铁酸钾分解.因此,高铁酸钾更适用于酸性或中性条件下的污水处理.
1.3.4存放时间对高铁酸钾分解反应的影响
实验5:用移液枪量取20 mL蒸馏水于小烧杯中,用电子天平分别称取三份质量为0.04 g的K2FeO4固体加到小烧杯中,放置不同时间,观察实验现象.
由实验可知,高铁酸钾溶液在长期存放过程中,高铁酸钾会不断地分解,时间越长分解得越多,浓度越小,所以高铁酸钾溶液不能长期保存,否则会影响净水效果.
1.3.5温度对高铁酸钾分解反应的影响
实验6:用移液枪分别量取20 mL蒸馏水于小烧杯中,同时连接溶解氧传感器,再分别加入质量为0.04 g的K2FeO4固体,在不同反应温度条件下(20 ℃,50 ℃, 80 ℃)得到溶解氧含量变化曲线,如图5所示.

图5 不同温度对高铁酸钾分解净水过程的影响
由图5曲线可知,在不同温度条件下,高铁酸钾的稳定性不同.溶液中的含氧量随着温度的升高而增大,即表明温度越高,高铁酸钾越容易分解生产O2,自身越不稳定.由于升高温度可以提高单位体积内的活化分子数,加快反应速率,因此适当升温,有利于提高净水效率.
1.3.6催化剂种类对高铁酸钾分解反应的影响
实验7:用移液枪量取20 mL蒸馏水于小烧杯中,再分别加入0.04 g的氯化铁、硝酸铁固体配成溶液,同时连接溶解氧传感器,再加入质量为0.04 g的K2FeO4固体,在不同催化剂条件下得到溶解氧含量变化曲线,如图6所示.
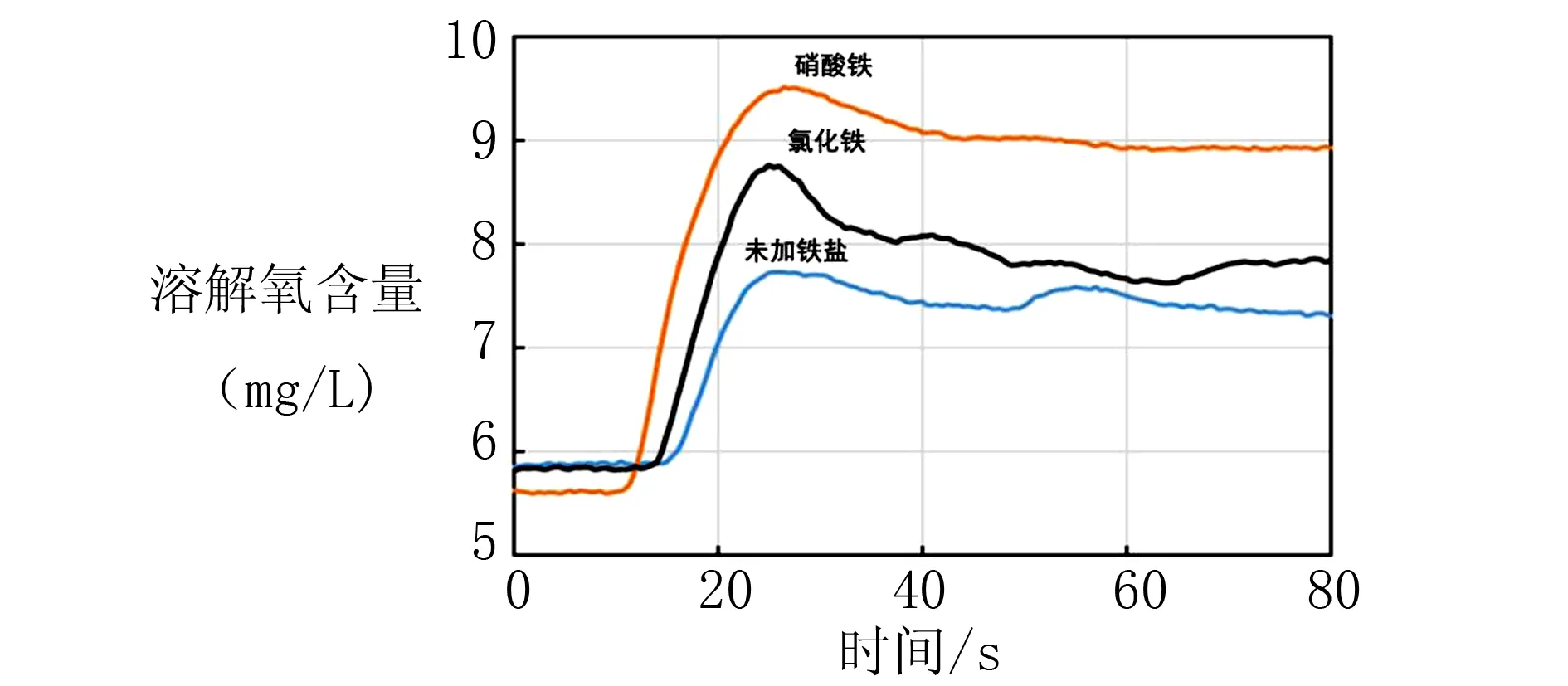
图6 不同催化剂下高铁酸钾分解净水过程的影响
由图6中溶解氧含量曲线变化可知,加入铁盐之后,高铁酸钾的分解速率均有了不同程度的提高,说明两种铁盐均能催化高铁酸钾分解.其原理可能是因为Fe3+与K2FeO4发生了氧化还原反应生成了不稳定的中间体,然而这些中间体又极不稳定迅速分解成Fe3+,最终促进K2FeO4的分解[3].但是,不同的铁盐对高铁酸钾的催化作用不同,说明铁盐中的阴离子对高铁酸钾溶液的稳定性也有一定影响.
1.4 实验结论
根据以上实验探究,可以得出高铁酸钾分解净水演示实验最佳条件为: 取20 mL污水溶液于小烧杯中,连接溶解氧传感器和pH传感器,再加入0.04 g高铁酸钾固体进行实验,一段时间后倾倒出上层清液,观察实验现象.在泥水中加入高铁酸钾后的烧杯底部沉降杂质较多,净水效果显著.
2 实验反思
2.1 实验装置简洁化
该分解净水实验只需要一个小烧杯、溶解氧传感器、pH感器及其他相关实验设备,不需要复杂的实验装置,实验操作方便、快捷.
2.2 实验条件简单化
设计的高铁酸钾分解净水实验,是在探讨了相关影响因素之后,选择的最佳反应条件.条件控制简单,实验现象明显,有很好的演示效果,可以随时进行实验.
2.3 检验手段简明化
利用数字化传感器技术,首先,可以很灵敏地检测出溶液中的溶解氧含量、氢氧化铁含量和溶液酸碱性的微量变化,大大节约了实验时间,有利于在课堂进行演示实验;其次,在实验分析过程中,实现了由现象为主体的定性分析向数据为主导的定量研究转变,启发学生思考,有利于提升课堂教学效果.

