通心络胶囊调控转化生长因子-β1表达改善糖尿病心肌病大鼠心肌纤维化损伤机制研究
闫文瑞,张常喜,张晓晋,张亚平,张雄慧
(1.宁夏医科大学中医学院,宁夏 银川 750001;2.宁夏中医医院暨中医研究院肺病科,宁夏 银川 750021;3.甘肃中医药大学中医学院,甘肃 兰州 730020)
糖尿病(Diabetic mellitus,DM)的发病率及致死率逐年上升,其临床主要表现为代谢紊乱,受饮食、运动及压力多方面影响,血糖常常控制不佳,随病程发展病变逐渐累及机体各系统及器官。糖尿病心肌病(Diabetic cardiomyopathy,DCM)是糖尿病心血管慢性并发症之一,在疾病晚期极易进展为不可逆的心肌纤维化病变,且高血糖持续时间与心肌纤维化程度呈正相关[1]。DCM表现为心肌灌注和功能障碍,属于特殊心肌病,长期高血糖和胰岛素抵抗可引起心肌能量代谢异常、心肌纤维化、左心室肥厚、冠状动脉功能和舒张障碍等[2-3]。心肌间质和血管周围的纤维化是DCM的主要病理特征。心肌纤维化作为心脏重塑的一种明显结构特征,表现为间质细胞过度增殖,胶原纤维在心肌组织结构中过量积聚,各型胶原成分发生改变、比例失衡等[4]。研究表明,心肌纤维化与糖尿病的住院率及病死率相关[5],因此寻找心肌纤维化新的治疗靶点具有重要意义。近年来研究表明,DCM的发生发展与转化生长因子-β1(Transforming growth factor-β1,TGF-β1)的异常表达和活化密切相关[6-7]。糖尿病患者长期高血糖及代谢紊乱均可刺激TGF-β1分泌,TGF-β1可促进心肌成纤维细胞Ⅰ型、Ⅲ型胶原分泌,诱导心肌纤维化[8]。因此,抑制TGF-β1活化对于改善心肌纤维化程度有重要作用。“大凡经主气,络主血,久病血瘀”,消渴病基础病机为气阴两虚,久病必入血络;消渴缠绵不愈转归心肌病变与络病病变相符。中药复方制剂通心络胶囊蕴含着中医学“络病”理论,其治则核心重在营卫,营卫不通,血凝不流;亦如《难经》云:“损其心者,调其营卫”。通心络胶囊具有益气活血、通络止痛之效。众多临床研究表明通心络胶囊在临床治疗DCM具有延缓病情进展、改善心功能的作用[9-10]。本研究观察通心络胶囊对DCM大鼠心肌纤维化的作用,以期为中医药防治DM心肌纤维化提供新的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:雄性SPF级SD大鼠共48只,6~8周龄,体重为(200±20)g,均购于宁夏医科大学实验动物中心,许可证编号:SCXK宁2020-0001。大鼠饲养于温度(25±1)℃、湿度50%的标准通风环境,普通饲料适应性喂养1周。本实验由宁夏医科大学动物实验伦理委员会审核批准(伦理编号IACUC-NYLAC-2020-039)。
1.1.2 实验药物与试剂:通心络胶囊(批号Z19980015);缬沙坦胶囊(批号H20040217)。链脲佐菌素(美国Sigma公司);HE染色试剂盒、Masson三色染色试剂盒(批号G1120、G1340,北京Solarbio公司);TGF-β1抗体(批号A2124,武汉ABclonal公司);TGF-β1 ELISA试剂盒(批号ml002856V,上海酶联生物);封闭用羊血清工作液、通用二步法试剂盒、DAB显色试剂盒(批号ZLI-9056、PV-9000、ZLI-9017,北京中杉金桥生物技术有限公司);普通饲料及高脂饲料(北京博爱港生物技术有限公司)。
1.1.3 主要实验仪器:正置显微镜(型号DM3000,德国徕卡);生物组织石蜡包埋机(型号YB-6LF,湖北亚光);切片机(型号RM2245,德国徕卡);电热恒温培养箱(武汉一恒苏净科学仪器有限公司);离心机(型号TG16W,长沙湘智离心机仪器有限公司);冷冻离心机(上海卢湘仪离心机仪器有限公司);酶标仪(深圳Rayto公司);电泳仪、电泳槽、转膜仪(美国伯乐公司)。
1.2 实验方法
1.2.1 大鼠分组与模型制备:按照随机数字表法将48只SD大鼠分为对照组、模型组、缬沙坦组及通心络高、中、低剂量组,每组8只。模型组、缬沙坦组及通心络高、中、低剂量组构建DCM模型:适应性喂养结束后禁食12 h开始实验,高糖高脂饲料喂养,以链脲佐菌素 30 mg/kg一次性腹腔注射建立DCM模型。2周后使用罗氏血糖仪检测大鼠血糖水平,随机尾静脉血浆葡萄糖浓度>16.7 mmol/L,且出现多饮、多食、多尿症状,认为糖尿病模型造模成功。继续造模处理至第8周,筛选符合实验标准的大鼠。以普通饲料喂养对照组大鼠,并与模型组等量一次性腹腔注射枸橼酸盐缓冲液。
1.2.2 给药:造模成功后,根据人与大鼠之间用药剂量换算公式计算给药剂量。缬沙坦组大鼠予缬沙坦胶囊(30 mg/kg),通心络低、中、高剂量组大鼠分别给予0.25、0.5、1.0 g/kg通心络,对照组和模型组大鼠予等体积0.9%氯化钠溶液,各组均连续干预4周。在实验周期12周内未发现大鼠酮症酸中毒表现者。
1.2.3 大鼠一般情况:实验期间密切观察并记录大鼠摄食、饮水、排尿排便及精神状态等情况,及时监测大鼠体重及血糖值变化。
1.2.4 大鼠心肌组织HE染色:干预结束后,大鼠禁食不禁水12 h,给予10%乌拉坦0.4 ml/kg腹腔注射进行麻醉,沿胸骨正中线打开胸腔,取出完整心脏组织,剪取大鼠左心室作为标本,心脏组织脱水、石蜡包埋、切片脱蜡后,进行苏木素、伊红染色,最后脱水并使用中性树脂封片,置于通风橱内晾干,光镜下观察心肌组织病理形态并采集图片。
1.2.5 大鼠心肌组织Masson染色:剪取大鼠部分左心室组织,脱水、石蜡包埋、切片脱蜡后,进行Weigert铁苏木素染色液染色,盐酸酒精分化,自来水冲洗,经丽春红酸性品红、磷钼酸、苯胺蓝及冰醋酸染色处理,最后脱水并使用中性树脂封片,置于通风橱内晾干,光镜下观察心肌组织病理形态改变并采集图片,利用Image J软件计算心肌胶原体积分数(CVF)。CVF=单视野内胶原面积/心肌总面积×100%。
1.2.6 免疫组化法检测心肌组织TGF-β1表达:心肌组织脱水,石蜡包埋,切片脱蜡,水浴锅高温抗原修复,滴加阻断剂10 min,PBS冲洗,用羊血清工作液室温血清封闭40 min,滴加兔抗TGF-β1抗体(1∶1000)湿盒4 ℃孵育过夜,次日,PBS冲洗,滴反应增强液20 min,PBS冲洗,加入酶标二抗在室温下孵育20 min,PBS冲洗,现配DAB可视化显色,镜下控制反应时间1~2 min。最后进行常规脱水、透明、封片。切片置于玻片扫描仪中,每个切片随机选取1个视野区域进行分析,应用Image J软件计算平均光密度值(AOD)。
1.2.7 酶联免疫吸附测定法检测心肌组织TGF-β1表达:心肌组织置于4 ℃ 0.9%氯化钠溶液中匀浆处理后,使用ELISA试剂盒检测TGF-β1浓度,所有操作均按照试剂盒提供的操作说明书进行。
1.2.8 蛋白印迹法检测心肌组织TGF-β1表达:通过RIPA试剂盒提取组织总蛋白,BCA试剂盒定量各组蛋白,每组使用相等的蛋白上样量在SDS-PAGE浓缩胶上样孔中进行点样并电泳分离,通过湿转膜法将分离的蛋白转移至PVDF膜上,5%脱脂牛奶封闭2 h,一抗4 ℃孵育过夜,通过TBST缓冲液清洗PVDF膜,二抗孵育2 h,ECL显色液显影。
1.3 统计学方法 采用Graphpad Prism 9统计学软件进行数据分析。计量资料以均数±标准差形式表示,两组间数据比较采用非配对t检验,两组以上数据比较采用单因素方差分析,多重比较采用Tukey或Bonferroni的多重比较检验;P<0.05表示差异有统计学意义。
2 结 果
2.1 各组大鼠一般情况比较 共计48只大鼠成功建立DCM模型。对照组大鼠未出现多饮、多食、小便增多、体重减轻等情况,精神状态好,活动自如;模型组大鼠出现多饮、多食、小便增多、体重减轻等,精神状态差;阳性药物缬沙坦组及通心络低、中、高剂量组在灌胃期间上述症状较模型组均有不同程度改善。
2.2 各组大鼠心肌组织HE染色 各组大鼠心肌组织HE染色见图1。对照组大鼠心肌组织排列整齐,心肌结构清晰,细胞核清晰,心肌间隙清晰可见,横纹明显;模型组心肌排列紊乱、增粗,组织肿胀,炎性细胞浸润明显;通心络低、中、高剂量组和缬沙坦组心肌组织排列较模型组整齐,炎性浸润减少,组织间隙无明显水肿。

图1 各组大鼠心肌组织病理改变(HE染色,×200)
2.3 各组大鼠心肌组织Masson染色 对照组大鼠心肌组织细胞排列整齐,细胞间质有少量蓝色胶原纤维,胶原纤维着色淡;模型组大鼠心肌组织细胞排列紊乱且胶原纤维蓝染,蓝色胶原在视野中组织占比大;通心络低、中、高剂量组以及缬沙坦组胶原纤维蓝染较模型组均明显减少,阳性面积占比均减少,且通心络高剂量组阳性面积明显少于缬沙坦组。见表1(图2)。

表1 各组大鼠心肌组织CVF比较(%)

图2 各组大鼠心肌组织病理改变(Masson染色,×200)
2.4 免疫组化染色检测各组大鼠心肌组织TGF-β1表达 对照组心肌细胞间质有少量的棕黄色胶原纤维,无明显特异性染色;模型组大鼠心肌纤维化明显,阳性面积表达范围扩大,TGF-β1蛋白表达明显增强,细胞核及间质内均有强表达;通心络低、中、高剂量组及缬沙坦组较模型组染色范围均缩小,纤维化程度低,阳性面积表达及TGF-β1蛋白表达均有较明显的减弱。见表2(图3)。
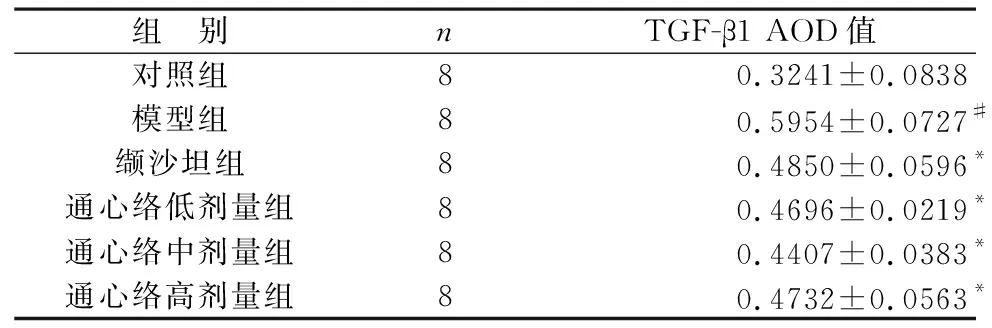
表2 各组大鼠心肌组织TGF-β1的AOD值比较(%)

图3 各组大鼠心肌组织TGF-β1蛋白表达(免疫组化染色,×200)
2.5 酶联免疫吸附测定法检测各组大鼠心肌组织TGF-β1表达 见表3。与空白组比较,模型组TGF-β1蛋白表达升高(P<0.05);与模型组比较,通心络低、中、高剂量组及缬沙坦组TGF-β1蛋白表达显著降低,差异有统计学意义(均P<0.05)。

表3 各组大鼠心肌组织TGF-β1表达比较(ng/ml)
2.6 蛋白印迹法检测各组大鼠心肌组织TGF-β1表达 见表4(图4)。相较于对照组,模型组TGF-β1蛋白表达显著增高(P<0.05);与模型组相比,通心络低、中、高剂量组TGF-β1蛋白表达明显降低,差异有统计学意义(均P<0.05);表明不同浓度的通心络胶囊对心肌组织TGF-β1表达有明显的调控作用。
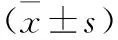
表4 各组大鼠心肌组织TGF-β1表达比较
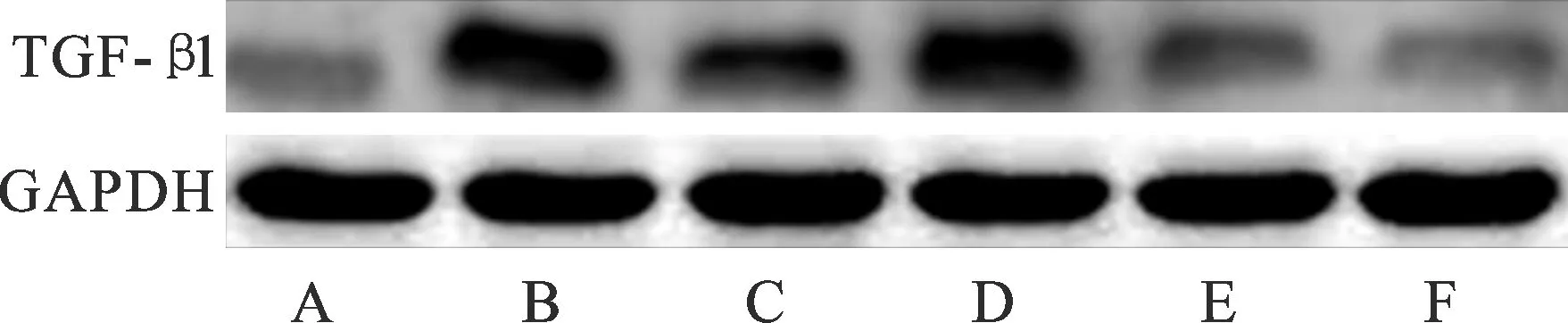
A:对照组;B:模型组;C:缬沙坦组;D:通心络低剂量组;E:通心络中剂量组;F:通心络高剂量组
3 讨 论
目前,全球的糖尿病患病人数逐年增加,DCM的发病率也逐年上升[11]。目前研究发现,DCM的发病与心肌细胞的结构和功能改变相关[12]。糖尿病代谢紊乱直接影响心肌细胞及心脏成纤维细胞,改变心肌细胞功能和胶原在心脏间质中沉积,由此心肌顺应性和舒缩功能下降,心肌结构发生实质性改变[13]。在高糖状态下,多种代谢途径被激活且相互作用,冠状动脉微循环灌注不足,心肌细胞肥大、凋亡,心肌纤维化,心脏舒缩功能受损障碍,最终导致心力衰竭,危及患者生命[14]。DCM生理病理机制包括全身代谢紊乱、肾素-血管紧张素-醛固酮系统激活不当、亚细胞成分异常、氧化应激、炎症反应和免疫调节功能失调,复杂的生理病理改变最终导致DCM的心脏结构改变,共同作用于心脏重塑[15]。DCM心脏结构重塑包括间质和血管周围纤维化和结缔组织胶原沉积,还包括心肌细胞坏死、肌肉原纤维逐渐消失、反应性心室肥厚、小冠状动脉增厚硬化等。长期高血糖刺激与心肌纤维化发展紧密相关[16]。当前DCM研究主要集中于抑制心肌成纤维细胞过度增殖、细胞外基质(ECM)过度沉积,调节胶原降解与合成失衡[17]。TGF-β1被认为是介导各器官组织纤维化的关键因子[18-19]。TGF-β1在心脏中主要存在于心肌细胞及心肌纤维细胞中,是调节心肌肥厚最重要细胞因子之一,同时也是胶原纤维产生及其他细胞外成分合成、沉积的始动因子。TGF-β1在心血管系统具有多种病理生理作用,可调节细胞增殖、分化,启动心肌成纤维细胞的转化和增生,抑制细胞外基质降解酶的活性,促使胶原蛋白异常表达性增高,导致细胞外基质降解与合成失衡,最终引发心肌纤维改变[20]。心脏组织TGF-β1表达水平显著上升与心室重塑有密切联系,提示其可作为早期诊断糖尿病心肌病变的依据之一[21]。TGF-β1可通过激活基于Smads和非Smads信号通路诱导纤维化,导致肌成纤维细胞激活及ECM的过量合成和抑制[22]。研究表明,在糖尿病心肌组织中TGF-β1及其受体蛋白表达量显著增加,TGF-β1激活后引起心肌纤维化,并激活下游Samd蛋白诱导DCM[23]。高糖环境下,TGF-β1被大量活化,ECM降解与合成失衡,致使心肌纤维化,因此阻断TGF-β1信号通路可延缓心肌纤维化进程[24]。
目前临床上治疗DCM多为药物治疗,如ACEI类和ARB类药物等,在一定程度可减轻临床症状,但长期用药易出现胃肠道刺激、高血钾、低血压、肝功能损伤等,且长期治疗极易药物耐受,一旦停止用药,可能会再次发病甚至加重病情[25]。在中医传统理论指导下,中医药可以多成分、多途径、多靶点的在防治DCM方面发挥独特优势[26]。DCM归属于中医“消渴心病”等范畴,其病位主要在心[27]。如《伤寒论》云:“消渴,气上撞心,心中痛热”,认为其在“消渴”的基础继发出现“心病”之症。DCM的病程进展与消渴病的进展紧密联系。中医认为,糖尿病心肌病多由过食肥甘厚腻、禀赋不足及情志所伤而致,痰浊、瘀血是疾病发展的产物,阴虚为本贯穿始终,“虚”和“瘀”为主要病机特点,早期气阴两虚、心脉不和,治疗以补气阴为主;中期发展为痰瘀互结,注重祛痰化瘀;消渴日久,迁延不愈,终致气血阴阳俱虚,以滋阴温阳为主。在疾病发展过程中气阴两虚、络脉空虚是本病发生的始动因素,而络脉瘀阻是本病形成的病理基础。通心络胶囊由人参、虫、水蛭、蜈蚣、蝉蜕、赤芍、全蝎、冰片组成。研究显示,通心络胶囊干预DCM可抑制心肌纤维化,改善心肌病理损伤[28]。通心络中主要成分人参皂苷Rg1、人参皂苷Rb1、芍药苷等具有抗纤维化作用[29]。人参皂苷Rb1和芍药苷可以通过TGF-β1/Smad等信号通路抑制多器官组织间质细胞纤维化[30],这可能是通心络抑制心肌纤维化的有效物质基础。
本研究通过2%STZ一次性腹腔注射构造DCM大鼠模型,Masson染色显示DCM模型组大鼠胶原沉积较对照组明显增多,DCM模型组大鼠心脏组织中TGF-β1表达显著增高,且心脏出现纤维化病理改变,心肌纤维断裂,排列结构紊乱,心肌细胞间质胶原纤维沉积,给予通心络胶囊治疗后可不同程度缓解心肌纤维化损伤,心脏组织中TGF-β1表达降低。综上所述,通心络胶囊可能通过抑制TGF-β1蛋白的表达改善DCM大鼠心肌纤维化和心肌结构紊乱。

