血浆微RNA-191、微RNA-23a和微RNA-145表达水平与前列腺癌患者预后的相关性
王 坤,朱海松,李 军
(驻马店市中心医院泌尿外一科,河南 驻马店 463000)
前列腺癌为男性泌尿系统常见恶性肿瘤,前列腺癌根治性手术是其主要治疗手段,但术后也可因癌灶复发、转移等导致治疗失败,故积极探索提示前列腺癌预后的相关标志物尤为重要[1-3]。随着分子生物学技术的不断发展,临床对微小核糖核酸的研究更加深入,这为肿瘤标志物的发现提供新思路,微RNA(microRNA,miRNA)为18~26个碱基大小的非编码单链RNA,是靶基因的关键调控分子,通过调控肿瘤细胞的多种生物学过程参与前列腺癌的发生和发展[4]。既往有研究发现,miR-191在前列腺癌组织中表达上调[5],但其在前列腺癌发生、发展及预后中的作用尚需进一步研究来验证。有研究发现,小分子RNA干扰p21激活性激酶6(p21-activated kinase 6,PAK6)可使前列腺癌细胞迁移能力减弱,PAK6为miR-23a的直接靶基因,miR-23a可能会引起前列腺癌细胞迁移能力下降[6]。miR-145在多种肿瘤中呈低表达,可抑制肿瘤细胞增殖、转移及侵袭,促进肿瘤细胞凋亡[7]。基于此,本研究探讨血浆miR-191、miR-23a和miR-145在前列腺癌患者中的表达情况,并分析其与疾病预后的关系,旨在为前列腺癌临床诊治提供参考。
1 资料与方法
1.1 一般资料
选择2019年12月至2021年12月驻马店市中心医院收治的60例前列腺癌患者为观察组。病例纳入标准:(1)经病理组织学检查确诊为前列腺癌;(2)患者行前列腺癌根治性手术;(3)临床及随访资料完整;(4)家属及患者签署知情同意书。排除标准:(1)合并其他恶性肿瘤患者;(2)伴有高血压、糖尿病、冠状动脉性心脏病等疾病者;(3)复发性前列腺癌患者;(4)伴有感染性疾病者;(5)近1个月内接受激素类药物治疗者。另选择同期健康体检者60例为对照组。对照组:年龄30~79(54.29±10.28)岁,体质量45~83(64.25±7.12)kg;观察组:年龄31~80(55.03±9.68)岁,体质量46~74(63.98±7.30)kg。2组受试者的年龄、体质量比较差异无统计学意义(P>0.05),具有可比性。本研究经医院院伦理委员会审核批准。
1.2 方法
1.2.1 资料收集
收集观察组患者的年龄、体质量指数(body mass index,BMI)、吸烟史、饮酒史、TNM分期、前列腺体积、病理组织学分级Gleason评分、血清前列腺特异抗原(prostate-specific antigen,PSA)水平等临床资料。
1.2.2 荧光定量聚合酶链式反应(polymerase chain reaction,PCR)法检测所有受试者血浆miR-191、miR-23a和miR-145表达水平
分别于前列腺癌患者术前、术后7 d采集静脉血5 mL,另外采集健康体检者空腹静脉血5 mL,留置于乙二胺四乙酸抗凝管中,3 500 r·min-1离心10 min(离心半径8 cm),离心后吸取上层血浆。取400 μL 血浆,参照mirVanaTMPARISTM miRNA试剂盒(上海嵘崴达实业有限公司)说明书,提取血浆中总RNA,使用NanoDrop 2000/2000c分光光度计(上海赛默飞世尔科技有限公司)测定RNA纯度及浓度;根据RNA反转录试剂盒(上海晶风生物科技有限公司)说明书进行反转录;使用ABI 7500型实时荧光定量PCR扩增仪(上海佐明机械设备贸易有限公司),使用SYBR Green荧光染料PCR试剂盒(德国Qiagen公司)进行荧光定量PCR检测。 miR-191上游引物序列为5′-CTGGACAGCGGGCAACGGAAT-3′,下游引物序列为5′-CTCGCTTCGGCAGCACATATACT-3′;miR-23a上游引物序列为5′-GCCGCGGGGTTCCTGGGGAT-3′,下游引物序列为5′-GTGCAGGGTCCGAGGT-3′;miR-145上游引物序列为5′-GTCCAGTTTTCCCAGG-3′,下游引物序列为5′-CACCATACCACTCCAGAT-3′。扩增反应条件:95 ℃预变性15 min,94 ℃变性20 s,64 ℃退火30 s,72 ℃延伸34 s,共40个循环。根据2-△△Ct计算血浆中miR-191、miR-23a 和miR-145的相对表达量。
1.3 观察指标
(1)比较对照组与观察组受试者血浆miR-191、miR-23a和miR-145表达水平。(2)比较观察组患者治疗前后血浆miR-191、miR-23a和miR-145表达水平。(3)观察组患者的预后:患者术后随访6~30个月,根据是否发生骨转移、复发将患者分为预后不良组(n=11)和预后良好组(n=49)。分析不同预后患者的临床特征及血浆miR-191、miR-23a和miR-145表达水平。(4)分析血浆miR-191、miR-23a和miR-145与前列腺癌患者预后的关系。(5)分析血浆miR-191、miR-23a和miR-145对前列腺癌患者预后的预测价值。
1.4 统计学处理
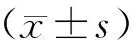
2 结果
2.1 对照组与观察组受试者血浆miR-191、miR-23a 和miR-145相对表达量比较
观察组患者血浆miR-191、miR-23a相对表达量显著高于对照组,miR-145相对表达量显著低于对照组,差异有统计学意义(P<0.05);结果见表1。
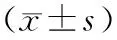
表1 对照组与观察组受试者血浆miR-191、miR-23a和miR-145相对表达量比较Tab.1 Comparison of relative expressions of miR-191,miR-23a,and miR-145 in plasma of subjects between the control group and the observation group
2.2 观察组患者治疗前后血浆miR-191、miR-23a和miR-145相对表达量比较
观察组患者治疗后血浆miR-191、miR-23a相对表达量显著低于治疗前,miR-145相对表达量显著高于治疗前,差异有统计学意义(P<0.05);结果见表2。
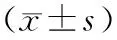
表2 观察组患者治疗前后血浆miR-191、miR-23a和miR-145相对表达量比较Tab.2 Comparison of relative expressions of miR-191,miR-23a,and miR-145 in plasma of patients in theobservation group before and after treatment
2.3 不同预后前列腺癌患者一般资料比较
预后不良组与预后良好组患者的年龄、BMI、吸烟史、饮酒史、前列腺体积比较差异无统计学意义(P>0.05);2组患者的TNM分期、Gleason评分、血清PSA水平及血浆miR-191、miR-23a、miR-145相对表达量比较差异有统计学意义(P<0.05)。结果见表3。
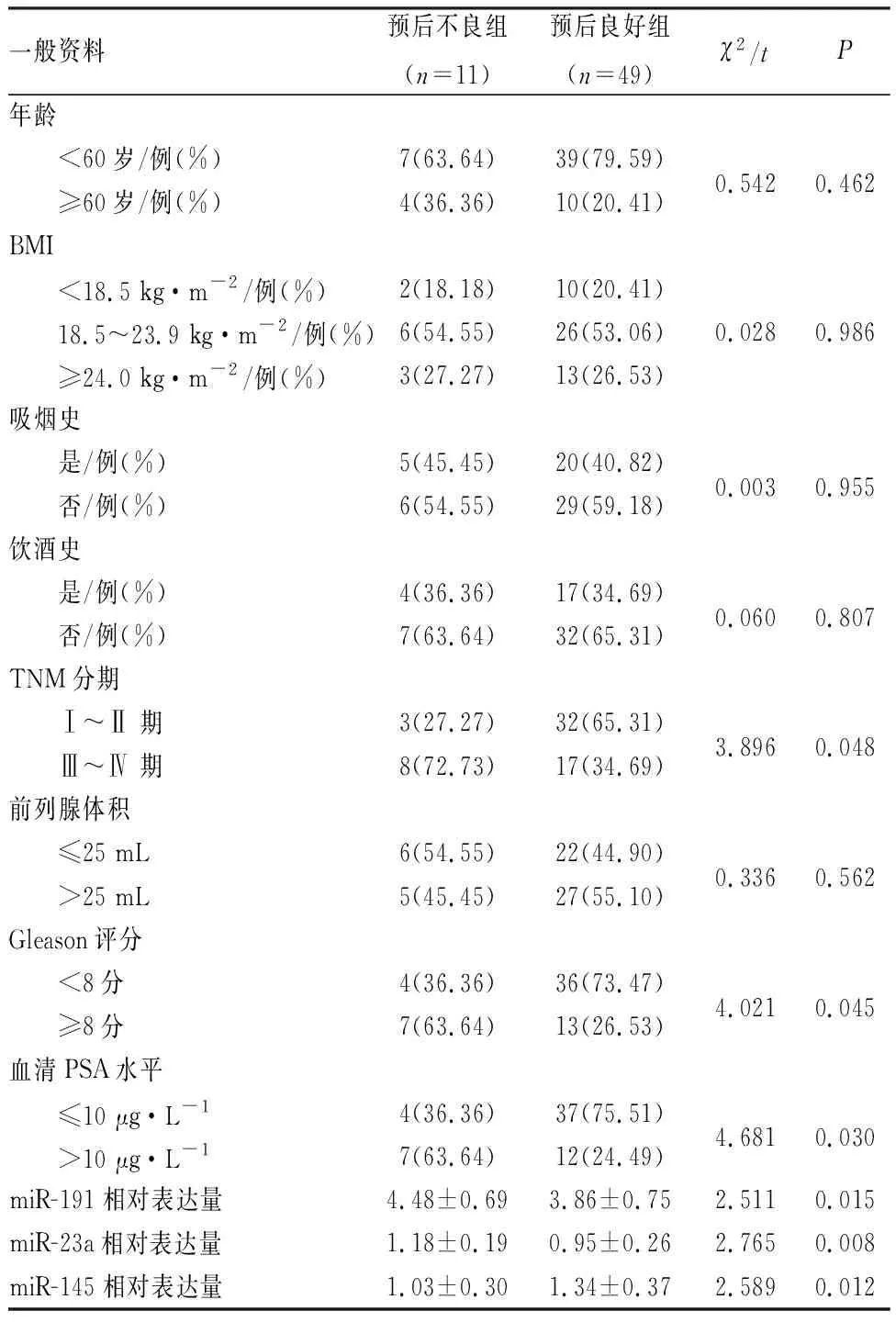
表3 不同预后前列腺癌患者临床资料比较Tab.3 Comparison of clinical data of prostate cancer patients with different prognosis
2.4 血浆miR-191、miR-23a和miR-145水平与前列腺癌患者预后的关系
将一般资料比较中差异有统计学意义的指标进一步行COX回归分析,结果显示,血浆miR-191、miR-23a和miR-145水平为前列腺癌患者预后的影响因素(P<0.05),见表4。
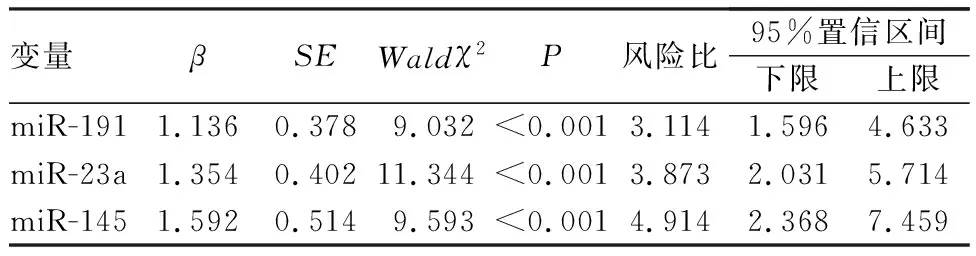
表4 血浆miR-191、miR-23a和miR-145水平与前列腺癌患者预后的关系Tab.4 Relationship between plasma miR-191,miR-23a,and miR-145 levels and prognosis of prostate cancer patients
2.5 血浆miR-191、miR-23a和miR-145对前列腺癌患者预后的预测价值
ROC曲线结果显示,血浆miR-191、miR-23a、miR-145均对前列腺癌患者预后有一定预测价值,三者联合预测前列腺癌患者预后的总体价值高于血浆miR-191、miR-23a、miR-145单独预测的价值(P<0.05);结果见图1和表5。
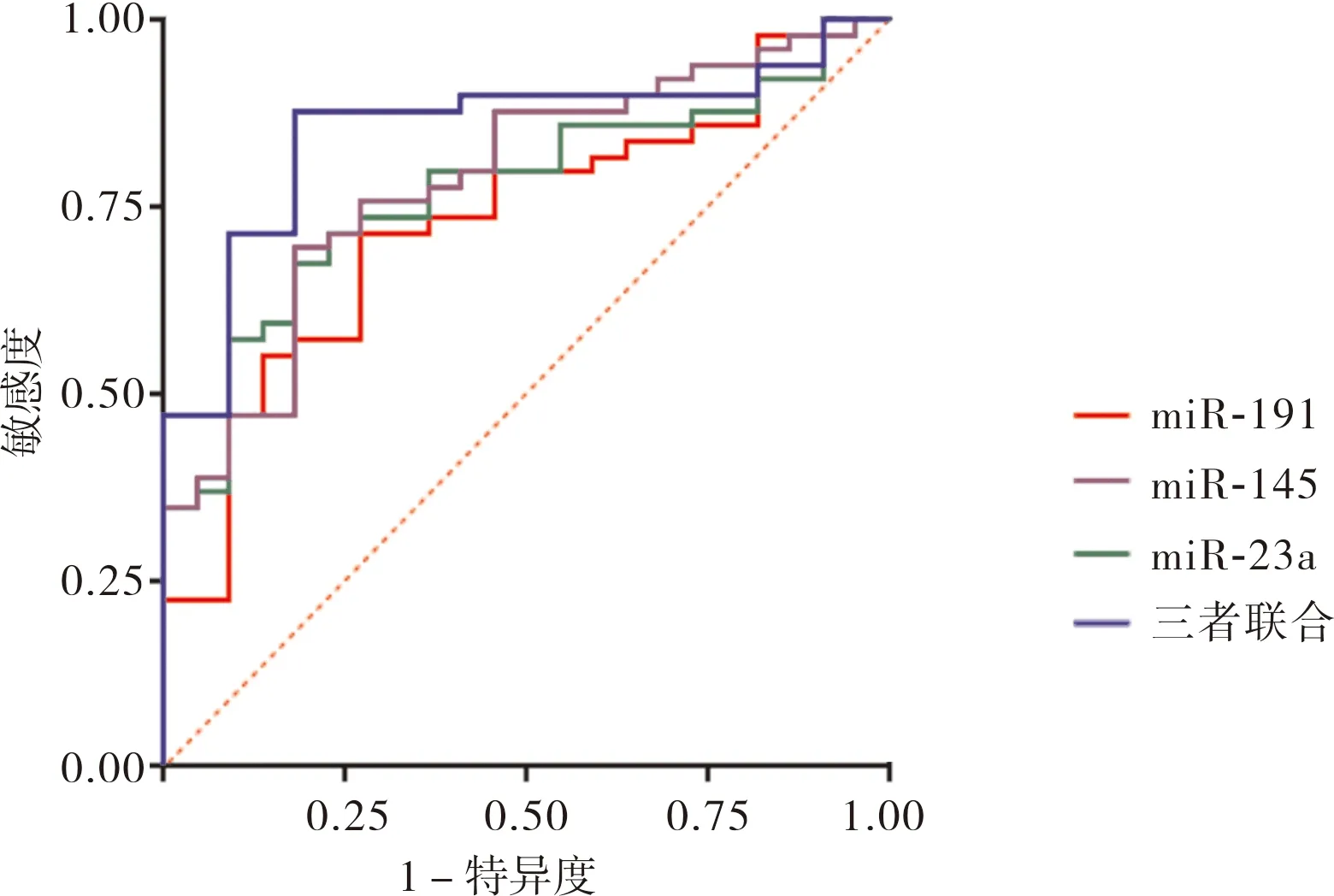
图1 血浆miR-191、miR-23a和miR-145水平预测前列腺癌患者预后的ROC曲线Fig.1 ROC curve of plasma miR-191,miR-23a,and miR-145 levels predicting prognosis of prostate cancer patients
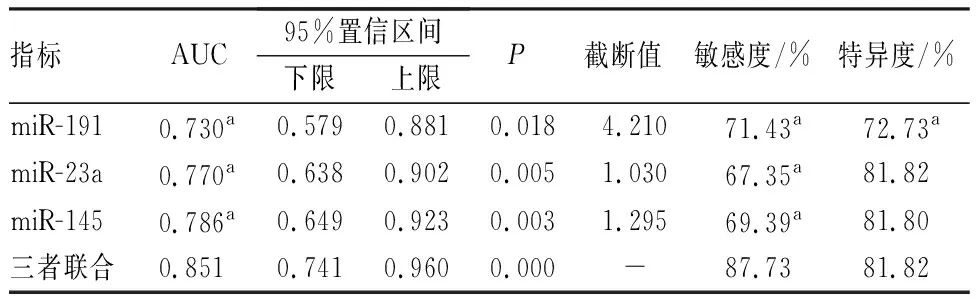
表5 血浆miR-191、miR-23a和miR-145水平对前列腺癌患者预后的预测价值Tab.5 Predictive value of plasma miR-191,miR-23a,and miR-145 levels for the prognosis of prostate cancer patients
3 讨论
前列腺癌为男性生殖系统常见恶性肿瘤,在我国恶性肿瘤发病率中位居第6位,以排尿异常、盆腔不适、勃起障碍等为主要临床表现,且近年来逐渐趋于年轻化,对男性健康造成严重影响[8-10]。现阶段临床对前列腺癌病理生理机制仍缺乏统一认识,预后判断存在迟滞性,不利于临床防治。国际上主要将PSA>4 μg·L-1视为前列腺癌筛查指标,但PSA值处于4~10 μg·L-1时临床难以对前列腺病变良恶性及预后做出有效评估[11-12]。故寻找新的前列腺癌预后的标志物,对指导临床实施针对性预防措施、改善疾病预后具有积极意义。
自从MITCHELL等[13]研究证实血浆中miRNA可作为前列腺癌诊断标志物后,辅助肿瘤诊断相关的新型循环miRNA标志物不断涌现。血浆中的miRNA性质较为稳定,-80 ℃ 和室温下反复冻融或100 ℃煮沸10 min等条件下,其血浆表达水平仍基本不变。有研究发现,miR-191在除乳腺癌以外的肿瘤组织中表达均呈上调趋势[14-15]。本研究结果显示,与对照组相比,观察组患者血浆miR-191表达水平显著升高,行前列腺癌根治术后其表达水平降低,提示miR-191可能参与前列腺癌的发生和发展。miR-191是促分裂原活化蛋白激酶信号通路等肿瘤相关通路的调节剂,体外实验表明,抑制miR-191表达能够阻碍肿瘤细胞增殖并介导其凋亡[16]。张冲等[17]研究结果也显示,前列腺癌细胞中miR-191-5p表达呈升高趋势,敲低miR-191-5p表达可抑制前列腺癌细胞的增殖,并促进其凋亡。在前列腺癌病理生理中,促癌基因一旦被激活,可导致癌细胞增殖增加、凋亡减少,促使疾病恶性病变及进展,影响疾病预后[18]。本研究中ROC曲线结果显示,血浆miR-191预测前列腺癌患者预后的敏感度高达71.43%,血浆miR-191对前列腺癌患者预后不良的最佳截断值为4.210,当前列腺癌患者血浆miR-191>4.210时,则可提示发生预后不良风险较大。
miR-23a为miR-23的亚型,可借助对N-乙酰氨基糖基转移酶Ⅲ基因的靶向作用来调控细胞糖代谢[19]。在多种恶性肿瘤中miR-23a呈高表达,发挥着原癌基因作用[20-21]。有研究发现,胃腺癌中miR-23a表达水平上调,miR-23a可抑制白细胞介素-6受体表达,促进胃腺癌细胞系MGC803生长,从而提升胃癌细胞增殖能力[22]。胡鑫等[23]研究发现,miR-23a在肺癌患者中表达水平上调。本研究结果显示,观察组患者血浆miR-23a表达水平显著高于对照组,提示miR-23a在前列腺癌中呈高表达,同上述研究结果一致。有研究发现,miR-23a在弥漫性大B细胞淋巴瘤中表达明显上调,是潜在的诊断和判断预后的生物标志物[24]。本研究结果发现,前列腺癌患者治疗后血浆miR-23a表达水平显著降低,血浆miR-23a为前列腺癌患者预后影响因素,miR-23a高表达可能增加前列腺癌患者预后不良风险,血浆miR-23a预测预后的AUC为0.770、特异度高达81.82%;提示,miR-23a可能参与前列腺癌的病理生理过程,对预后具有一定预测价值。且有研究显示,miR-23a可通过PAK6-含LIM模体的蛋白激酶-cofilin信号通路,对前列腺癌细胞骨架的重构产生影响,参与前列腺癌的发生和发展[25]。
大量研究发现,miR-145在多种肿瘤中呈低表达,主要通过与多个靶基因的作用,对肿瘤细胞的生物学特性进行抑制[26-27]。本研究结果显示,观察组患者血浆miR-145表达水平低于对照组;说明,血浆miR-145在前列腺癌患者中呈低表达。有学者运用miRNA芯片技术检测前列腺癌组织中miRNA表达水平,结果发现,miR-145呈低度表达[28],并借助实时荧光定量PCR验证了这一结果,与本研究论点一致。因此,推测miR-145不仅在前列腺癌患者血浆中呈低表达,还可能与前列腺癌手术治疗患者的疗效及预后密切相关。由本研究结果可知,治疗后前列腺癌患者血浆miR-145表达水平显著升高,是前列腺癌患者预后的保护因素,miR-145相对表达量<1.295时,患者预后不良风险增加;说明,miR-145在前列腺癌发生中可能发挥抑癌基因作用,可作为临床预测前列腺癌预后的有效辅助手段。同时有研究证实,miR-145能通过靶向调控残疾基因同源物2来影响高侵袭前列腺癌细胞的迁移和侵袭能力[29]。由于miR-145调控机制较为复杂,现阶段尚未发现特定靶基因,潜在靶目标可能包含参与蛋白质转录翻译基因、参与信号传导途径等基因,但miR-145在前列腺癌中的调控机制尚需进一步探究。
4 结论
前列腺癌患者血浆miR-191、miR-23a表达升高,血浆miR-145表达降低,血浆miR-191、miR-23a、miR-145联合检测对前列腺癌预后具有较高的预测价值。但本研究亦存在一定不足,如研究时期较短、样本量较小等,今后需展开长期、大样本研究来进一步验证该结论。

