激活突变引发SHP2蛋白相分离对小鼠间充质干细胞增殖能力的影响及其机制
刘 嘉,戴媛娟,汪思应
SHP2是由PTPN11基因编码的非受体型酪氨酸磷酸酶,PTPN11的激活突变与多种肿瘤的发生密切相关,除了非小细胞性肺癌[1]、乳腺癌[2]、血液系统肿瘤[3]等常见肿瘤外,在人类的横纹肌肉瘤(rhabdomyosarcoma,RMS)中也发现了PTPN11的激活突变[4]。肉瘤是一种复杂的间叶肿瘤,其发生的潜在分子机制仍未完全明了,其中大部分原因是对其细胞起源缺乏共识,但现在越来越多的证据表明它们来源间充质干细胞(mesenchymal stem cell, MSC)[5]。与此同时,相分离作为一种与肿瘤发生相关的机制被越来越多地提及,它是指生物体内的大分子物质之间由于多价相互作用而聚集在一起,形成生物分子冷凝物的现象[6]。有研究[7]提示激活突变的SHP2蛋白会在细胞内形成大量的生物分子冷凝物,然而激活突变SHP2蛋白的相分离与人类横纹肌肉瘤的发生之间的联系还有待探究。该研究构建SHP2E76K突变的小鼠模型,探究激活突变引发的SHP2蛋白相分离对小鼠MSC增殖能力的影响及其机制,以期为肉瘤的诊断和治疗寻找新的作用靶点。
1 材料与方法
1.1 材料
1.1.1实验动物 本研究所用Ptpn11E76K-neo/+小鼠(C57BL/6J品系),由美国埃默里大学血液/肿瘤系的瞿成奎教授赠予, Mx1-cre(C57BL/6J品系)小鼠购自上海南方模式生物研究中心,于安徽医科大学基础医学院动物实验中心SPF级环境中饲养。本研究对照组小鼠为Mx1-cre; Ptpn11+/+(C57BL/6J品系),实验组小鼠为Mx1-cre; Ptpn11E76K/+(C57BL/6J品系)。该研究的动物实验均经安徽医科大学动物伦理委员会批准(批准号:LLSC20210807)。
1.1.2主要试剂 琼脂糖粉末购自北京兰杰柯科技有限公司;鼠尾鉴定聚合酶链式反应(polymerase chain reaction,PCR)试剂盒购自成都福际生物技术有限公司;胎牛血清购自美国普诺赛公司;高糖DMEM细胞培养基、低糖DMEM细胞培养基均购自美国Gibico公司;细胞培养皿、细胞计数板均购自美国康宁公司;SHP2抗体、p-ERK抗体、ERK抗体、p-AMPK抗体、AMPK抗体、p-mTOR 抗体、m-TOR抗体均购自美国CST公司;β-actin抗体购自美国Proteintech公司;SHP099购自美国Selleck公司;ET070由中国科学院上海有机化学研究所提供;预染蛋白分子量Marker购自美国赛默飞公司;细胞总蛋白裂解液、CCK-8试剂盒、二甲亚砜、PBS粉末均购自美国Sigma公司。
1.1.3主要仪器 CO2细胞培养箱(德国Eppendorf公司,型号:Galaxy170S);正置显微镜(日本OLYMPUS公司,型号:TMT2-21);倒置显微镜(日本尼康公司,型号:ECLIPSE TS100);细胞计数仪(江苏卓微生物科技有限公司,型号:JIMBIO CL);普通PCR仪(德国Biometra公司,型号:2506261);多功能酶标仪(型号:Varioskan)、低温冷冻离心机(型号:Heraeus Megafuge 16)(美国赛默飞公司);生物安全柜(美国Labconco公司,型号:Type A2); 化学发光凝胶成像仪(美国 BIO-RAD公司,型号:ChemiDoc MP);电泳仪(德国 Eppendorf公司,型号:Powerpac Basic Power Supply)
1.2 方法
1.2.1小鼠尾部组织基因组DNA的提取 子鼠1周龄时,将小鼠尾部组织剪取长约0.2 cm的小段于1.5 ml EP管中,在EP管中加入50 μl Buffer MP,2 μl Foregene Protease Plus,65 ℃金属浴30 min,然后95 ℃水浴5 min,8 000 r/min离心5 min。
1.2.2PCR扩增反应及琼脂糖凝胶电泳进行的基因型鉴定 小鼠基因型鉴定引物序列: E76KNeo Forward,5′-TGGGAAGACAATAGCAGGCA-3′;E76KNeo Reverse,5′-CCCACTCACCTTGTCATGTA-3′; Mx1-cre Forward,5′-GACCAGGTTCGTTCACTC-3; Mx1-cre Reverse,5′- TAGCGCCGTAAATCAAT-3′。PCR反应体系:2×PCR反应缓冲液10 μl,前引物0.5 μl,后引物0.5 μl,超纯水5 μl,DNA模板4 μl,总体积20 μl。PCR反应程序:E76K扩增反应程序为:① 94 ℃、3 min;② 94 ℃、30 s;③ 55 ℃、30 s;④ 72 ℃、30 s;⑤ 72 ℃、5 min;⑥ 4 ℃保持。②~④为循环反应,循环数为32。Mx1-cre扩增反应程序为:① 94 ℃、3 min;② 94 ℃、30 s;③ 58 ℃、30 s;④ 72 ℃、60 s;⑤ 72 ℃、5 min;⑥ 4 ℃保持。②~④为循环反应,循环数为28。琼脂糖凝胶电泳:琼脂糖1.5 g,5×TAE缓冲液2 ml,双蒸水98 ml,溴化乙啶(EB)5 μl,DNA 样本10 μl,电泳电压90 V,时间40 min,凝胶成像仪成像。
1.2.3Mx1-cre;Ptpn11E76K/+小鼠的获得 取经PCR鉴定的基因型Mx1-cre;Ptpn11E76K/+的小鼠,待其长至4周龄时按照20 μg/只的剂量腹腔注射pI-pC,每隔1 d注射1次,共3次,注射完成后30 d左右即可用于实验。
1.2.4原代骨髓MSC的分离 取基因型为Mx1-cre;Ptpn11+/+和Mx1-cre;Ptpn11E76K/+的雄性小鼠,脱颈处死后放入75%的乙醇中消毒10 min,在生物安全柜内,按照无菌操作原则分离其股骨和胫骨,用PBS清洗,剪去两侧干骺端,用1 ml注射器吸取PBS反复冲洗骨髓腔直至骨髓腔发白为止,收集骨髓冲洗液置于15 ml离心管中;1 000 r/min离心5 min后去上清液,用含10%FBS的低糖DMEM完全培养基吹打沉淀,制成单细胞悬液,以1×105个/ml为密度将细胞接种在大皿中,放入细胞培养箱中培养;2 d后半换液,5 d后全换液,之后每2~3 d换1次液,当细胞长至80%进行传代,传至第3代用于实验。
1.2.5MSC的鉴定 在24孔板中放入细胞爬片,取正在培养的第3代Ptpn11E76K/+和Ptpn11+/+MSC消化后制成单细胞悬液并计数,保持每孔液体体系为0.5 ml,每孔种入2×104个细胞,每组3个复孔,共两组,在37 ℃、5%CO2浓度条件下培养48 h,之后吸弃各孔培养基,加入4%的多聚甲醛固定0.5 h,室温下用10%的山羊血清封闭1 h,用含有1%BSA和0.25% Triton X-100的PBS以200 ∶1的比例稀释一抗(Sca-1),每孔加入200 μl,4 ℃孵育过夜(超过12 h),用上述试剂以1 000 ∶1稀释二抗,每孔加入200 μl,避光条件下在常温孵育1.5 h,用DAPI室温避光染细胞核5 min,滴加抗荧光淬灭剂封片,风干并拍照计数。
1.2.6细胞免疫荧光实验 在24孔板中放入细胞爬片,取正在培养的第3代Ptpn11E76K/+和Ptpn11+/+MSC消化后制成单细胞悬液并计数,每孔种入2×104个细胞,每组3个复孔,共6组;4~6 h后,对照组和实验组分别换上完全培养基和加了相应浓度的分子变构抑制剂(SHP099和ET070的浓度均为20 μmol/L)的培养基,在细胞培养箱中培养48 h,期间每24 h更换相应的培养基;48 h后,吸弃各孔培养基,后续操作参照1.2.5项进行。
1.2.7Western blot实验 消化离心的细胞沉淀用RIPA重悬,置于冰上30 min,每4~5 min振荡3~5 s,在4 ℃条件下以12 000 r/min离心20 min,吸出上清液转移至新1.5 ml EP管;用BCA方法测蛋白浓度并绘制标准曲线;按照5×上样缓冲液体积:蛋白体积为1 ∶4,加入上样缓冲液,99 ℃水浴加热蛋白10 min;制备SDS-PAGE凝胶,根据BCA结果上样后进行电泳和PVDF膜转膜,用5%的脱脂牛奶封闭1 h以上,分别将膜置于稀释好的一抗中,4 ℃条件下孵育过夜,TBST洗膜,室温孵育二抗1 h,洗膜后显影。
1.2.8CCK-8实验 取状态良好的细胞进行离心消化并计数,将细胞悬液调制浓度为1×104/ml,96孔板每孔加入200 μl细胞悬液,每组5个复孔,每板6组,需要4个96孔板(0、24、48、72 h);铺板后4~6 h后实验组和对照组分别换成加变构抑制剂的完全培养基和普通完全培养基,培养至相应时间点后取出检测(0 h的无需继续培养),期间每24 h更换每个孔相应的培养基;当达到相应时间时,取出孔板,在各孔中加入20 μl CCK-8溶液,培养箱中继续孵育2~4 h;孵育结束后,用酶标仪检测其在480 nm处吸光度值。
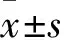
2 结果
2.1 小鼠基因型鉴定结果将工具鼠Mx1-cre与Ptpn11E76K-neo/+的C57BL/6小鼠杂交,得到的小鼠通过基因型鉴定确定得到Mx1-cre;Ptpn11+/+(2、10、15、18、19、21、24、25、26号)和Mx1-cre;Ptpn11E76K/+(3、4、7、9、10号)小鼠。见图1。
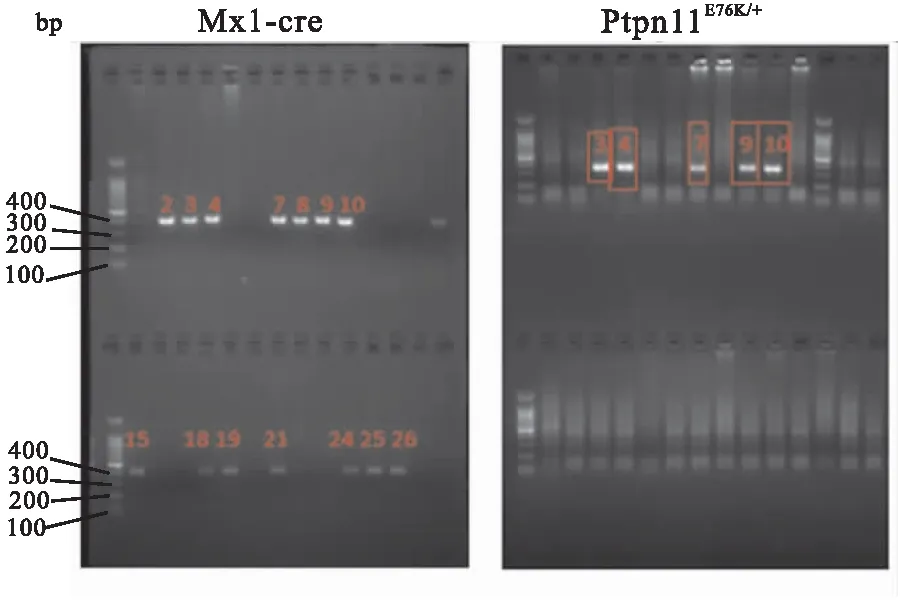
图1 小鼠基因型鉴定结果
2.2 MSC细胞形态及鉴定分离Mx1-cre;Ptpn11+/+和Mx1-cre;Ptpn11E76K/+两种基因型小鼠的MSC并进行体外传代培养,在培养过程中观察到MSC呈集落式贴壁生长,细胞呈梭形,放射状排列,并伸出长短不一粗细不均的突起并且伴随传代数增加,细胞形态趋于统一。见图2A。细胞免疫荧光检测显示,第3代细胞的表面抗原蛋白均表达干细胞表面抗原Sca-1(图2B、C),由此可确定分离所得细胞为MSC。
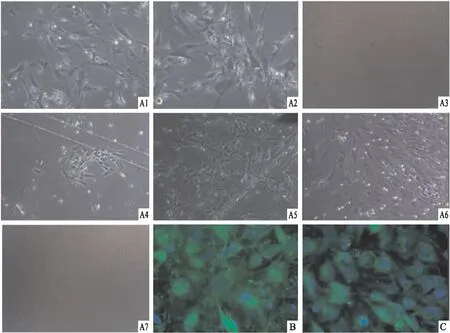
图2 成功分离并培养Ptpn11+/+和Ptpn11E76K/+ MSC
2.3 细胞免疫荧光实验观察变构抑制剂SHP099和ET070对Ptpn11E76K/+激活突变的MSC内的SHP2的相分离现象的影响细胞免疫荧光染色结果显示,与Ptpn11+/+组相比,Ptpn11E76K/+组MSC在显微镜下可观察到更多的SHP2蛋白由相分离而产生的生物分子冷凝物,且两组MSC细胞内形成的冷凝物的数量差异有统计学意义(图3A,t=21.62,P<0.000 1);与Ptpn11E76K/+组相比较,Ptpn11E76K/++SHP099组和Ptpn11E76K/++ET070组的MSC在显微镜下可见的SHP2蛋白由相分离而产生的生物分子冷凝物明显减少,差异有统计学意义(图3B,tSHP099=20.54,tET070=23.88,P<0.000 1)。Western blot实验表明,野生型和突变型MSC以及添加变构抑制剂SHP099和ET070作用之后,细胞内SHP2蛋白本身的表达水平几乎没有差异(图3C)。
图3 免疫荧光检测实验组和对照组SHP2蛋白由于相分离产生的冷凝物液滴数量并且通过Western blot实验检测实验组和对照组SHP2蛋白的表达差异
2.4 MSC中E76K突变的SHP2蛋白的相分离被抑制后干细胞的增殖能力的变化用CCK-8试剂盒检测6个组细胞药物作用后第0、24、48、72 h 4个时间段细胞生长密度及各组各个时间点吸光度值并进行统计分析,如图4所示,实验结果显示,与SHP2E76K突变组相比,SHP2WT组(t=10.36,P<0.01)、SHP2E76K+SHP099组(t=42.31,P<0.001)、SHP2E76K+ET070组(t=32.02,P<0.000 1)细胞的吸光度值均下降,差异有统计学意义。结果提示MSC增殖能力较差。
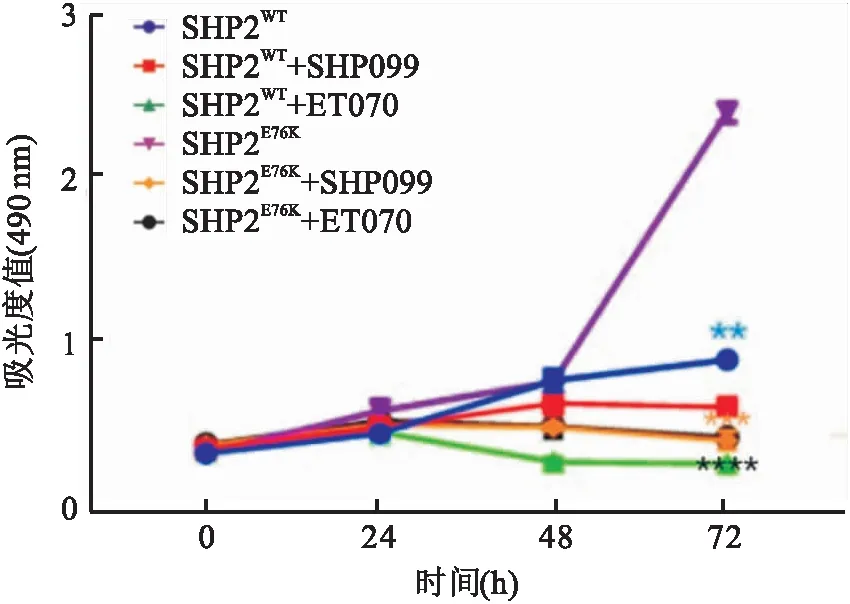
图4 MSC的SHP2发生E76K突变以及相分离被抑制之后细胞增殖能力的变化
2.5 抑制Ptpn11E76K/+突变的MSC中SHP2的相分离之后MSC ERK及AMPK-mTOR信号通路部分相关蛋白活化的改变提取药物处理了48 h的野生型和突变型的MSC的总蛋白,通过Western blot实验检测与细胞增殖和代谢相关的蛋白的表达水平,结果显示:与Ptpn11+/+组相比,Ptpn11+/++SHP099组(t=22.2,P<0.000 1)、Ptpn11+/++ET070组(t=55.8,P<0.000 1)p-ERK蛋白表达减少;与Ptpn11E76K/+组相比,Ptpn11E76K/++SHP099组(t=96.87,P<0.000 1)、Ptpn11E76K/++ET070组(t=41.14,P<0.000 1)p-ERK蛋白表达减少(图5B、C)。此结果提示SHP2相分离被抑制后Ptpn11E76K/+MSC ERK蛋白活化程度降低(图5A)。AMPK-mTOR信号通路相关蛋白表达检测显示:mTOR蛋白、AMPK蛋白的相对表达量在实验组和对照组之间差异无统计学意义(图5E、F)。而p-AMPK蛋白的相对表达统计结果显示:与Ptpn11+/+组相比较,Ptpn11+/++SHP099组(t=4.573,P<0.05)、Ptpn11+/++ET070组(t=10.25,P<0.001)蛋白表达增加;与Ptpn11E76K/+组相比较, Ptpn11E76K/++SHP099组(t=174.3,P<0.000 1)、Ptpn11E76K/++ET070组(t=74.82,P<0.000 1)蛋白表达增加(图5G)。p-mTOR蛋白的相对表达统计结果显示:与Ptpn11+/+组相比,Ptpn11+/++SHP099组(t=46.98,P<0.000 1)、Ptpn11+/++ET070组(t=38.27,P<0.000 1)蛋白表达减少;与Ptpn11E76K/+组相比, Ptpn11E76K/++SHP099组(t=37.39,P<0.000 1)、Ptpn11E76K/++ET070组(t=113.3,P<0.000 1)蛋白表达减少(图5H);p70s6k蛋白的相对表达统计结果显示:与Ptpn11+/+组相比,Ptpn11+/++SHP099组(t=47.00,P<0.000 1)、Ptpn11+/++ET070组(t=19.38,P<0.000 1)蛋白表达减少;与Ptpn11E76K/+组相比,Ptpn11E76K/++SHP099组(t=43.29,P<0.000 1)、Ptpn11E76K/++ET070组(t=49.63,P<0.000 1)蛋白表达减少(图5I)。此结果提示,SHP2相分离被抑制后,Ptpn11E76K/+MSC AMPK蛋白被活化,并且mTOR的磷酸化被抑制,导致下游蛋白p70s6k表达减少(图5D)。
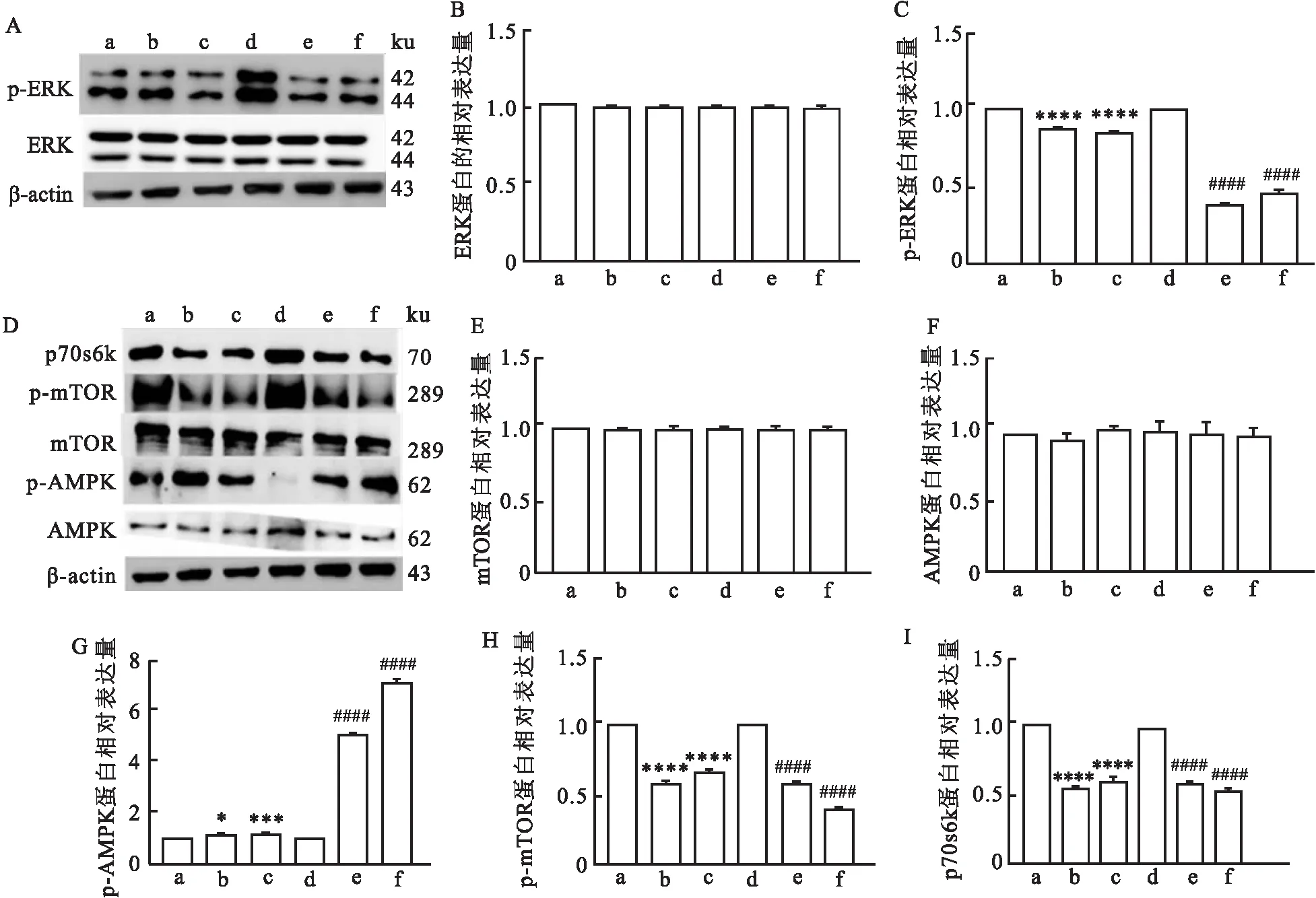
图5 Western blot检测各组MSC细胞总蛋白中ERK通路、AMPK-mTOR通路部分蛋白的表达情况及统计图
3 讨论
据相关报道[4],在横纹肌肉瘤中发现了Ptpn11的激活突变,但其机制尚不清楚。Ptpn11是一种原癌基因,它编码的SHP2蛋白是非受体蛋白酪氨酸磷酸酶家族的一员。SHP2蛋白的构象在生理状态下自我抑制,几乎没有催化活性,当Ptpn11发生突变导致SHP2蛋白活性异常时,蛋白的蛋白酪氨酸磷酸酶结构域暴露,从而使酪氨酸磷酸酶活性的作用发挥出来[8]。研究[7,9-10]表明在SHP2异常突变中,E76K突变为第76位的谷氨酸突变为赖氨酸,其SHP2的磷酸酶催化活性相较于其他突变较高,是目前Ptpn11突变中最活跃的激活突变之一。而肉瘤的发生与MSC的恶性转化之间有密切联系,MSC的转化主要通过敲除抑癌基因、过表达癌基因和给药影响信号通路等方法实现[5,11]。近年来,大量研究表明癌症的发生与原致癌蛋白相分离有关[12-14],但是肉瘤的发生发展与蛋白相分离是否有关,目前还没有相关研究报道。
课题组既往的实验[3]表明,SHP2E76K突变细胞增殖能力远远高于野生型细胞,而细胞的恶性转化总是伴随恶性增殖。本研究利用了Ptpn11E76K/+激活突变类型小鼠,分离与肉瘤发生密切相关的MSC作为实验工具,通过使用两种分子构象抑制剂(SHP099和ET070)抑制SHP2E76K激活突变蛋白的相分离,检测相分离被抑制之后突变细胞增殖能力的变化及相应蛋白表达的改变。实验结果显示SHP2E76K激活突变后蛋白在细胞内产生了更多相分离,并且由此刺激了ERK及AMPK-mTOR信号通路活化,促进了MSC增殖。由于细胞的恶性转化总是伴随着细胞增殖能力异常增强,可以以此为切入点,深入探究SHP2激活突变的蛋白产生的相分离与MSC恶性转化之间关系,并可以进一步研究肉瘤治疗新的靶点,为其临床治疗提供新的依据。

