磷酸钙纳米颗粒介导干扰LMO4对皮肤鳞癌细胞增殖的影响
项明华,郭立钰,涂珍珍,王 月,周海胜
纳米颗粒作为运送基因或药物的载体,在生物医学研究中得到广泛应用。磷酸钙纳米颗粒(calcium phosphate nanoparticles, NP)作为一种新型的非病毒载体,可用于包裹目的基因转染真核细胞[1]。LIM结构域蛋白4(lim-domain protein 4,LMO4)是有2个串联重复排列的、富含有半胱氨酸-组氨酸的LIM结构域,故属于LMO蛋白家族成员。LMO4作为核内转录因子,不与DNA分子直接发生作用,而是协助其他转录因子以调节靶基因的表达[2]。研究[3-6]表明在胚胎发育过程中,LMO4调控生殖细胞、表皮细胞和上皮细胞的增殖、分化和迁移。多项研究[7-9]表明上皮来源的多种肿瘤如乳腺癌、胰腺癌、肺癌和食管癌等肿瘤细胞中LMO4的表达显著增加,与肿瘤细胞的增殖和凋亡存在密切关系。为了探讨LMO4在皮肤鳞癌中作用和机制,分析皮肤鳞癌组织和细胞系中LMO4的表达水平,构建表达靶向干扰LMO4的shRNA,利用NP包裹这种表达载体,转染皮肤鳞癌细胞,观察其增殖能力并探讨其机制。
1 材料与方法
1.1 试剂十二烷基硫酸纳(sodium dodecyl sulfate, SDS)、琼脂糖、枸橼酸钠、磷酸氢二钠、氯化钙和泡沫消除剂(聚醚F68)均为国产化学试剂(化学分析纯),购自北京索来宝科技有限公司;高糖DMEM培养基和青-链霉素双抗试剂购自美国Hyclone公司;胎牛血清(FBS)购自美国Gibco公司;细胞周期素蛋白(Cyclin)D1和E1抗体均购自美国Cell Signaling Technologies公司;GAPDH抗体、LMO4抗体、细胞周期素蛋白激酶(cyclin-dependent kinase, CDK)2和4均购自美国Abcam公司;检测细胞增殖的噻唑蓝试剂盒(thiazolyl blue, MTT)、细胞周期检测试剂盒购自上海碧云天生物科技有限公司;引物(表1)均由上海生工生物工程有限公司合成;TRIzol试剂盒和转染试剂Lipofectamine 3000购自美国Invitrogen公司;逆转录试剂盒、PCR检测试剂盒均购自大连宝生生物公司。
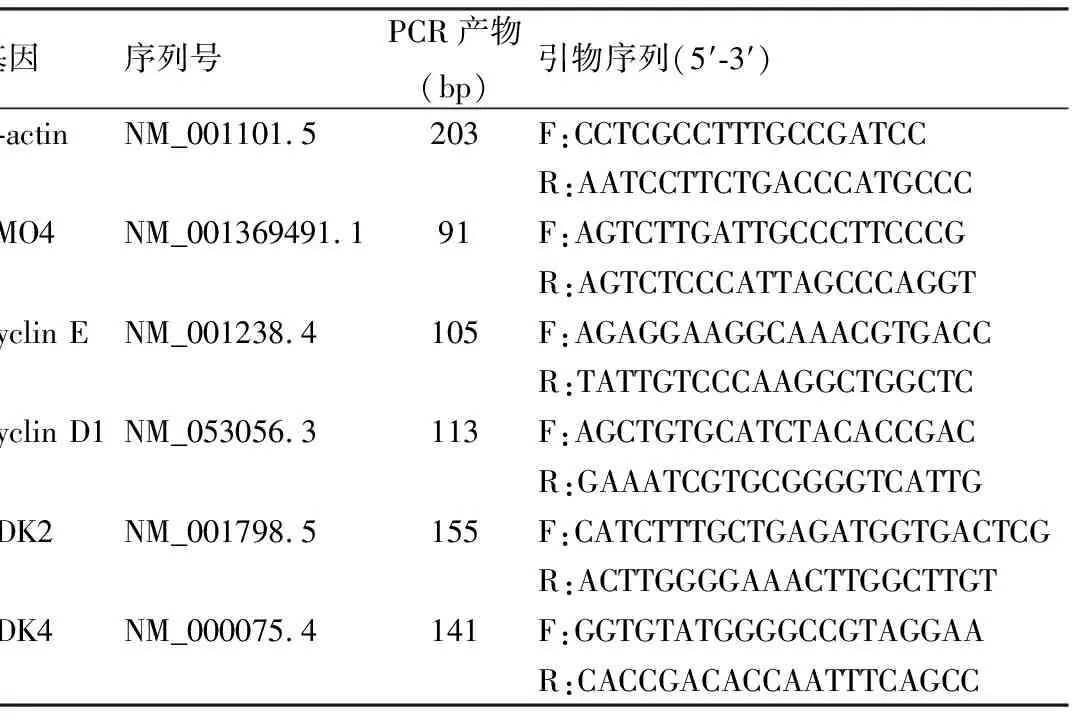
表1 检测目的基因引物
1.2 组织、细胞系与载体人皮肤鳞癌组织来自安徽省立医院皮肤科,在完成临床组织病理分析后剩余的标本;人正常皮肤组织来自安徽省立医院泌尿外科门诊包皮环切手术后遗弃的组织标本。人皮肤鳞癌细胞系A431和永生化的人角质形成细胞系(human immortalized epidermal cells, HaCat)均为所在研究室保存。干扰LMO4的干扰序列shRNA-L1和L2为研究室设计,载体GV248、干扰LMO4质粒shRNA-L1和shRNAc-L2均为课题组保存。
1.3 方法
1.3.1NP制备 根据文献[1]提供方法制备NP。制备过程描述如下:将50 ml的0.05 mol/L氯化钙、10 ml 1% SDS和10 ml 1% F68混合,持续搅拌24 h以制备均匀的微乳液A;同时将50 ml的0.025 mol/L磷酸氢二钠、50 ml的0.025 mol/L枸橼酸钠、10 ml 1% SDS和10 ml 1% F68混合,搅拌24 h以制备均匀的微乳液B。再将微乳液B以10 ml/h 的速度缓慢加入到微乳液A中,并在35 ℃搅拌72 h,以促进两种微乳液充分混合。将混合液15 000 r/min离心15 min获得纳米颗粒,75%乙醇洗涤4次,加入15 ml去离子水进行超声匀化(频率22 kHz,功率120 W)1 h。获得的纳米颗粒溶液置于-70 ℃冰箱中快速冷冻2 h,再转入冷冻干燥箱放置48 h,从而获得NP粉末备用。
1.3.2NP包被DNA及包裹效率分析 将制备的NP分别与shRNA-L1、shRNA-L2按照质量比10 ∶1、5 ∶1混合后,加入0.05 mol/L的氯化钙重悬,室温放置30 min,10 000 r/min离心10 min,收集沉淀备用。将上清液进行琼脂糖凝胶电泳分析纳米颗粒包裹DNA的效果。确定包裹方案,包裹载体GV248,作为纳米颗粒介导的载体DNA(nanoparticles mediated vectors,NP/sh-V);包裹的NP/shRNA-L1和NP/shRNA-L2混合,制备纳米颗粒介导的干涉LMO4混合液(nanoparticles mediated interfering LMO4, NP/sh-L)。制备好的纳米包裹DNA液于4 ℃保存、备用。
1.3.3细胞培养与转染 人皮肤鳞癌细胞系A431细胞和人皮肤角质形成细胞HaCat细胞均使用含10%热失活的FBS和1%青-链霉素的高糖DMEM培养基,放置于37 ℃、5% CO2的培养箱中培养。按照脂质体Lipofectamine 3000说明书操作步骤,包裹shRNA-L1、shRNA-L2,并将二者混合形成脂质体介导的干涉LMO4(liposome mediated interfering LMO4, Lip/sh-L);同时使用脂质体包裹载体GV248(Lip/sh-V),分别转染A431细胞。将纳米颗粒包裹的NP/sh-L或NP/sh-V加入A431细胞,进行瞬时转染,转染的细胞数量和DNA量与脂质体转染保持一致。转染后培养24 h,更换新鲜培养基继续培养,用于后续实验。
1.3.4逆转录-定量PCR(RT-qPCR) 根据TRIzol试剂说明书提取细胞总RNA。参照试剂盒说明进行逆转录。PCR 反应条件为94 ℃变性4 min,按照94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共32个循环,最后72 ℃延伸8 min。每个样品均设置β-actin作为内参基因。
1.3.5免疫组织化学 脱蜡处理组织切片,枸橼酸盐修复抗原,内源性过氧化物酶进行封闭。兔源抗体LMO4在4 ℃孵育过夜;次日依次滴加反应增强液和增强型酶标记二抗,室温孵育30 min,DAB显色,苏木精染细胞核,自来水冲洗染料,烘干后使用中性树脂封闭玻片;显微镜观察和拍片。
1.3.6蛋白质免疫印迹(Western blot)实验 收集细胞,加入细胞裂解液,冰上裂解30 min;细胞裂解液置于100 ℃水浴 10 min,使蛋白发生变性;进行12%聚丙烯酰胺-SDS电泳分离蛋白质;再以170 mA稳定电流转膜1.5 h;含5%脱脂牛奶的封闭液封闭40 min;分别加入对应的抗体4 ℃孵育过夜;次日漂洗后加入酶标记二抗室温孵育6 h,增强化学发光曝光显影。
1.3.7细胞增殖实验 用DMEM制备2×105/ml的细胞悬液,在96孔板中每孔接种500个细胞,接种后12 h(细胞贴壁),在12、24、36、48 h等4个时间点,根据MTT时试剂盒说明书操作。每孔加入10 μl新配制好的MTT溶液,在培养箱内孵育4 h,每孔加入100 μl的甲臜溶液,在培养箱内继续孵育,直至甲臜完全溶解,在490 nm测定吸光度值(A490)。
1.3.8细胞周期分析 按照细胞周期检测试剂盒说明书操作,简要描述如下:收集细胞,制备单细胞悬液,离心后去除上清液,在细胞中加入70%预冷乙醇 500 μl 固定4 ℃过夜;去除固定液、洗涤细胞,细胞沉淀中加入100 μl RNase A溶液,重悬细胞,37 ℃水浴 30 min;再加入400 μl的碘化丙啶染色液混匀,4 ℃避光孵育30 min。流式细胞仪检测分析细胞周期。
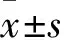
2 结果
2.1 LMO4在皮肤组织和细胞中表达利用收集的皮肤鳞癌组织和正常人皮肤组织,进行免疫组织化学分析。结果显示(图1A):LMO4表达定位在细胞核。在正常人皮肤组织中的表达水平较低,主要分布在表皮的基底层细胞,棘层、颗粒层和角化层等位置均没有检测到LMO4表达;而在皮肤鳞癌组织中,LMO4的表达水平显著增加。
为了研究LMO4在皮肤鳞癌发生中的作用和机制,选择了正常人皮肤来源的角质形成细胞HaCat和皮肤鳞癌细胞A431作为研究对象。首先在mRNA水平利用RT-qPCR方法对LMO4进行检测。结果显示(图1B):皮肤鳞癌A431细胞中LMO4的表达水平显著增加,是正常HaCat细胞的4倍。进一步在蛋白质水平利用Western blot进行验证,结果显示(图1C):LMO4在A431的表达水平较HaCat明显增加。因此,LMO4在皮肤鳞癌组织和鳞癌细胞中均具有较高的表达水平,由此推测LMO4可能参与皮肤鳞癌的发生、发展过程。
2.2 纳米颗粒包裹DNA效率和干扰效率根据人LMO4的mRNA序列和表达载体GV248结构,设计并构建了2个可以表达干扰RNA的表达载体shRNA-L1和shRNA-L2(图2A),用于干扰LMO4的表达。目的基因插入位置是在GV248载体的AgeI和EcoRI位点(图2B)。将纳米颗粒与DNA(shRNA-L1和shRNA-L2)按照质量比(μg)为5 ∶1和10 ∶1的比例进行混合,以包裹质粒DNA。将这些包裹的DNA溶液进行离心后,收集的上清液进行琼脂糖凝胶电泳,以检测上清液中残留DNA,从而判断包裹效率。如图2C显示:在5 ∶1的上清液中残留较多DNA,包裹效率较低;而在10 ∶1组的上清液中未见残留DNA,显示较好的包裹效果。在后续实验中,将纳米颗粒按照10 ∶1包裹DNA。
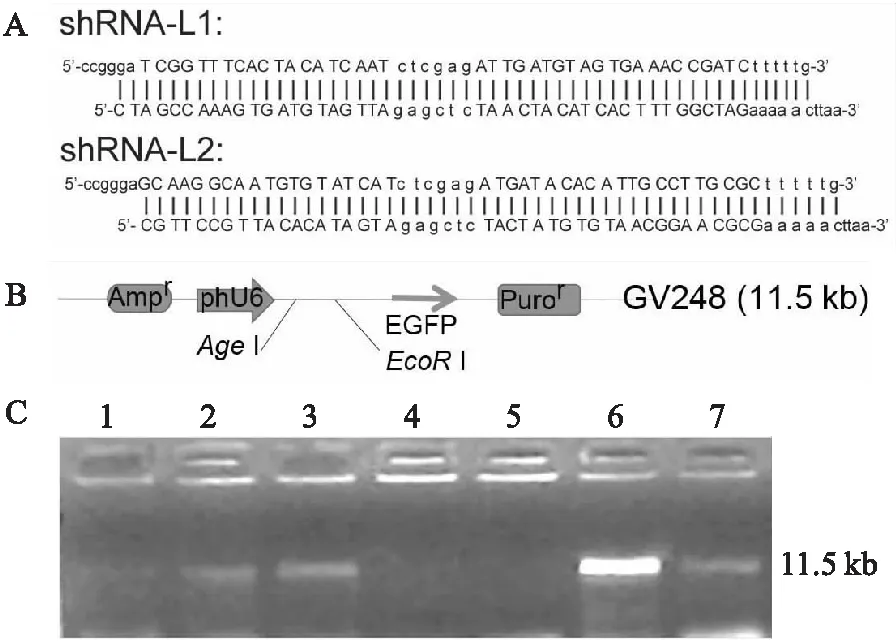
图2 shRNA表达载体构建及NP包裹DNA检测
为了检测转染效率和干涉效率,分别将纳米颗粒包裹的DNA(NP/sh-L和NP/sh-V)和脂质体包裹DNA (Lip/sh-L和Lip/sh-V)瞬时转染A431细胞,提取细胞总RNA进行RT-qPCR检测LMO4的表达水平。结果显示(图3A):在Lip/sh-L组细胞和NP/sh-L组细胞中LMO4的表达水平,分别是A431细胞组的64%±12.5%和55.0%±14.3%,分析显示差异有统计学意义(P=0.002 1,P=0.03)。但是Lip/sh-L组细胞与NP/sh-L组细胞相比,LMO4的表达差异无统计学意义(P=0.21)。Western blot检测结果脂质体和NP转染的干扰载体,都能降低LMO4的表达(图3B)。灰度分析显示(图3C):Lip/sh-L组中LMO4的表达水平是A431组细胞的74.0%±4.5%,差异有统计学意义(P=0.024)。NP/sh-L转染组的细胞中LMO4的表达水平是A431细胞的51.0%±3.0%,差异有统计学意义(P=0.002)。可见Lip/sh-L和NP/sh-L转染的细胞,LMO4的表达均得到有效抑制。
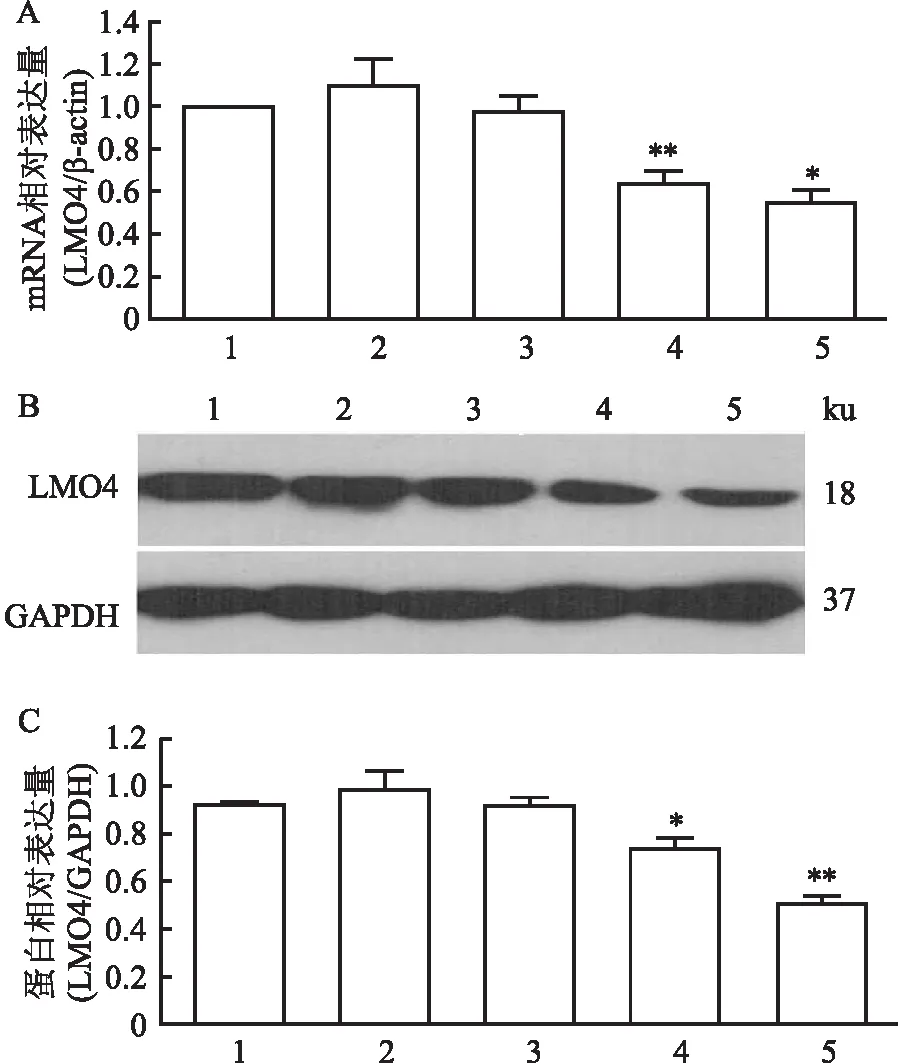
图3 A431细胞LMO4干扰效率分析
2.3 干扰LMO4对A431细胞增殖和细胞周期的影响为了研究干扰LMO4的表达对A431细胞增殖的影响,使用MTT法检测细胞增殖能力,结果显示(图4):在转染后24、36和48 h,NP/sh-L组吸光度值(A490)分别为0.28±0.01、0.31±0.11、0.38±0.18;NP/sh-V组的A490分别为0.39±0.02、0.54±0.02、0.73±0.11。与A431组相比,NP/sh-L组A490在24 h(P=0.011)、36 h(P=0.002)和48 h(P=0.001)等时间点的表达差异均有统计学意义。因此,A431细胞在干扰LMO4时,其细胞的增殖能力显著降低。
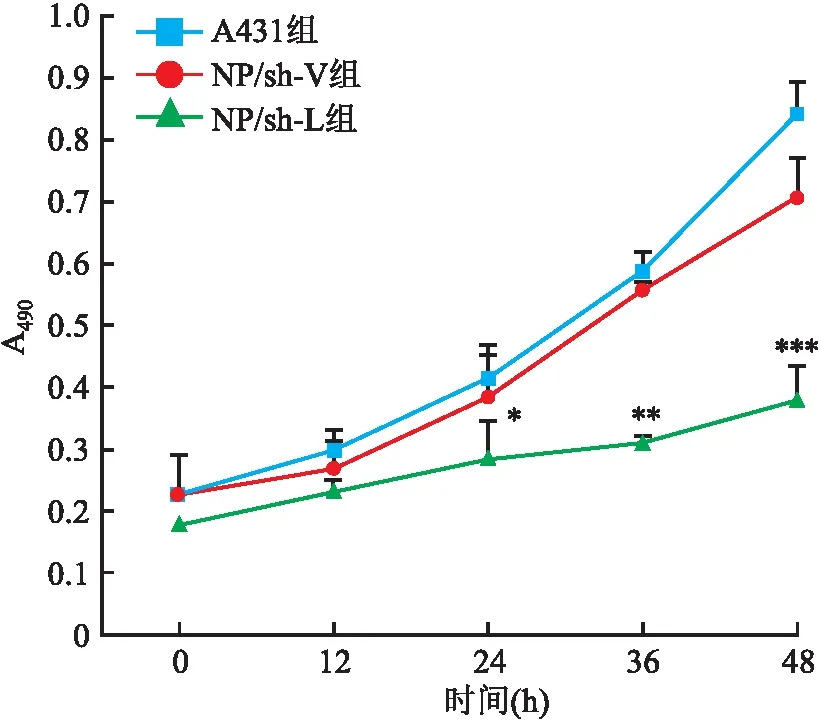
图4 干扰LMO4对细胞增殖能力的影响
为了进一步研究LMO4调节细胞增殖的机制,采用碘化丙啶染色DNA方法,通过流式细胞分析技术观察细胞周期的变化。结果显示(图5A):在A431组细胞中,处于G0/G1期的细胞比例为30.76%±1.96%;NP/sh-L组细胞中G0/G1期细胞比例为39.82%±1.86%,二者相比,差异有统计学意义(P=0.003)。A431组细胞中S期的细胞的比例为50.65%±0.62%,NP/sh-L组细胞中S期细胞比例为39.56%±0.65%,二者相比,差异有统计学意义(P=0.002)。而G2/M期细胞在NP/sh-L组与A431组之间比较,二者的差异无统计学意义(P=0.517)。可见干扰LMO4可以阻止细胞从G1期进入S期。
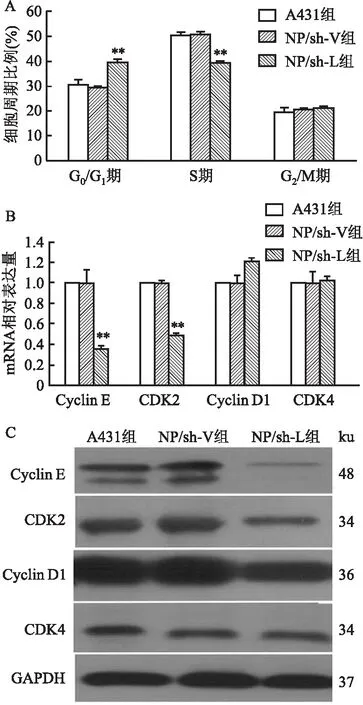
图5 干扰LMO4对A431细胞周期的影响
为探讨LMO4调控细胞周期的机制,利用RT-qPCR方法对Cyclin D1、Cyclin E、CDK2和CDK4进行了检测。结果显示NP/sh-L组细胞中Cyclin E和 CDK2较对照组明显降低。其中,Cyclin E是NP/sh-V组细胞的0.36±0.03倍,差异有统计学意义(P=0.016);NP/sh-L组细胞中CDK2是NP/sh-V组细胞的0.49±0.02倍,差异有统计学意义(P=0.001)。干扰LMO4的表达对Cyclin D1和CDK4的表达没有明显影响(图5B)。Western blot方法检测Cyclin D1、Cyclin E及CDK2和CDK4等蛋白的表达变化,与RT-qPCR的结果一致(图5C)。因此,LMO4可以通过调控Cyclin E和 CDK2表达,影响细胞周期的变化。
3 讨论
将目的基因转入真核细胞,常见的有脂质体转染、磷酸钙转染、电转染或病毒介导等方法,因操作过程较为繁琐,要求具有较高的实验条件,且需要较高的实验成本,在应用中受到一定限制。利用磷酸盐和氯化钙聚合形成直径为23.5~34.5 nm的纳米颗粒,具有易制备、实验成本低和较低的细胞毒性,且不具有免疫原性等优点[1],具有一定应用价值。在氯化钙修饰制备的纳米颗粒时,改变了纳米颗粒表面带电性,包裹带负电的DNA时能提高包裹效率[10]。利用此方法制备的纳米颗粒可以有效包裹干扰载体DNA,与传统的脂质体介导基因转移相比,其转染效率和干扰效率具有较好的一致性。
LMO4作为核内转录因子,协助其他转录因子以调节靶基因的表达[2]。由于胚胎发育时LMO4参与调控表皮细胞的增殖、分化和迁移[3-6];而在正常皮肤组织中,LMO4仅仅在基底层细胞中表达,其功能是参与维持角质形成细胞的增殖、分化和迁移,保持表皮层细胞的更新[11]。有研究[12-14]表明在上皮组织来源的肿瘤,如乳腺癌、非小细胞型肺癌、鳞状细胞癌、胰腺癌等肿瘤中,LMO4的表达水平均显著增加,且LMO4参与调控这些肿瘤细胞的增殖、迁移和转移。因此,LMO4与肿瘤细胞恶性生物学行为密切相关。免疫组织化学检测证实LMO4在皮肤鳞癌组织显著增加;细胞水平检测也表明LMO4在皮肤鳞癌细胞中表达水平较正常皮肤角质形成细胞显著增加。提示LMO4可能参与调控皮肤鳞癌的发生。
在皮肤鳞癌细胞系A431中靶向干扰LMO4的表达,结果显示敲低LMO4的表达,能显著抑制A431细胞的增殖。在干扰LMO4表达的细胞中,G2/M期细胞没有受到影响,而主要变化是G0/G1期细胞数量显著增加,S期细胞较对照组细胞明显减少。因此,干扰LMO4表达,有利于细胞周期停滞在G0/G1期。已知调节细胞周期的主要是周期素蛋白包括有 A、B、D和E等5种类别。其中,Cyclin D1和E主要调控细胞G1期到S期,Cyclin D1能激活CDK4调控G1期细胞生长;Cyclin E激活CDK2调控S期的染色体复制[12]。在A431细胞中干扰LMO4时,Cyclin E表达显著降低,同时伴随CDK2表达减少;而Cyclin D1和CDK4的表达变化不明显。这些结果与细胞周期的变化具有一致性。有研究[15]表明在乳腺癌细胞中敲低LMO4后,Cyclin D1和E的表达显著降低,导致细胞停留在G2/M期,这可能是LMO4在不同类型肿瘤细胞中作用机制存在差异性。

