花旗松素调控内质网应激PERK-ATF4 通路减轻高血压大鼠心肌肥厚的机制研究
余金玉,韩 静,张 营,侯 亮,余 稳
(长江航运总医院,武汉 430000)
左心室肥厚(left ventricular hypertrophy, LVH)是高血压性心脏病的一个重要特征,主要涉及心肌细胞肥大和心肌成纤维细胞增殖引起的纤维化[1]。LVH 是多种心血管不良事件的诱发因素,例如心律失常、心力衰竭、心肌梗塞,甚至猝死[2-3]。逆转高血压LVH,降低心血管并发症的发生率和患者死亡率是高血压治疗的重点[4]。花旗松素(taxifolin,TAX)又名二氢槲皮素,是一种植物黄酮类化合物,可用于预防和治疗心血管疾病[5],具有抗高血压作用[6]。最近的研究显示,TAX 可呈浓度依赖性地抑制血管紧张素II(Ang II)诱导的心肌细胞肥大,并可减轻压力负荷诱导的小鼠心肌肥厚及心肌纤维化[7-8],是治疗心肌肥厚和纤维化的潜在候选药物。然而,关于TAX 对心肌肥厚的调控机制知之甚少。
内质网应激( endoplasmic reticulum stress,ERS)可促进高血压期间的心肌细胞凋亡,与心肌肥厚的发病机制有关[9-10]。据报道,ERS 抑制可减轻高血压患者的心脏损伤和压力超负荷诱导的心脏肥大[11-12]。因此,ERS 可能是改善病理性心肌肥厚的重要干预靶点。蛋白激酶R 样内质网激酶(protein kinase R-like endoplasmic reticulum kinase,PERK) -转录激活因子4(activating transcription factor 4, ATF4)通路是ERS 的主要转导通路,其激活可促进心肌细胞肥大和心肌成纤维细胞活化[13];而抑制PERK-ATF4 通路可减轻心肌肥厚[14]。在肿瘤中,TAX 被报道可通过调控ERS 抑制非小细胞肺癌细胞增殖并促进细胞凋亡[15]。然而,TAX 对心肌肥厚的保护作用是否与ERS 有关尚未见报道。因此,本研究旨在确定PERK-ATF4 通路介导的ERS是否参与了TAX 在高血压心肌肥厚中的保护作用。
1 材料和方法
1.1 实验动物
SPF 级雄性15 周龄自发性高血压大鼠(spontaneously hypertensive rats, SHR)(n=24,体重260~300 g),SPF 级雄性15 周龄正常血压Wistar-Kyoto(WKY)大鼠(n=8,体重280~320 g),由北京维通利华实验动物技术有限公司[SCXK(京)2019-0009]提供,在武汉大学人民医院动物实验中心[SYXK(鄂)2020-0027]饲养。保持在恒温(23~24℃)恒湿(50%~60%)的环境中,光照时间为12 h/12 h 光暗循环,可自由获取水和食物。本研究经武汉大学人民医院动物伦理委员会批准(IACUC-202103005),并符合实验动物使用的3R 原则。
1.2 主要试剂与仪器
TAX(纯度≥85%,美国Sigma-Aldrich 公司,批号78666);PERK 激活剂CCT020312(CCT,纯度98.97%,美国MedChemExpress 公司, 批号HY-119240);小麦胚芽凝集素(WGA)溶液(美国Sigma-Aldrich 公司,批号L4895);苏木精伊红(hematoxylin eosin, HE)染色试剂盒、Masson 三色染色试剂盒(北京Solarbio 公司,批号G1120、G1340);兔源一抗葡萄糖调节蛋白78(glucose regulatory protein 78,GRP78)(批号#3183)、p-PERK(批号#3179)、PERK(批号#3192)、ATF4(批号#11815)、C/EBP 同源蛋白(C/EBP homologous protein, CHOP) (批号#3082)、β-肌动蛋白(β-actin)(批号#4970)均购自美国Cell Signaling Technology 公司。BP-2010A 智能无创血压计(北京Softron 科技有限责任公司);Vevo 2100 超高分辨率小动物彩色多普勒超声实时影像系统(加拿大VisualSonics 公司);Eclipse C1 Plus 共聚焦显微镜(日本Nikon 公司);SmartSpec Plus 分光光度计、ChemiDocTMXRS 凝胶成像分析仪(美国Bio-Rad 公司);ABI 7500 实时荧光定量PCR 仪(美国Applied Biosystems 公司)。
1.3 实验方法
1.3.1 动物分组及干预
适应性饲养1 周后,将24 只SHR 随机分为3组(n=8):SHR 组(SHR 对照组)、TAX 组(20 mg/kg TAX)[6]、TAX+CCT 组(20 mg/kg TAX+2 mg/kg CCT)[16]。8 只同龄WKY 大鼠作为WKY 组(正常对照组)。TAX 组灌胃给予20 mg/kg TAX,TAX+CCT 组在给予等量TAX 灌胃的同时腹腔注射2 mg/kg CCT,SHR 和WKY 组每天给予相同体积的生理盐水灌胃和腹腔注射。每天1 次,共给药8 周。
1.3.2 血压测量
分别于治疗前和治疗后2、4、8 周用BP-2010A智能无创血压计采用尾套法测量收缩压(systolic blood pressure, SBP) 和舒张压(diastolic blood pressure, DBP)。在测量前将每只大鼠置于加热管(38℃)中10 min 以提高其体温。每组大鼠平行测定,每只大鼠测量3 次,取平均值。
1.3.3 超声心动图
治疗8 周后,通过腹腔注射戊巴比妥钠(40 mg/kg)麻醉大鼠,使用小动物超声成像系统检测大鼠舒张期室间隔厚度(diastolic interventricular septum,IVSd)、收缩期室间隔厚度(systolic interventricular septum, IVSs)、左心室射血分数(left ventricular ejection fraction, LVEF)判断心肌肥厚程度和心脏功能。
1.3.4 心脏指数、左心室指数
心脏功能检测结束后,称量大鼠体重,然后取出心脏,用冰冷的生理盐水冲洗。滤纸吸干表面残留液体后,称取心脏总重量,随后解剖分离左心室并称重,计算心脏指数和左心室指数。
心脏指数=心脏总重量(mg)/体重(g)
左心室指数=左心室重量(mg)/体重(g)
1.3.5 HE 染色、WGA 染色和Masson 染色评估心肌组织病理学变化
从左心室心尖切下部分心肌组织,立即用冰冷的磷酸盐缓冲液清洗,用4%多聚甲醛固定过夜,然后包埋在石蜡中。随后,制备左心室的横向切片(约5 μm 厚)并放置在载玻片上。接下来,用苏木精和伊红以及Masson 三色试剂对切片进行染色,显微镜下观察染色结果,并在Masson 三色试剂染色的切片中测量纤维化面积(蓝色胶原沉积),计算胶原容积分数(collagen volume fraction, CVF)。CVF=(胶原面积/心肌总面积)×100%。
为了确定心肌细胞横截面积,将心肌组织切片脱蜡、再水化,并用EDTA 抗原修复溶液进行抗原修复处理。洗涤后,将切片与用FITC 标记的WGA 溶液(1 ∶200)在37℃避光孵育30 min,然后与DAPI在室温下放置10 min。最后,用抗褪色封固剂封固载玻片,使用荧光显微镜观察染色的细胞,每张切片随机选择5 个非重复视野,拍摄图像。使用Image-Pro Plus 6.0 软件分析心肌细胞横截面积。
1.3.6 实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)
检测心肌组织中心房钠尿肽(atrial natriuretic peptide,ANP)、 B 型 利 钠 肽(B-type natriuretic peptide,BNP)、I 型胶原蛋白α1 链(collagen I α1 chain,COL1A1)和Ⅲ型胶原蛋白α1 链(collagen Ⅲα1 chain,COL3A1)mRNA 表达
使用TRIzol 试剂从冷冻的左心室心肌组织中提取总RNA。通过SmartSpec Plus 分光光度计使用A260/A280 比率对RNA 纯度进行测定。使用Transcriptor First Strand cDNA 合成试剂盒将总RNA(每份样品2 μg)逆转录成cDNA。使用LightCycler 480 SYBR-Green I Master mix 进行qRT-PCR。在95℃初始变性5 min 后,总共进行了42 个引物延伸循环,每个循环包括95℃ 10 s 变性、60℃ 20 s 退火、72℃ 20 s 延伸。使用2-ΔΔCt方法进行基因相对表达分析。将结果标准化为甘油醛-3-磷酸脱氢酶( glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的mRNA 表达。引物序列见表1。
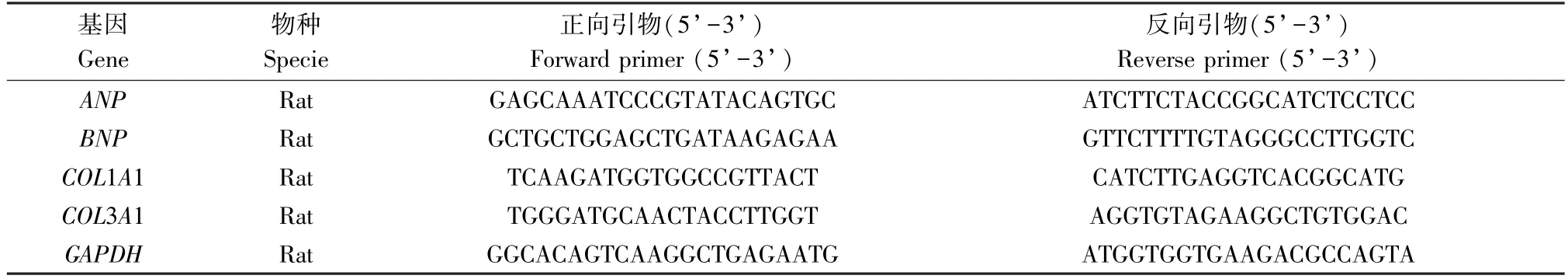
表1 qRT-PCR 引物序列Table 1 qRT-PCR primer sequences
1.3.7 Western blot 检测心肌组织PERK-ATF4 通路相关蛋白表达
在RIPA 裂解缓冲液中提取大鼠左心室心肌组织总蛋白,并通过在4℃下以12 000 r/min 离心10 min 去除碎片获得上清液。使用二辛可宁酸测定法测定样品中的蛋白质浓度。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离提取的蛋白质。然后,将蛋白质转移到聚偏二氟乙烯膜上。将膜在5%脱脂奶粉中封闭2 h。然后按照Marker 标记的分子量将膜水平切割,并在4℃下与相应的一抗(GRP78(1 ∶1000)、p-PERK(1 ∶1000)、PERK(1 ∶1000)、ATF4(1 ∶500)、CHOP(1 ∶1000)、β-actin(1∶4000))孵育过夜。将膜用TBST 洗涤后与辣根过氧化物酶偶联的二抗(1 ∶2000)在室温下孵育2 h。ECL 试剂显色并使用ChemiDoc® XRS 凝胶成像分析仪扫描印迹。使用Image J 软件测定蛋白质条带的灰度值,并使用β-actin 作为内部对照,计算目的蛋白的相对表达量。
1.4 统计学方法
实验数据用平均数±标准差(±s)表示。使用GraphPad Prism 8.0 软件,通过单因素方差分析和SNK-q检验来评估多组之间的统计显著性。P<0.05 为差异具有统计学意义。
2 结果
2.1 各组大鼠血压变化比较
治疗前,各组SHR 大鼠SBP、DBP 显著高于WKY 组(P<0.05),而SHR 大鼠组间SBP、DBP 差异均无统计学意义(P>0.05)。治疗2、4、8 周后,与SHR 组相比,TAX 组大鼠SBP、DBP 显著降低(均P<0.05);与TAX 组相比,TAX+CCT 组在治疗4、8 周后SBP、DBP 显著升高(均P<0.05)(表2、表3)。
表2 各组大鼠SBP 比较(±s,n=8)Table 2 Comparison of SBP of rats in each group
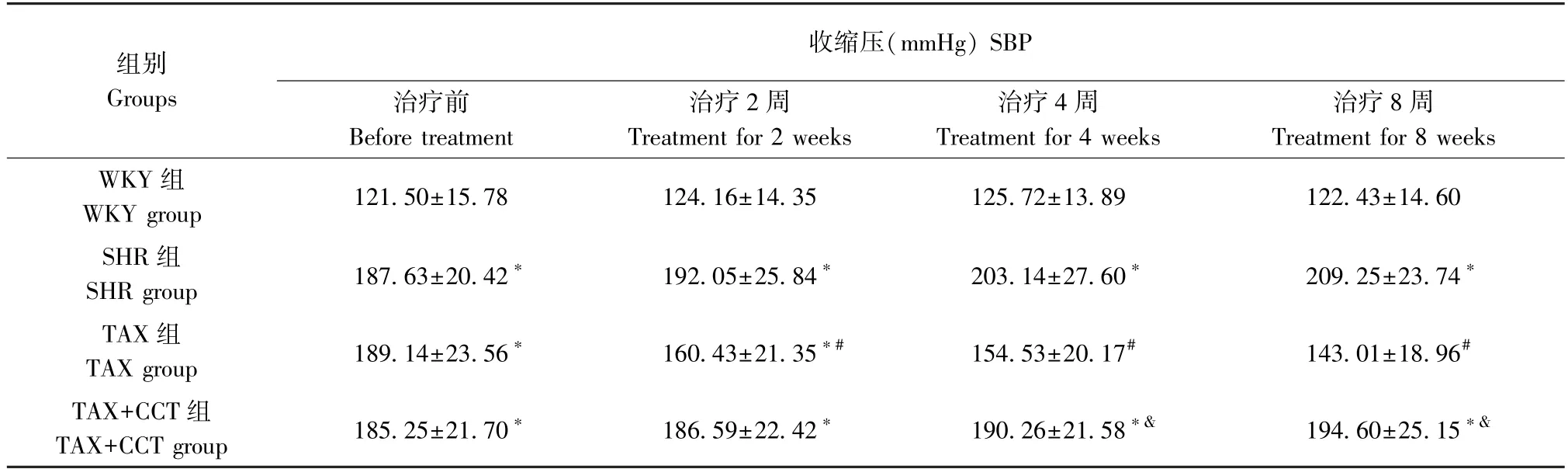
表2 各组大鼠SBP 比较(±s,n=8)Table 2 Comparison of SBP of rats in each group
注:与WKY 组相比,*P<0.05;与SHR 组相比,#P<0.05;与TAX 组相比,&P<0.05。Note.Compared with WKY group,*P<0.05.Compared with SHR group,#P<0.05.Compared with TAX group,&P<0.05.
组别Groups收缩压(mmHg) SBP治疗前Before treatment治疗2 周Treatment for 2 weeks治疗4 周Treatment for 4 weeks治疗8 周Treatment for 8 weeks WKY 组WKY group 121.50±15.78 124.16±14.35 125.72±13.89 122.43±14.60 SHR 组SHR group 187.63±20.42* 192.05±25.84* 203.14±27.60* 209.25±23.74*TAX 组TAX group 189.14±23.56* 160.43±21.35*# 154.53±20.17# 143.01±18.96#TAX+CCT 组TAX+CCT group 185.25±21.70* 186.59±22.42* 190.26±21.58*& 194.60±25.15*&
表3 各组大鼠DBP 比较(±s,n=8)Table 3 Comparison of DBP of rats in each group

表3 各组大鼠DBP 比较(±s,n=8)Table 3 Comparison of DBP of rats in each group
注:与WKY 组相比,*P<0.05;与SHR 组相比,#P<0.05;与TAX 组相比,&P<0.05。Note.Compared with WKY group,*P<0.05.Compared with SHR group,#P<0.05.Compared with TAX group,&P<0.05.
组别Groups舒张压(mmHg)DBP治疗前Before treatment治疗2 周Treatment for 2 weeks治疗4 周Treatment for 4 weeks治疗8 周Treatment for 8 weeks WKY 组WKY group 87.42±10.36 85.59±11.07 90.14±13.25 84.76±12.49 SHR 组SHR group 129.50±15.25* 133.26±16.32* 140.68±17.12* 137.80±15.62*TAX 组TAX group 126.38±14.40* 112.15±15.08*# 106.32±14.54# 98.23±13.27#TAX+CCT 组TAX+CCT group 127.61±16.19* 129.04±13.65* 135.19±18.05*& 130.45±17.10*&
2.2 各组大鼠心脏功能比较
与WKY 组相比,SHR 组大鼠IVSd、IVSs 显著增加,LVEF 显著降低(均P<0.05);与SHR 组相比,TAX 组大鼠IVSd、IVSs 显著降低,LVEF 显著升高(均P<0.05);与TAX 组相比,TAX+CCT 组大鼠IVSd、IVSs 显著增加,LVEF 显著降低(均P<0.05)(图1,表4)。

图1 各组大鼠超声心动图代表性图像Figure 1 Representative echocardiographic images of rats in each group
表4 各组大鼠IVSd、IVSs 和LVEF 比较(±s,n=8)Table 4 Comparison of IVSd, IVSs and LVEF of rats in each group

表4 各组大鼠IVSd、IVSs 和LVEF 比较(±s,n=8)Table 4 Comparison of IVSd, IVSs and LVEF of rats in each group
注:与WKY 组相比,*P<0.05;与SHR 组相比,#P<0.05;与TAX 组相比,&P<0.05。Note.Compared with WKY group,* P <0.05.Compared with SHR group,#P<0.05.Compared with TAX group,&P<0.05.
组别Groups舒张期室间隔厚度(mm)IVSd收缩期室间隔厚度(mm)IVSs左心室射血分数(%)LVEF WKY 组WKY group 1.48±0.15 1.96±0.20 76.58±8.13 SHR 组SHR group 1.90±0.17* 2.51±0.23* 54.39±6.40*TAX 组TAX group 1.57±0.16# 2.16±0.19# 68.42±7.25#TAX+CCT 组TAX+CCT group 1.84±0.19*& 2.45±0.22*& 55.90±6.31*&
2.3 各组大鼠心脏指数、左心室指数比较
与WKY 组相比,SHR 组大鼠心脏指数、左心室指数显著升高(均P<0.05);与SHR 组相比,TAX组大鼠心脏指数、左心室指数显著降低(均P<0.05);与TAX 组相比,TAX+CCT 组大鼠心脏指数、左心室指数显著升高(均P<0.05)(表5)。
表5 各组大鼠心脏指数、左心室指数比较(±s,n=8)Table 5 Comparison of cardiac index and left ventricular index of rats in each group

表5 各组大鼠心脏指数、左心室指数比较(±s,n=8)Table 5 Comparison of cardiac index and left ventricular index of rats in each group
注:与WKY 组相比,*P<0.05;与SHR 组相比,#P<0.05;与TAX 组相比,&P<0.05。Note.Compared with WKY group,* P <0.05.Compared with SHR group,#P<0.05.Compared with TAX group,&P<0.05.
组别Groups心脏指数(mg/g)Cardiac index左心室指数(mg/g)Left ventricular index WKY 组WKY group 3.26±0.39 2.38±0.25 SHR 组SHR group 4.15±0.44* 3.04±0.32*TAX 组TAX group 3.50±0.41# 2.52±0.29#TAX+CCT 组TAX+CCT group 4.07±0.42*& 2.93±0.30*&
2.4 各组大鼠心肌细胞横截面积、CVF 比较
心肌组织学分析结果显示,WKY 组心肌细胞结构正常,与WKY 组相比,SHR 组心肌细胞肿胀变性、排列稀疏,心肌细胞横截面积、CVF 显著升高(均P<0.05);与SHR 组相比,TAX 组心肌细胞肿胀程度下调,心肌细胞横截面积、CVF 显著降低(均P<0.05);与TAX 组相比,TAX+CCT 组心肌细胞横截面积、CVF 显著升高(均P<0.05)(图2,表6)。
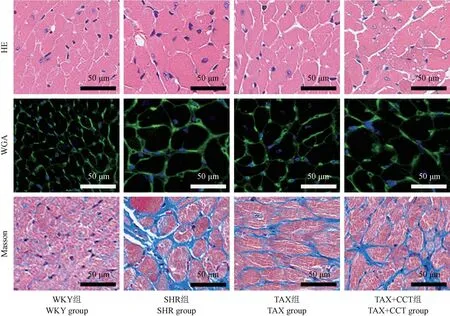
图2 心肌HE 染色、WGA 染色和Masson 染色的代表性组织学图像Figure 2 Representative histological images of myocardial HE, WGA and Masson staining
表6 各组大鼠心肌细胞横截面积、CVF 比较(±s,n=8)Table 6 Comparison of cardiomyocyte cross-sectional area and CVF of rats in each group

表6 各组大鼠心肌细胞横截面积、CVF 比较(±s,n=8)Table 6 Comparison of cardiomyocyte cross-sectional area and CVF of rats in each group
注:与WKY 组相比,*P<0.05;与SHR 组相比,#P<0.05;与TAX 组相比,&P<0.05。Note.Compared with WKY group,*P<0.05.Compared with SHR group,#P<0.05.Compared with TAX group,&P<0.05.
组别Groups心肌细胞横截面积(μm2)Myocardial cell cross-sectional area胶原容积分数(%)CVF WKY 组 WKY group 436.85±52.96 3.12±0.40 SHR 组 SHR group 1152.70±94.25* 12.79±1.53*TAX 组 TAX group 788.42±61.34*# 6.80±0.72*#TAX+CCT 组 TAX+CCT group 1094.15±85.67*& 11.45±1.38*&
2.5 各组大鼠心肌组织ANP、BNP、COL1A1 和COL3A1 mRNA 表达比较
与WKY 组相比,SHR 组ANP、BNP、COL1A1 和COL3A1 mRNA 表达显著升高(均P<0.05);与SHR组相 比,TAX 组ANP、BNP、COL1A1 和COL3A1 mRNA 表达显著降低(均P<0.05);与TAX 组相比,TAX+CCT 组ANP、BNP、COL1A1 和COL3A1 mRNA表达显著升高(均P<0.05)(表7)。
表7 各组大鼠心肌组织ANP、BNP、COL1A1 和COL3A1 mRNA 表达比较(±s,n=8)Table 7 Comparison of the expressions of ANP, BNP, COL1A1 and COL3A1 mRNA in myocardial tissue of rats in each group
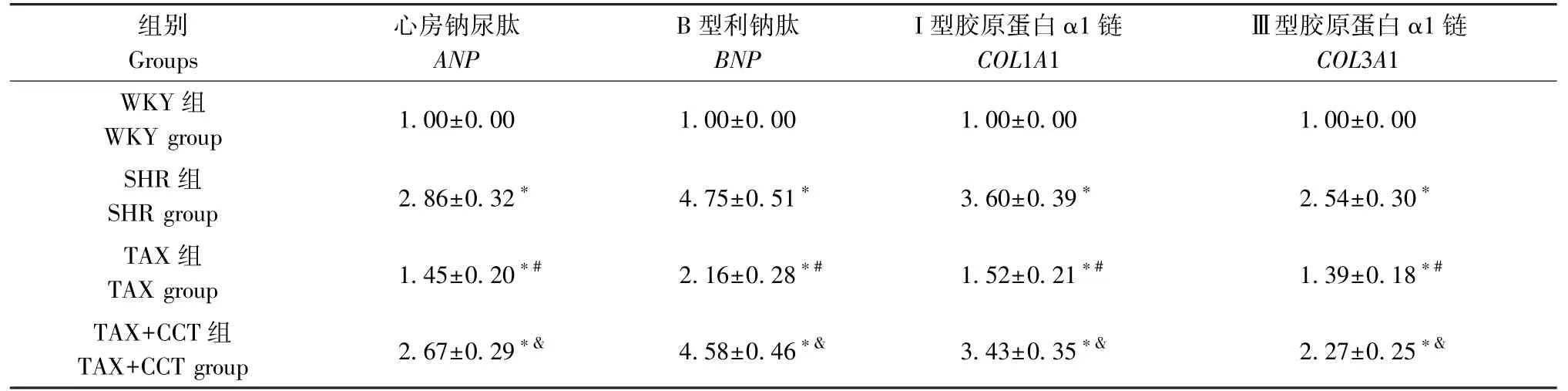
表7 各组大鼠心肌组织ANP、BNP、COL1A1 和COL3A1 mRNA 表达比较(±s,n=8)Table 7 Comparison of the expressions of ANP, BNP, COL1A1 and COL3A1 mRNA in myocardial tissue of rats in each group
注:与WKY 组相比,*P<0.05;与SHR 组相比,#P<0.05;与TAX 组相比,&P<0.05。Note.Compared with WKY group,*P<0.05.Compared with SHR group,#P<0.05.Compared with TAX group,&P<0.05.
组别Groups心房钠尿肽ANP B 型利钠肽BNP I 型胶原蛋白α1 链COL1A1Ⅲ型胶原蛋白α1 链COL3A1 WKY 组WKY group 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 SHR 组SHR group 2.86±0.32* 4.75±0.51* 3.60±0.39* 2.54±0.30*TAX 组TAX group 1.45±0.20*# 2.16±0.28*# 1.52±0.21*# 1.39±0.18*#TAX+CCT 组TAX+CCT group 2.67±0.29*& 4.58±0.46*& 3.43±0.35*& 2.27±0.25*&
2.6 各组大鼠心肌组织PERK-ATF4 通路相关蛋白表达比较
与WKY 组相比,SHR 组GRP78、ATF4、CHOP蛋白水平和p-PERK/PERK 比值显著升高(均P<0.05);与SHR 组相比,TAX 组GRP78、ATF4、CHOP蛋白水平和p-PERK/PERK 比值显著降低(均P<0.05);与TAX 组相比,TAX+CCT 组GRP78、ATF4、CHOP 蛋白水平和p-PERK/PERK 比值显著升高(均P<0.05)(图3,表8)。

图3 各组大鼠心肌组织PERK-ATF4 通路相关蛋白表达Figure 3 Expression of PERK-ATF4 pathway-related proteins in myocardial tissue of rats in each group
表8 各组大鼠心肌组织GRP78、PERK、p-PERK、ATF4 和CHOP 蛋白水平比较(±s,n=8)Table 8 Comparison of GRP78, PERK, p-PERK, ATF4 and CHOP protein levels in myocardial tissue of rats in each group
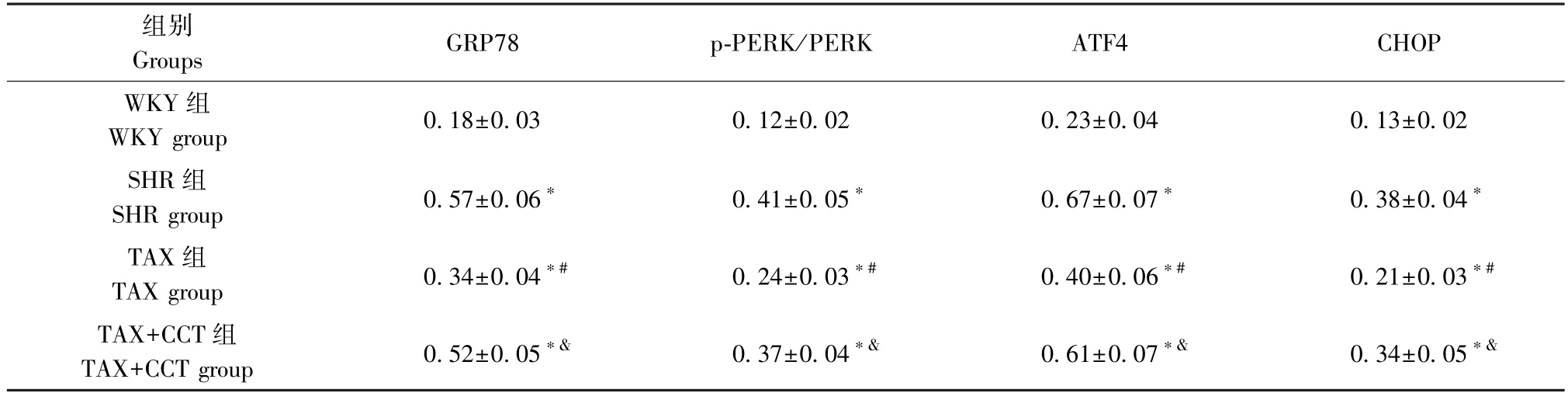
表8 各组大鼠心肌组织GRP78、PERK、p-PERK、ATF4 和CHOP 蛋白水平比较(±s,n=8)Table 8 Comparison of GRP78, PERK, p-PERK, ATF4 and CHOP protein levels in myocardial tissue of rats in each group
注:与WKY 组相比,*P<0.05;与SHR 组相比,#P<0.05;与TAX 组相比,&P<0.05。Note.Compared with WKY group,*P<0.05.Compared with SHR group,#P<0.05.Compared with TAX group,&P<0.05.
组别Groups GRP78 p-PERK/PERK ATF4 CHOP WKY 组WKY group 0.18±0.03 0.12±0.02 0.23±0.04 0.13±0.02 SHR 组SHR group 0.57±0.06* 0.41±0.05* 0.67±0.07* 0.38±0.04*TAX 组TAX group 0.34±0.04*# 0.24±0.03*# 0.40±0.06*# 0.21±0.03*#TAX+CCT 组TAX+CCT group 0.52±0.05*& 0.37±0.04*& 0.61±0.07*& 0.34±0.05*&
3 讨论
高血压是全球心血管疾病和过早死亡的主要危险因素。慢性高血压引起长期左心室压力超负荷,导致病理性心肌肥厚,最终导致心力衰竭[17]。目前,没有有效的药物可逆转从病理性心肌肥厚到心力衰竭的进展。一种被广泛接受的治疗策略是在心力衰竭早期进行积极干预,抑制病理性心肌肥厚。
TAX 是一种常见的黄酮类化合物,具有清除自由基、抗氧化和抗炎作用,用于治疗心脑血管疾病。据报道,TAX 可抑制心肌肥厚并减轻压力超负荷后的心室纤维化[7-8]。与以往的研究结果一致,本研究结果显示,TAX 在SHR 中具有抗高血压作用,还可以改善左心室功能障碍,减轻心肌肥厚。ANP 和BNP 是心肌肥厚的常见生物标志物[18]。心脏纤维化在心肌肥厚的发病机制中起着重要作用,心脏成纤维细胞过度沉积细胞外基质蛋白,会加速心力衰竭进展[19]。胶原蛋白(Collagen I 和Collagen Ⅲ)的积累是导致心肌纤维化的主要原因。在本研究中,TAX 降低了SHR 心肌组织中ANP和BNPmRNA 水平,减轻了心脏和左心室重量;通过HE 和WGA 染色测定,TAX 降低了SHR 中增大的心肌细胞横截面积。此外,TAX 降低了SHR 心肌组织COL1A1 和COL3A1 mRNA 表达以及CVF,表明TAX 可抑制心肌纤维化。提示,TAX 改善了与高血压相关的心脏功能和心肌肥厚。但其潜在机制需要进一步研究。
研究显示,ERS 诱导的心肌细胞凋亡在心肌肥厚向心力衰竭的转变中起重要作用,减轻ERS 可减轻心肌肥厚[11-12]。在本研究中,SHR 心肌组织中GRP78、p-PERK 和ATF4、CHOP 蛋白表达水平升高,表明SHR 所致的心肌肥厚中存在ERS。ERS 主要通过GRP78 的上调启动。GRP78 是一种与PERK 结合的分子伴侣,与GRP78 的解离是PERK信号通路激活的开始[20]。PERK 是一种I 型跨膜ER 蛋白,属于真核生物翻译起始因子2α(eukaryotic translation initiation factor 2α, eIF2α)家族,是ERS反应的主要转导因子,在正常生理情况下,PERK 与其分子伴侣-GRP78 结合形成稳定的复合物,表现为活性抑制;而当ERS 错误折叠或未折叠蛋白增多时则促使GRP78 与PERK 解离,PERK 形成寡聚体,自体发生磷酸化被激活,活化的PERK 可直接促进其下游真核翻译起始因子2α(eIF2α)磷酸化,从而降低细胞应激,通过抑制蛋白质合成使细胞存活[21]。PERK 可以阻断大部分蛋白质的翻译,但并非抑制了所有蛋白质的合成,相反的可提高细胞位于5’端非编码区上的开放式阅读框架的翻译效率,上调ATF4 的表达[22]。过度或持续的ERS 则促使GRP78 与PERK 解离,PERK 形成寡聚体,发生自磷酸化被激活,可以跳过eIF2α 磷酸化,激活下游转录因子ATF4,进而增加CHOP 的转录和蛋白表达,诱导细胞死亡[23-24]。给予TAX 干预后,SHR 左心室心肌组织中ERS 生物标志物GRP78 和p-PERK、ATF4 水平,以及ERS 诱导细胞凋亡的关键下游因子CHOP 的表达均降低,这意味着PERK-ATF4 通路介导的ERS 可能参与了TAX 对SHR 的保护功能。
与本研究结果一致,Shu 等[25]发现TAX 可通过减少GRP78、p-PERK 和p-eIF2α 表达,抑制ERS 诱导的细胞凋亡, 减轻心肌缺血再灌注损伤。CCT020312 是PERK 信号的选择性激活剂[16]。在本研究中,使用CCT020312 激活PERK 来探索TAX的作用是否依赖于对PERK 信号的抑制,结果显示,TAX 对心脏功能和心肌肥厚的保护作用被CCT020312 部分逆转;CCT020312 还逆转了TAX 对ERS 的抑制作用。表明TAX 对ERS 的影响可能是由于抑制了PERK 信号。提示,TAX 可能通过抑制PERK-ATF4 通路介导的ERS,改善高血压心肌肥厚。
综上所述,ERS 参与了TAX 对高血压心肌肥厚的保护作用,TAX 的作用机制可能是由PERK-ATF4信号通路介导的。本研究阐明了TAX 可通过抑制PERK-ATF4 信号通路来保护SHR 中的心肌肥厚,为TAX 对高血压性心肌肥厚的治疗作用提供了潜在的机制。但本研究尚存在一定的局限性,如未分析不同浓度TAX 的保护作用与心肌肥厚改善程度的关系。因此,尚需进一步实验探究TAX 对心肌肥厚的保护作用是否因浓度不同而不同。

