PI3K/Akt/mTOR 信号通路在TRALI 大鼠发病机制中的作用研究
刘双春,张细江,王璐倩,陈再欢,林荣海*
(1.台州市立医院输血科,浙江 台州 318000;2.台州市立医院重症医学科,浙江 台州 318000)
输血反应的特征是对输注全血或其个别成分的不良反应,其严重程度从轻微到严重危及生命。他们也可能出现非特异性症状,通常与患者的其他潜在共病症状重叠。这种临床表现的重叠使得输血反应的诊断变得极其困难[1]。死亡在急性输血反应中并不常见,但可迅速发生[2]。输血相关急性肺损伤(transfusion-related acute lung injury, TRALI)是输血过程中导致死亡的主要原因之一,在输注血液制剂6 h 内出现以急性非心源性肺水肿、低氧血症为主要临床表现的综合征[3]。美国食品药品管理局(food and drug administration,FDA)监测了2012~2016 年所有的TRALI 死亡病例,大约占输血相关总死亡人数的34%[4]。然而我国对于TRALI 基础知识的掌握比较匮乏,临床医生对该病认识不足并且临床输血缺乏有效的预警系统,经常导致其漏诊和误诊。进一步探究临床输血过程中TRALI 的主要发病机制,寻找输血不良事件和血液输注预警系统中的主要作用靶点,在防治TRALI 发生发展过程中具有举足轻重的作用,对保证临床输血安全具有重要意义。
TRALI 的病理学机制尚不清楚,相关文献报道了不同细胞信号转导通路的激活参与了TRALI 的发病。目前,国际上公认的机制是“二次打击”学说。患者本身的一些危险因素,包括感染、炎症、败血症、慢性酒精滥用、吸烟、休克、肝手术、高压机械通气等成为了TRALI 的第一次打击[5-6]。TRALI 的第二次打击包括两组类型:抗体介导型和非抗体介导型。人类白细胞抗原(HLA)-I 类、-II 类抗体或粒细胞特异性抗原(HNA)抗体是诱导TRALI 抗体介导型第二次打击的主要输注血液成分[7];另外血液成分中包含着一些溶血磷脂酰胆碱、花生四烯酸、可溶性CD40 配体等非抗体性的生物活性物质,因血液制剂储存过久可导致其在血液中过量积累引起“储存损伤”,成为了非抗体介导的第二次打击的主要输注血液成分[8-9]。仅有的少量相关研究发现,TRALI 的发生发展与机体的一系列炎症反应及免疫损伤过程密切相关,涉及大量炎症及免疫相关信号分子及信号通路的激活,但其相关生物学研究尚不充分。在多种炎症及免疫相关信号通路中,PI3K/Akt/mTOR 信号通路在炎症反应中有重要作用,参与多种类型急性肺损伤的发生发展,但在TRALI 中的相关研究甚少。PI3K/Akt/mTOR 轴传递的重要信号调节包括了几乎所有组织类型的各种生理过程,如增殖、凋亡、炎症细胞迁移和免疫反应,其调节失调与各种疾病的发展相关,包括癌症、糖尿病、自身免疫及炎症相关疾病等[10]。基于此,本研究利用创伤-失血-大量输血的方法构建了TRALI 大鼠模型,对其外周血/肺组织中的相关炎症因子表达谱进行分析,同时明确PI3K/Akt/mTOR信号通路在TRALI 发生发展过程中的调控机制,这一研究以mTOR 作为靶点,无疑将为临床工作中TRALI 的有效防治提供必要的理论支撑和实验数据。
1 材料和方法
1.1 实验动物
SPF 级雄性SD 大鼠共20 只,6~8 周龄,体重180~200 g,购自南京君科生物工程有限公司[SCXK(沪)2018-0006],无菌处理动物培养过程中所需的物品(包括标准饲料、饮水和垫料等),动物在22~24℃和(50±5)%湿度下保持12 h/12 h 明暗循环,在台州学院医学院SPF 级动物房常规饲养[SYXK(浙)2021-0013]。所有动物实验均通过台州学院实验动物伦理审查并批准(TZXY-2021-20211001),按照《实验动物管理条例》要求的实验动物使用3R原则给予人道关怀。
1.2 主要试剂与仪器
逆转录试剂盒购于日本TaKaRa 公司(货号:AJ60650A);SYBR Green Realtime PCR Master Mix试剂购于日本TOYOBO 公司(货号:647200);实验过程中所有的上下游引物及大鼠ACTB 内参引物均由上海生工生物工程有限公司提供;RIPA 裂解液、BCA 蛋白浓度测定试剂和ECL 超敏发光试剂均购于上海碧云天生物科技有限公司;TNF-α(货号:PT516)、IL-1β(货号:PI303)和IL-6(货号:PI328)ELISA 试剂盒均购于上海碧云天生物技术有限公司;蛋白Marker 购于上海雅酶生物科技有限公司;p-mTOR(Ser2448)(D9C2)(货号:#2475)、mTOR(7C10)(货号:#2983)、p-Akt(Ser473)(D9E)(货号:#4060)、Akt(pan)(C67E7)(货号:#4691)、Bax(E4U1V) (货号:#41162)、Bcl-2(124) (货号:#15071)、 Caspase3 (货 号: #9662)、 GAPDH 抗 体(D16H11)(货号:#5174)、HRP-山羊抗兔二抗(批号7074P2)美国CST 公司。Thermo Fisher PCR 扩增仪;Roche 实时荧光定量PCR 仪;瑞士TECAN 酶标仪;Bio-Rad Western 电泳电转仪;奥林巴斯BX53显微拍照系统。
1.3 实验方法
1.3.1 动物分组及模型构建
将大鼠随机分为正常对照组(normal control,NC)(n=5)、TRALI 模型组(TRALI model,TM)(n=7)和生理盐水对照组(normal saline,NS)(n=6)。
本实验动物模型的构建参照胡嫒等[11]的建模方法进行,具体方法如下:异氟醚(0.6~0.8 L/min)麻醉动物,大鼠股动静脉置管后15~30 min 采集大鼠全血的30%,恢复1 h 后以2 倍失血量的乳酸林格钠液平衡液进行补液,40 min 内补液完成后经股静脉注射伊文思兰染液(Evans blue dye,EBD)30 mg/kg,随后将保存了35 d 的红细胞进行输注;同时将NS 组大鼠输注相同体积的生理盐水。红细胞输注量(mL)=大鼠基础红细胞比容/该袋PRBC 红细胞比容×失血量(mL),将浓缩红细胞用生理盐水稀释成总体积=失血量,并于30 min 内输注完毕。生理盐水输注量=红细胞输注量。NC 组大鼠不做任何处理。
1.3.2 肺组织病理学检测
模型制备成功后6 h,处死各组大鼠取出右肺组织。福尔马林固定,行HE 染色,观察大鼠肺组织形态学改变。
1.3.3 酶联免疫吸附试验(ELISA)检测外周血TNF-α、IL-1β 和IL-6 表达
采集大鼠外周静脉血,分离血清置-80℃备用;采用ELISA 试剂盒检测外周血血清中TNF-α、IL-6和IL-1β 含量。所有操作均按照说明书进行。
1.3.4 Real-time PCR(RT-qPCR)检测肺组织中TNF-α、IL-1β 和IL-6 mRNA 表达
采用RT-qPCR 方法分析肺组织中TNF-α、IL-6和IL-1β mRNA 表达。使用TRIzol ®试剂提取RNA,使用反转录试剂盒合成cDNA。使用SYBR 预混EX TaqTMcDNA 和特定的基因引物进行qPCR,并使用LightCycler480 system 进行检测。确定各基因的相对表达量,归一化为ACTIN 的表达量,用2-ΔΔCq法计算。引物的序列见表1。

表1 引物序列Table 1 Primer sequence
1.3.5 Westem blot 检测肺组织中相关蛋白的表达
提取大鼠肺脏组织总蛋白,BCA 法检测蛋白浓度。将样本用恒温金属浴煮沸(100℃)3 min 后行8%或10% SDS-PAGE 电泳,100 V 电转60 min,将中间膜转移至PVDF。脱脂牛奶恒温37℃封闭2 h,TBST 洗 膜3 次,每 次10 min,一 抗Akt、p-Akt、mTOR、p-mTOR、 Bcl-2、 Bax、 Caspase3 和 GAPDH(1 ∶1000;CST)孵育抗覆盖膜4℃孵化过夜。转天TBST 漂洗3 次共30 min 后于HRP 标记的二抗室温孵育2 h,TBST 洗涤3 次后ECL 法显色拍照,采用Image J 图像分析软件进行结果分析。
1.4 统计学方法
数据对的统计和分析采用GraphPad Prism 7.0软件进行,以平均数±标准差(±s)表示结果中的数据,数据统计应用了配对样本t检验和单因素方差分析。P值通过Bonferroni 进行校正。P<0.05 为差异显著,P<0.01 为差异极显著。
2 结果
2.1 各组大鼠的肺组织HE 染色
如图1 所示,HE 染色后发现,NC 组大鼠肺泡组织结构清晰,肺泡腔内无渗出液及细胞;与NC 组相比,TM 组(红圈内)肺泡组织结构严重受损,肺泡壁增厚,肺泡腔有粉色水肿液,炎细胞浸润,水肿明显;NS 组肺泡结构基本完整,无肉眼可见的水肿和炎性细胞浸润。
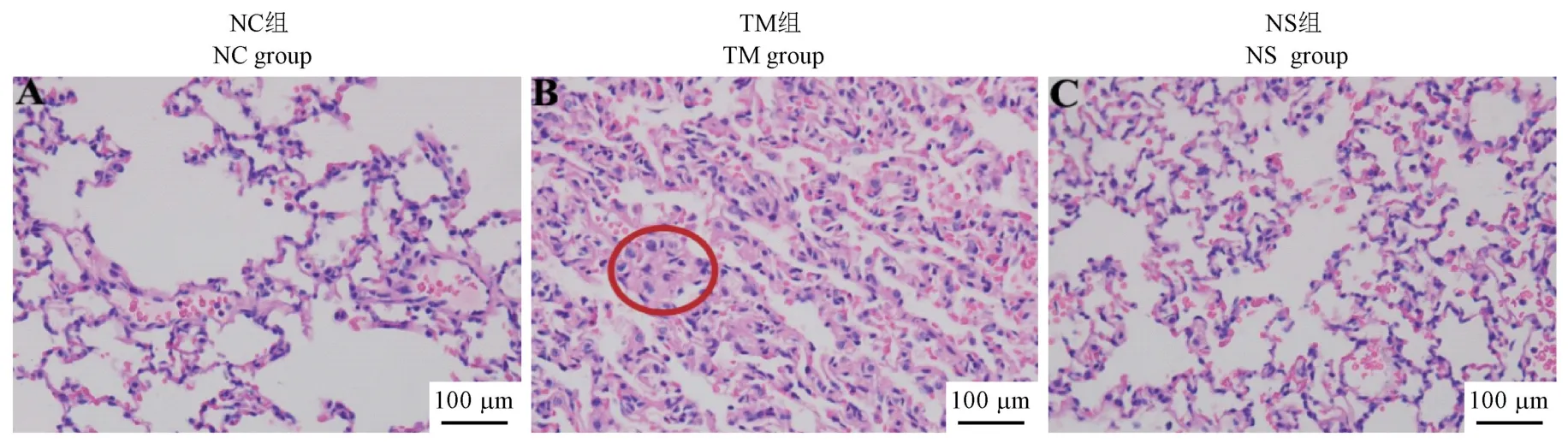
图1 各组大鼠HE 染色Figure 1 HE staining of rats in each group
2.2 各组大鼠肺组织中TNF-α、IL-6 和IL-1β 的mRNA 表达水平
RT-qPCR 检测肺组织中相关细胞因子的mRNA 表达水平,如图2 结果所示,与NC 组相比,TM 组大鼠肺组织中TNF-α、IL-6 和IL-1β 的mRNA表达水平均显著增高(P<0.05);与TM 组相比,NS组大鼠肺组织中TNF-α 和IL-1β mRNA 表达水平均明显下降(P<0.05);NC 组与NS 组相比,差异无统计学意义。

注:与正常对照组相比,*P<0.05,**P<0.01;与TRALI 模型组相比,#P<0.05,##P<0.01。图2 RT-qPCR 检测各组大鼠肺组织中TNF-α、IL-1β 和IL-6 的mRNA 的表达水平Note.Compared with NC group,*P<0.05,**P<0.01.Compared with TM group, #P<0.05,##P<0.01.Figure 2 Expression levels of TNF-α, IL-1β and IL-6 mRNA in lung tissues were detected by RT-qPCR
2.3 各组大鼠外周血中TNF-α、IL-6 和IL-1β 的蛋白表达水平
如图3 所示,与NC 组相比,TM 组大鼠外周血中TNF-α、IL-6 和IL-1β 的分泌水平均显著增高(P<0.01);与TM 组相比,NS 组大鼠外周血中TNF-α 和IL-1β 表达水平均明显下降(P<0.05);NC 组与NS组相比,所有细胞因子水平的变化差异均无统计学意义。

注:与正常对照组相比,**P<0.01;与TRALI 模型组相比,#P<0.05,##P<0.01。图3 ELISA 检测各组大鼠外周血中TNF-α、IL-1β 和IL-6 的分泌水平变化Note.Compared with NC group,**P<0.01.Compared with TM group,#P<0.05,##P<0.01.Figure 3 Levels of TNF-α, IL-1β and IL-6 production in peripheral blood were detected by ELISA
2.4 PI3K/Akt/mTOR 信号通路蛋白在各组大鼠肺组织中的表达
与NC 组相比,TM 组和NS 组大鼠肺组织中p-Akt/Akt 和p-mTOR/mTOR 显著升高(P<0.01)。与TM 组比较,NS 组p-Akt/Akt 显著降低,然而pmTOR/mTOR 则显著升高(P<0.01)(图4)。

注:与正常对照组相比,**P<0.01;与TRALI 模型组相比,##P<0.01。图4 PI3K/Akt/mTOR 信号通路相关蛋白在各组大鼠肺组织中的表达水平Note.Compared with NC group,**P<0.01.Compared with TM group,##P<0.01.Figure 4 Expression levels of PI3K/Akt/mTOR signaling pathway relative protein in lung tissue were detected by Western blot
2.5 Bcl-2、Bax 和Caspase3 凋亡蛋白在各组大鼠肺组织中的表达
如图5 所示,与NC 组相比,Bax 和Caspase3 蛋白表达水平在TM 组大鼠肺组织中呈明显下降趋势,Bcl-2 蛋白表达则呈现显著增加(P<0.05),NS组Bax 和Caspase3 蛋白表达水平则明显增加(P<0.01);与TM 组相比,NS 组大鼠肺组织中Bax 和Caspase3 蛋白表达水平明显升高(P<0.05)。

注:与正常对照组相比,**P<0.01;与TRALI 模型组相比,##P<0.01。图5 Western blot 检测各组大鼠肺组织中Bcl-2、Bax 和Caspase3 凋亡蛋白的表达水平变化Note.Compared with NC group,**P<0.01.Compared with TM group,##P<0.01.Figure 5 Expression levels of Bcl-2, Bax and Caspase3 apoptosis protein in lung tissues were detected by Western blot
3 讨论
TRALI 是一种输血相关的严重并发症,是与输血有关的第二大死亡原因[1]。TRALI 急性起病,以低氧血症(P/F≤300 或SpO2<90%)为特征,影像学明显双侧肺水肿,属于非心源性肺水肿。首先,TRALI 是一种临床诊断,尽管我们在了解其发病机制方面已经取得了长足进展,包括识别抗人HLA 或人HNA 抗体,但其生物标志物只能支持诊断[12]。因此深入研究TRALI 疾病进展过程中的病理生理学机制,是促进其预防和治疗的重要手段。
TRALI 的发生发展与机体一系列炎症反应及免疫损伤过程密切相关,涉及大量炎症及免疫相关信号分子及信号通路的激活,但其相关生物学领域研究尚不充分。本研究参照“二次打击假说”理论,将雄性SD 大鼠制备成TRALI 动物模型,HE 染色观察了模型大鼠肺组织损伤情况。实验结果发现,TM组大鼠肺泡组织结构严重受损,肺泡壁增厚,肺泡腔有粉色水肿液,炎性细胞浸润,水肿明显(图1),由此证明TRALI 大鼠模型制备成功。TRALI 发病重要的病理生理学基础是肺部炎症细胞聚集及其随后细胞因子及炎症介质的大量释放,从而引起肺脏组织中微血管内皮细胞和肺泡上皮细胞的损伤[13]。肺泡腔内的巨噬细胞既具有吞噬功能,又具有分泌功能,在受到外界因素刺激后能够合成并释放肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)和白介素-6(IL-6)等多种炎症细胞因子,便于中性粒细胞迁移、粘附于损伤部位,并激活后产生呼吸爆发,启动炎症级联反应,加重肺损伤[14]。本研究中我们采用RT-qPCR 和ELISA 检测的肺组织和外周血中TNF-α、IL-6 和IL-1β mRNA 和蛋白的表达水平。实验结果发现,TRALI 大鼠肺组织和外周血中相 关炎性细 胞因 子TNF-α、IL-6 和IL-1β 的mRNA 和蛋白的表达水平均明显升高(图2、图3)。
PI3K/Akt/mTOR 是酪氨酸激酶级联相关的一条重要的信号通路,参与了细胞的存活、增殖、代谢、迁移,并且还与自噬和 凋亡密切相关[15]。此信号通路一旦被激活,会通过多种炎症过程参与肺脏的炎症浸润和组织破坏,造成肺部的损伤。相关文献报道,抑制PI3K/Akt/mTOR 通路肺损伤的炎症水平可明显降低[16]。本实验结果发现,TRALI 发生发展过程中PI3K/Akt/mTOR 信号通路被活化,Akt和mTOR 蛋白表达水平均明显增加,通过增加TNF-α、IL-6 和IL-1β 等炎症介质的表达参与了肺损伤的发生。
另外,在炎症性相关疾病发展中,mTOR 已被认为是发展靶向药物的关键治疗靶点[17]。近年来,研究者发现不同诱导因素引起的急性肺损伤中,mTOR 信号通路是一把双刃剑。一方面可以发挥对急性肺损伤的保护性作用:通过抑制自噬减少促炎细胞浸润。另一方面也可以诱导急性肺损伤的加重:通过激活自噬促使细胞凋亡和相关炎症因子的大量分泌。目前关于mTOR 信号通路调控肺损伤过程中具有双面性的调控机制还不清楚。
自噬是细胞通过溶酶体降解各种大分子物质并破坏细胞器的一种行为。近年来,自噬在调节宿主炎症和细胞凋亡中的作用尚未完全阐明,但可以明确的是,自噬可以影响炎性疾病的进展和预后[18]。自噬在下列情况下可以抑制凋亡:一方面是低营养情况下促进细胞存活;另一方面是可清除受损线粒体,降低活性氧含量[19]。与上述结论相一致,本实验结果发现TRALI 发生的早期(6 h 内),机体组织处于低能量和低营养状态,自噬被激活后明显抑制了Bax 和Caspase3 蛋白的表达,却促进了Bcl-2 蛋白的表达。随后mTOR 的激活明显抑制了自噬从而加重了肺组织的炎症反应。由此说明,在TRALI 发生发展的早期阶段(6 h),机体利用自噬和凋亡的级联反应最终诱导了肺组织炎性细胞浸润、急性肺损伤的发生。田雪[20]提到TRALI 的疾病进程涉及mTOR 信号通路的上调激活,预防性使用mTOR 特异性抑制剂(Rapamycin,RAPA)可在一定程度上缓解小鼠肺损伤的严重程度,可能为TRALI预防治疗的潜在方式。
然而,我们需要强调的是,对于TRALI 患者来说,如果未进行临床干预,在晚期阶段则表现为肺组织自噬被激活后诱导了显著的细胞凋亡和细胞因子风暴,肺损伤明显加重[17]。总之,自噬作用与疾病的诱导因素类型相关,既有有害作用[21-22]又有细胞保护作用[23-24],而具体机制尚未研究清楚。自噬诱导是利是弊,取决于疾病的类型或阶段。mTOR 作为一个有潜力的药物靶点,由于其作用机制的复杂性,界定其发挥保护和损伤作用的确切时间靶点,选择最佳用药时间是临床防控TRALI 发生发展的重要手段。

