IBS-D 大鼠肠道菌群-短链脂肪酸代谢轴变化特点及丁酸钠干预作用研究
占 凯吴皓萌郑 欢秦书敏杨元明黄绍刚
(1.广州中医药大学第二附属医院,广州 510120;2.广州中医药大学东莞医院,广东 东莞 523000;3.省部共建中医湿证国家重点实验室,广州 510120)
肠易激综合征(irritable bowel syndrome,IBS)是最常见的功能性肠病,以腹痛、腹胀或腹部不适并伴有排便习惯改变为主要临床表现,基于罗马IV 标准下的全球患病率约为3.6%~4.0%[1],中国的患病率约为1.4%~11.5%[2]。IBS 有四种亚型,腹泻型肠易激综合征(diarrhea-predominant irritable bowel syndrome,IBS-D)是IBS 最主要的亚型,约占IBS 患者数的21.0%~74.1%[2]。肠道菌群作为众多致病因素和机制的交汇点参与了IBS 的发病过程。既往研究显示,与健康人群相比,IBS 患者存在明显肠道菌群失调,且在各亚型IBS 患者中,以IBS-D 肠道菌群失调最为严重[3-4]。短链脂肪酸(short-chain fatty acids,SCFAs)主要包括乙酸、丙酸、丁酸和戊酸等,是结肠细菌通过膳食碳水化合物和一些氨基酸发酵的主要代谢产物,与机体内脏高敏[5]、宿主肠道免疫[6]及肠道屏障功能[7]等密切相关。本研究旨在通过16S rRNA 测序和靶向代谢组学分析IBS-D大鼠模型的肠道菌群-短链脂肪酸代谢轴变化特点,以及探讨丁酸钠对该轴的影响。
1 材料和方法
1.1 实验动物
17 只SPF 级Wistar 雄性大鼠,7 周龄,体重为(200±20)g,购买于南方医科大学实验动物中心[SCXK(粤)2021-0041]。本课题动物实验经广州中医药大学第二临床医学院(广东省中医院)伦理委员会批准(BF2020-028-01),实验动物被饲养于广东省中医院科研楼动物中心[SYXK(粤)2018-0094],饲养环境温度(22±1)℃,湿度(50±10)%,12 h/12 h 明暗交替周期,并提供足够的食物和水,所有动物适应性饲养1 周后开始实验,实验操作遵循3R 原则。
1.2 主要试剂与仪器
丁酸钠(美国MedChemExpres 公司,批号:27305);醋酸(上海阿拉丁公司,货号:A298827);DNA 抽提试剂盒(上海索宝生物科技有限公司,货号:D5625-01);FastPfu 聚合酶(中国环凯微生物公司,货号:HKE031-01A)。
超微量分光光度计(美国 Thermo Fisher Scientific 公司,型号:NanoDrop2000);MISEQ 测序仪(美国Illumina 公司,型号:Illumina Miseq);PCR仪(美国Applied Biosystems 公司,型号:Applied Biosystems GeneAmp®9700 型);小型离心机(德国,Eppendorf 公司,型号:Eppendorf 5430 R);粉碎研磨仪(上海万柏生物科技有限公司,型号:TL-48R)。
1.3 实验方法
1.3.1 实验动物分组
将17 只SPF 级Wistar 雄性大鼠随机分为正常组(5 只)、模型组(5 只)、丁酸钠腹腔注射组(7只)。
1.3.2 束缚应激+醋酸灌肠建立IBS-D 大鼠模型
大鼠适应饲养1 周后,予以4%醋酸灌肠1 次,具体方法参考文献[8]:灌肠前大鼠禁食24 h,乙醚麻醉后,插入涂抹有润滑剂的灌胃针8 cm,注入1 mL 4%(40 mL/L)醋酸溶液,缓慢拔出灌胃针,用手压迫肛门并将大鼠尾巴抬高30 s, 30 s 后注入1 mL 0.9%NaCl 溶液冲洗,放回笼中自由活动进食水。与此同时,除正常组外的其余2 组大鼠,每日予自制束缚袋(专利号:ZL201820882292.X)束缚2 h(大鼠无法自由活动,可正常呼吸和排便),每天上午10:00~12:00,持续3 周。
1.3.3 给药方法及剂量
造模开始后,丁酸钠腹腔注射组即予以丁酸钠腹腔注射干预14 d,500 mg/(kg·d)[9]。其余组予以相对应剂量生理盐水腹腔注射。
1.3.4 取材
粪便:给药结束后,按照无菌原则收集大鼠粪便,即收集粪便时使用高温高压消毒的镊子、Eppendorf(EP)管及无菌培养皿。带好无菌手套后,提起大鼠尾巴,用准备好的75%酒精棉球消毒大鼠肛周,刺激大鼠排便至无菌培养皿中,用无菌镊子将粪便转移至1.5 mL EP 管中,避免不同组间交叉污染,标号,置于液氮罐中,随后转移至-80℃冰箱中储存待检。
1.3.5 指标检测及方法
(1)各组大鼠一般指标测定
观察模型组与正常组大鼠形态变化,包括皮毛色泽、活动能力变化、神态、活动度、粪便、饮食等情况;每周测量大鼠体重变化、进食量、饮水量及排便情况。
(2)腹壁撤退反射(abdominal withdrawal reflex,AWR)评分
在给药结束后第1 天,用自制的结肠测压计检测各组大鼠腹壁撤退反射。检测前轻轻触碰大鼠肛门,排便后将涂抹有石蜡油的球囊塞入肛门内8 cm,将连接球囊的管子固定在大鼠尾巴根部。待大鼠平静后,缓慢向球囊充气至气压为20、40、60 及80 mmHg,20 s 内观察大鼠腹壁对肠腔球囊扩张刺激的反应,根据AWR 评分标准进行评分。
(3)粪便含水率测定
给药结束后当天收集所有大鼠的粪便,用离心管采集大鼠粪便,微量天平称重并记录后,放置于烘箱2 h,之后再次称重并记录。粪便含水率=(烘干前粪便重量-烘干后粪便重量)/烘干前粪重量×100%。
(4)大鼠肠道菌群16S rRNA 检测
收集大鼠粪便,用DNA 提取试剂盒提取粪便中的总DNA 并检测其提取质量,然后用338F 和806R引物对V3~V4 可变区进行PCR 扩增。使用2%琼脂糖凝胶回收PCR 产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,UnionCity,加利福尼亚州,美国)进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega, 美国)进行检测定量。根据Illumina MiSeq 平台(Illumina,圣地亚哥,美国)标准操作规程将纯化后的扩增片段构建PE 2×300 的文库。利用Illumina 公司的Miseq PE300 平台进行测序。
(5)短链脂肪酸气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)检测
量取乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸纯标准品适量,用乙醚配制成14 个混合标准浓度梯度。色谱条件:色谱柱Agilent HP-INNOWAX 毛细管柱(30 m×0.25 mm ID×0.25 μm);分流进样,进样量1 μL,分流比10 ∶1。进样口温度250℃;离子源温度230℃;传输线温度250℃,四极杆温度150℃。程序升温起始温度90℃;然后以10℃/min升温至120℃;再以5℃/min 升温至150℃;最后以25℃/min 升温至250℃维持2 min。载气为氦气,载气流速1.0 mL/min。MS 条件:电子轰击电离源,SIM 扫描方式,电子能量70 eV。取大鼠粪便上清液上机测试验证方法可行性,待总离子流色谱图明确8 个短链脂肪酸均能够区分开后,对SCFA 标准液的浓度系列分别进行GC-MS 检测。经精密度、重复性、回收率检测无误后对所有样品进行定量分析。SCFA 含量(μg/g)= 浓度(μg/mL)×0.5/取样量(mg)×1000。
1.4 统计学方法
采用SPSS 23 软件进行数据处理,画图采用Prism 8 软件,符合正态分布的数据以平均数±标准差(±s)表示,不符合正态分布的数据采用M(P25,P75)表示。符合正态分布且方差齐性的数据,两间比较采用t检验;符合正态分布但方差不齐的数据,两间比较采用t’检验;不符合正态分布的数据,两组间比较采用Mann-WhitneyU秩和检验,以P<0.05 为具有显著性差异。
2 结果
2.1 一般状态观察
与正常组相比较,给予4%醋酸灌肠及束缚应激后,大鼠进食量、饮水量减少,自主活动减少,反应迟钝、蜷缩、扎堆,毛发凌乱,闻声易惊,肛周污秽,持续排出浅棕色不成形大便,无血便,伴有少量黏液。与模型组对比,经丁酸钠干预后,进食量、饮水量稍增加,大鼠大便性状稍成形,自主活动增加,毛色稍光泽。
2.2 体重增长情况
如图1 所示,与正常组相比较,模型组大鼠体质量呈负增长,在造模第1 周最为明显,之后体重呈缓慢增长趋势。丁酸钠干预后,大鼠体重与模型组大鼠无明显差异,但呈平稳增长。提过提示腹泻可使大鼠体重明显降低,丁酸钠可在一定程度上缓解束缚应激联合醋酸灌肠导致的腹泻,改善IBS-D 大鼠体重。

图1 各组大鼠体重变化情况Figure 1 Weight change of rats in each group
2.3 腹壁撤退反射(AWR)评分
AWR 实验是评估大鼠内脏高敏感应用最广泛的手段。如表1 所示,与正常组相比较,模型组大鼠在40 mmHg、60 mmHg 及80 mmHg 压力的AWR 评分均升高,差异具有统计学意义,提示内脏高敏诱导成功。与模型组相比较,丁酸钠组大鼠在60 mmHg 压力的AWR 评分较模型组显著下降,在40 mmHg 和80 mmHg 压力的AWR 评分虽均有下降的趋势,但均无统计学意义。
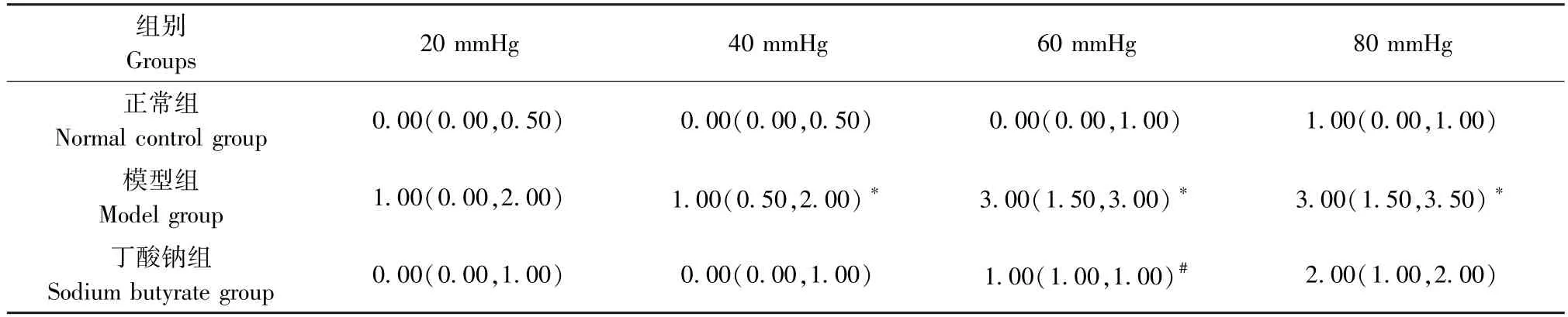
表1 各组大鼠AWR 评分结果Table 1 AWR score of rats in each group
2.4 粪便含水率
在造模期间,醋酸灌肠联合束缚应激所诱导的大鼠均出现不成形大便,腹泻率为100%。与正常组相比,模型组粪便含水率明显升高;经丁酸钠干预后,丁酸钠组大鼠粪便含水率较模型组降低,差异显著。具体如图2 所示。

注:与模型组比较,***P<0.001。图2 各组大鼠粪便含水率Note.Compared with model group,***P<0.001.Figure 2 Water content in feces of rats in each group
2.5 各组大鼠肠道菌群测序
2.5.1 α 多样性
α 多样性是评估菌群丰富度和均匀度的指标,如图3 所示,与正常组相比,模型组大鼠Chao1 指数、Faith-pd 指数及Observed-otus 指数有下降的趋势,但均无统计学差异。与模型组比较,丁酸钠组以上指数虽有增加的趋势,但也均无统计学意义。Shannon 指数在各组之间均无明显变化。

图3 各组大鼠肠道菌群α 多样性Figure 3 α diversity of gut microbiota in each group of rats
2.5.2 β 多样性
基于unweighted-unifrace 距离来进行PCoA 分析(图4A)和NMDS 分析(图4B),结果均显示正常组、模型组及丁酸钠组粪便样本距离接近,提示三组大鼠粪便群落组成结构相似,β 多样性无明显差异。

图4 各组大鼠肠道菌群β 多样性Figure 4 β diversity of gut microbiota in each group of rats
2.5.3 各组大鼠肠道菌群门、属水平变化情况
在门水平(图5A),三组大鼠均以厚壁菌门(Firmicutes)、糖细菌门(Saccharobacteria)、拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)、放线菌门(Actinobacteria)及变形菌门(Proteobacteria)为主要组成,其中厚壁菌门(Firmicutes)均占比70%以上。与正常组比较,模型组厚壁菌门、拟杆菌门及变形菌门均有下降的趋势,但无统计学差异。与模型组比较,丁酸钠有逆转上述菌群下降的趋势。在属水平(图5B),与正常组比较,我们发现模型组乳酸杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus)及双歧杆菌属(Bifidobacterium)等相对丰度明显下降,而布劳特氏菌属(Blautia)相对丰度明显升高;经丁酸钠干预后,乳酸杆菌属、瘤胃球菌属及双歧杆菌属相对丰度升高但无统计学差异,布劳特氏菌属相对丰度明显下降(图5C、5D)。

注:与模型组比较,*P<0.05,**P<0.01。图5 各组大鼠肠道菌群门、属水平变化情况Note.Compared with model group,*P<0.05,**P<0.01.Figure 5 Relative abundances of gut microbiota at phylum and species level in each group of rats
2.6 各组大鼠粪便短链脂肪酸含量测定
研究结果显示,与正常组比较,模型组大鼠粪便乙酸含量明显升高,丁酸及戊酸含量显著降低,丙酸、异丁酸及异戊酸含量无明显差异;与模型组比较,我们发现腹腔注射丁酸钠可显著提高大鼠肠道丁酸及戊酸的含量,而对乙酸的表达无明显作用(图6)。

注:与模型组比较,*P<0.05,**P<0.01。图6 各组大鼠粪便SCFA 含量Note.Compared with model group,*P<0.05,**P<0.01.Figure 6 Fecal SCFA content in each group of rats
2.7 肠道菌群与SCFAs 相关性
如图7 所示,Spearman 相关性分析显示,芽孢杆 菌 属 (Elusimicrobium)、 考 拉 杆 菌 属(Phascolarctobacterium) 及 聚 集 杆 菌 属(Aggregatibacter)与丁酸呈显著正相关。萨特氏菌属(Sutterella)、Reyranella与戊酸呈显著负相关,而芽孢杆菌属(Elusimicrobium)与戊酸呈显著正相关,具有统计学意义。

注:横轴为SCFAs,纵轴为肠道细菌。通过计算获得R 值(秩相关)和P 值。R 值在图中以不同颜色展示正相关(红色)或负相关(蓝色),*P<0.05,**P<0.01。图7 肠道细菌与SCFAs 相关性分析Note.Horizontal axis is SCFAs, and the vertical axis is gut microbiota.R value (rank correlation) and P value are obtained by calculation.R value shows positive correlation (red) or negative correlation (blue) in different colors,*P<0.05,**P<0.01.Figure 7 Correlation between gut microbiota and SCFAs
3 讨论
本研究结果显示,4%醋酸灌肠联合束缚应激诱导的IBS-D 大鼠模型可以成功模拟IBS-D 患者的腹泻及内脏高敏表型,且该类大鼠模型表现为以乳酸杆菌属及双歧杆菌属等相对丰度明显降低、布劳特氏菌属相对丰度升高为特征的粪便菌群失调;和以粪便乙酸含量升高,丁酸、戊酸含量降低为特征的SCFAs 代谢失调。与此同时,我们发现丁酸钠可能通过改善肠道菌群-SCFAs 代谢轴失调而缓解IBSD 大鼠腹泻及内脏高敏表型。
IBS-D 是目前公认的与肠道微生态联系最为密切的疾病之一。人体分布的共生微生物有80%生活在消化道内,细胞总数超过1014个,约为人体自身细胞数量的1.3~2.3 倍[3]。罗马IV 指出肠道菌群失调是IBS-D 的重要机制之一,肠道菌群结构及数量的改变是肠道内脏高敏感、免疫过度激活、肠动力增强、低度炎性反应状态及黏膜屏障功能受损等肠道稳态失调的重要诱因,参与IBS 重要病理基础的构成[10-11]。本研究结果显示三组大鼠肠道菌群的α 多样性差异无统计学意义,这与目前在IBSD 患者发现的肠道菌群多样性变化是一致的[12-14]。但是在属水平,我们发现模型组乳酸杆菌属(Lactobacillus)及双歧杆菌属(Bifidobacterium)相对丰度明显下降。研究表明,乳酸杆菌(Lactobacillus)是人体肠道中一种丰富的益生菌,不仅具有营养功能,还具有调节肠道功能紊乱、调节免疫及抗肿瘤等作用[15-16]。一些研究还证实乳酸杆菌可提高黏膜屏障功能,主要通过以下三个途径[17]:(1)增加紧密连接蛋白的表达;(2)促进黏液分泌基因的表达,从而减少病原体与上皮细胞的结合;(3)抑制炎症的发展。目前关于乳酸杆菌(Lactobacillus)在抑制肠道炎症方面的研究众多,如在葡聚糖硫酸酯钠和2,4,6-三硝基苯磺酸诱导的结肠炎动物模型、溃疡性结肠炎患者及克罗恩病患者的治疗中均显示出了良好的抗炎效果;这种抗炎作用可通过上调Toll 样受体的负调节因子抑制丝裂原活化蛋白激酶和NF-κB 信号通路的激活实现。而双歧杆菌属不仅可以刺激γ-氨基丁酸的产生调节脑-肠轴,从而改善焦虑和抑郁[18];还可以通过调节Treg/Th2 反应和肠道菌群重塑改善葡聚糖硫酸钠诱导的慢性结肠炎。予以丁酸钠干预后,IBS-D 大鼠肠道乳酸杆菌属及乳酸杆菌属相对丰度均有增加的趋势,表明丁酸钠有增加IBS-D 益生菌的潜力。近期研究表明,IBS 患者布劳特氏菌属(Blautia)相对丰度显著增加[19],患者腹泻症状与该菌丰度呈正相关,被认为是肠道“失衡”的标志[20],其诱发IBS-D 的机制可能与诱导肠道的炎症激活,继而引起肠黏膜屏障损伤和内脏高敏[21]。另外,布劳特氏菌属是肠道产乙酸的主要菌属[22],而乙酸是诱导IBS-D 模型的常用物质之一。我们发现布劳特氏菌属(Blautia)在IBS-D 大鼠模型中明显升高,而丁酸钠可降低其相对丰度,提示丁酸钠改善IBS-D 腹泻及内脏高敏可能与降低布劳特氏菌属相对丰度有关。
菌群的失调必然会导致其代谢产物的改变。SCFAs 是肠道菌群的重要代谢产物之一,在IBS-D的发病机制中占据着重要地位。本研究检测了三组大鼠粪便中乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸六种SCFAs 的含量。本研究中丁酸钠干预后IBS-D 大鼠肠道乙酸含量并未下降,或者其实丁酸钠有下调乙酸作用,但前期造模时采用了乙酸灌肠,外源性补充的乙酸掩盖了丁酸钠的效应作用,因此无法明确丁酸钠对乙酸的作用,这也是本实验的不足之处。因此,后续实验需要评判乙酸在IBSD 的作用时,可考虑束缚应激联合番泻叶或大黄灌胃等方法。
丁酸在胃肠道中起到多种益处,丁酸阴离子很容易作为主要的能量来源被肠上皮细胞吸收,其本身还参与了肠道免疫调节和抗炎过程,是结肠细胞增殖和凋亡、胃肠运动的重要调节剂[23]。既往研究表明,丁酸可能通过多种途径维持肠上皮屏障完整的功能而改善IBS-D 腹泻:(1)抑制组蛋白去乙酰化酶和外周促肾上腺皮质激素释放因子受体的表达[24];(2)参与合成前列腺素E1 促进MUC2 基因的表达, 使MUC2 分泌增加[25];(3)抑制结肠上皮细胞促炎通路的激活,下调炎性因子如 NF-κB、TNF-α、IFN-γ、TLR2 等的表达[26]。给予IBS 患者移植健康人群的粪菌液可显著提高其粪便丁酸、戊酸表达水平,且应答者丁酸水平与IBS-SSS 评分、疲劳评定量表评分呈负相关[23]。动物实验显示丁酸钠可下调IRAK1 改善肠易激综合征内脏高敏感[28]。本研究中IBS-D 大鼠粪便丁酸、戊酸含量明显下降,予以腹腔注射丁酸钠后,丁酸、戊酸含量明显升高,结果与上述研究保持一致。针对戊酸而言,仅在IBD 患者中发现戊酸含量降低[29],还需要大量研究来证实其在IBS-D 中的作用,本实验也为今后进一步深入研究提供依据。
丁酸在肠道中主要由梭菌属、柔嫩梭菌属、罗斯式菌属、真菌属及丁酸弧菌属产生,而这些产丁酸细菌的代谢能力还与其他肠道微生物的存在有关,尤其是乳酸菌和双歧杆菌[30]。研究表明,口服乳酸杆菌能够增加肠道内产丁酸细菌罗斯式菌属的丰度,并显著增加丁酸含量[31]。另外,霍式真杆菌不能利用复杂的低聚糖和多糖,但低聚果糖的存在可以增加双歧杆菌的丰度,双歧杆菌产生的乳酸可以被霍式真杆菌利用转化为丁酸盐[32]。本实验中发现丁酸钠有增加IBS-D 肠道乳酸菌和双歧杆菌的趋势,给我们今后的研究有一定提示作用,即丁酸钠可能通过乳酸菌和双歧杆菌间接发挥增加调控产丁酸菌的作用,从而改善IBS-D 症状,但可能由于样本量相对较少,结果无显著性,后续实验需进一步验证。与此同时,相关性分析显示丁酸及戊酸的表达水平与芽孢杆菌属(Elusimicrobium)、考拉杆菌 属 (Phascolarctobacterium)、 聚 集 杆 菌 属(Aggregatibacter)及萨特氏菌属(Sutterella)密切相关,这为今后进一步研究肠道菌群与SCFAs 的关系奠定了重要基础。
综上所述,IBS-D 大鼠存在肠道菌群-短链脂肪酸代谢轴失调,丁酸钠可通过改善该轴失调达到缓解IBS-D 腹泻和内脏高敏的作用,但由于本实验主要通过菌群及代谢角度阐释丁酸钠与IBS-D 的关系,未进行相关分子生物学检测及机制研究,后续实验据此进一步完善。

