基于UPLC-TQ-MS 探究野鸦椿酸在Caco-2 细胞单层模型上的吸收转运研究
王 宁谢 莉丁文欢田 莉
(1.新疆医科大学中医学院,乌鲁木齐 830011;2.新疆维吾尔自治区药品检验研究院,乌鲁木齐 830011;3.新疆名医名方与特色方剂学重点实验室,乌鲁木齐 830011)
野鸦椿酸(euscaphic acid,EA)又名蔷薇酸,是一种存在于蔷薇科类植物(如蔷薇果、金樱子等[1])中的三萜酸类化合物,分子式C30H48O5,分子量488.70,结构式见图1,其不溶于水,可溶于甲醇、氯仿、DMSO 等有机溶剂[2]。
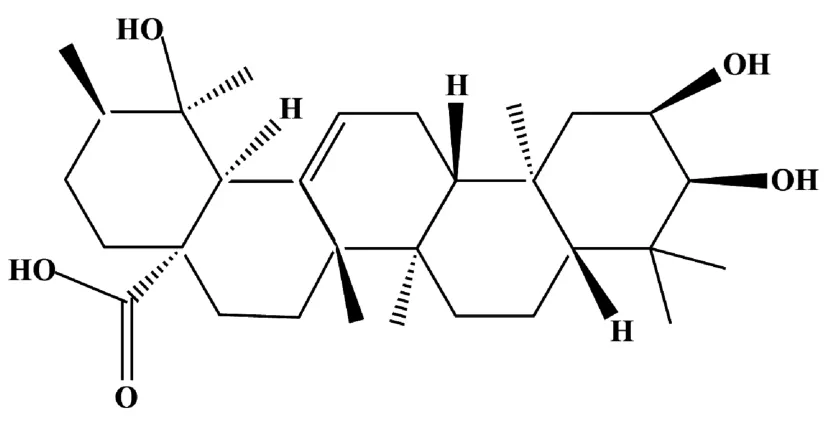
图1 野鸦椿酸结构式Figure 1 Structural formula of euscaphic acid
野鸦椿酸具有抗氧化[3]和抗癌[4-5]等药理活性,且无毒、无致突变作用[6]。目前,关于野鸦椿酸的吸收特性及体内过程研究未见文献报道。来源于人类结肠和直肠癌的Caco-2 细胞经体外培养后可形成与小肠上皮细胞具有相似的微绒毛结构及细胞间紧密连接的单细胞层,且形态学、标志酶的功能表达及渗透特征与小肠上皮细胞类似,可作为模拟小肠上皮细胞吸收转运的体外吸收模型,目前已被广泛应用于药物的肠吸收机制研究[7]。本研究采用Caco-2 细胞模型研究野鸦椿酸的吸收特性,为其后续药效研究以及体内过程评价提供参考。
1 材料和方法
1.1 细胞株
Caco-2 人结直肠腺癌细胞株购自于武汉博士德生物工程有限公司,实验所用细胞传代数在22~42 代内(货号:CX2266)。
1.2 主要试剂与仪器
野鸦椿酸对照品(批号:YRY097-210101,纯度≥98%),购自成都仪捷睿生物科技有限公司;Transwell®12 孔转运小室(批号:5662)、12 孔板、96孔板、培养瓶均购自美国Costar 公司;胎牛血清(fetal bovine serum, FBS)(批号:FND622)购自依科赛生物科技有限公司; DMEM 培养基(批号:7121572)、非必需氨基酸(批号:11140050)、青霉素-链霉素双抗液(批号:10378016)、胰蛋白酶(批号:25200056)、D-Hank’s 平衡盐溶液(批号:88284)均购自美国Gibico 公司;荧光素钠(批号:F8140)、维拉帕米(批号:IV0040)、环孢素A(批号:SC5120)、EGTA(批号:E8050)、无菌二甲基亚砜(DMSO)(批号:D8371)均购自索莱宝科技有限公司;甲醇、乙腈(色谱纯)均购自美国Fisher Scientific 公司。超高效液相色谱-三重四极杆质谱联用仪(美国Waters公司);Millicell-ERS 电位仪(德国Meck millipore);Milli-Q 超纯水系统(美国Millipore 公司);Motic AE51 荧光倒置显微镜( 日本尼康公司);MULTISKAN FC 酶标仪(美国赛默飞世尔科技公司);HY-1 型快速漩涡混合器、pHS-5 型精密pH 计(上海仪电科学仪器有限公司)。
1.3 实验方法
1.3.1 对照品溶液的配制
精密称取野鸦椿酸5.00 mg,DMSO 溶解完全,再用HBSS 稀释至浓度为100 μg/mL 储备液,备用(DMSO<0.1%)。
1.3.2 色谱及质谱条件
色谱条件:ACQUITY UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm);柱温:30℃;样品室温度:4℃;流动相:A 相10 mmoL/L 乙酸铵;B 相为乙腈;洗脱方式:梯度洗脱(0~1 min,97% A;1~3 min,97% A→30% A;3~4 min,30% A→97% A;4~6 min,97% A);流量:0.3 mL/min;进样体积:5 μL[8]。
质谱条件:电喷雾离子源,负离子扫描模式;离子源温度150℃;锥孔反吹气为氮气(纯度>99.99%),流量50 L/h;脱溶剂气为氮气,温度350℃,流量为650 L/h;多反应监测(MRM)模式采集,见表1[1]。

表1 野鸦椿酸质谱条件Table 1 Escaphic acid mass spectrometry conditions
1.3.3 野鸦椿酸方法学考察
用甲醇将野鸦椿酸储备液梯度稀释制备系列浓度标准溶液,按照“1.3.2”项下条件测定,绘制标准曲线,并考察精密度、重复性、稳定性和加样回收率,计算RSD 值。
1.3.4 Caco-2 细胞模型验证及细胞毒性试验
将Caco-2 细胞以2.5×105/mL 密度接种至Transwell®12 孔板中,每孔接种0.5 mL,通过测定电阻值(TEER)和荧光素钠的表观渗透系数(Papp值)对细胞模型进行验证[9]。
采用MTT 比色法考察野鸦椿酸对Caco-2 细胞的毒性,按照公式(A实验组-A空白组)/(A对照组-A空白组)×100%,计算细胞的存活率[10]。
1.3.5 野鸦椿酸摄取试验
(1)细胞模型建立
将Caco-2 细胞以2.5×105/mL 密度接种于12孔板中,每孔1 mL,连续培养18 d 后进行摄取试验。
(2)时间对摄取的影响
12 孔板中每孔加入1 mL 25 μg/mL 的野鸦椿酸溶液,分别在0、10、30、60、90、120、150、180、210 min 取样测定,每个时间点设置3 个复孔,考察时间对摄取的影响。
(3)温度对摄取的影响
12 孔板中每孔加入1 mL 25 μg/mL 的野鸦椿酸溶液,分别置于4℃、25℃、37℃条件下中孵育180 min,每个温度设置3 个复孔,考察温度对摄取的影响。
(4)摄取样品的制备
将摄取实验结束后的每孔加入0.5 mL 胰酶消化细胞,1000 r/min 离心5 min,收集沉淀,加入RIPA 细胞裂解液于冰上裂解,水浴蒸干,甲醇复溶,12 000 r/min 离心10 min,取上清液按照“1.3.2”项下条件测定。
1.3.6 野鸦椿酸转运试验
(1)野鸦椿酸转运液的配制
精密吸取一定量的野鸦椿酸储备液稀释制成12.5、25、50 μg/mL,作为野鸦椿酸双向转运的低、中、高浓度。并制备每毫升分别含有0.100 μmoL的盐酸维拉帕米(Ver)、0.099 μmoL 环孢菌素A(CsA)和0.025 μmoL 乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)低、中、高浓度双向转运液。
(2)细胞模型建立
采用12 孔Transwell ®板进行双向转运实验,包括AP 侧→BL 侧(即B→A,吸收转运)和BL 侧→AP 侧(即A→B,分泌转运)[11]。
A→B 转运:将Caco-2 细胞以2.5×105/mL 密度每孔接种0.5 mL 于Transwell®12 孔板中,连续培养18 d 后,在AP 侧(作为供给侧)加入0.5 mL 的含药HBSS 溶液,在BL 侧(作为接受侧)加入1.5 mL 空白液,分别在15、30、60、90、120、150 和180 min 时从BL 吸取200 μL 同时补加200 μL HBSS 缓冲液,水浴蒸干,甲醇复溶,12 000 r/min 离心10 min,取上清液按照“1.3.2”项下条件测定,分别考察不同浓度,不同抑制剂,螯合剂和不同pH 对野鸦椿酸双向转运的影响。
B→A 转运:类似A→B 转运。在BL 侧(作为供给侧)加入1.5 mL 的含药HBSS 溶液,在AP 侧(作为接受侧)加入0.5 mL HBSS 空白液,按“A→B转运”方法取样测定。
1.3.7 计算公式
TEER(Ω·cm2)= (测定电阻-空白小室电阻)×Transwell 小室面积(1.12 cm2)
加入空白溶液的一侧为接收侧,接收侧中的药量视为其吸收量(Qr)。A→B 转运试验中,B 侧室在任意时间点吸收的药量记为(QrBi);B→A 转运试验中,A 侧室在任意时间点吸收的药量为(QrAi),具体计算见下公式:
A→B 转运:Qr Bi=0.2×(Cr1+Cr2+Λ+Cr(i-1))+1.5×Cri
B→A 转运:Qr di=0.2×(Cr1+Cr2+Λ+Cr(i-1))+0.5×Cd i
公式中,1.5 为B 侧室所加的供试液体积(mL),0.5 为A 侧室所加的供试液体积(mL),0.2为每次的取样体积(mL),Cri为第i个时间点接受室的实测浓度(μg/mL)。
表观渗透系数Papp(cm/s)公式计算如下:
其中dQ/dt 为单位时间药物转运量(μg/s),是以时间(s)为横坐标,药物累计吸收药量(μg)为纵坐标所得直线的斜率;A为12 孔Transwell ®膜表面积(1.12 cm2),C0为供给侧中加入药物的初始浓度(μg/cm)。
外排比率(ER)公式计算如下:若比值大于2,则表明药物在Caco-2 细胞中的转运具有明显的方向性,有外排转运体参与转运。
1.4 统计学方法
采用SPSS 20.1 软件对数据进行方差分析(ANOVA),结果以平均数±标准差(±s)表示,组间差异的比较采用t检验,当P<0.05 时,判定差异具有统计学意义。
2 结果
2.1 野鸦椿酸方法学考察
2.1.1 线性考察
野鸦椿酸的标准曲线为A=30214C+19246(r=0.9999),浓度范围为0.10~32.00 μg/mL,见图2。

图2 野鸦椿酸的MRM 质谱图Figure 2 MRM mass spectra of euscaphic acid
2.1.2 精密度、重复性、稳定性和加样回收率
野鸦椿酸的精密度、重复性、稳定性均有RSD值<2.00%,平均回收率为99.75%, RSD 值为1.14%,表明该测定方法准确度高,见表2。

表2 野鸦椿酸的加样回收率(n=6)Table 2 Recovery of euscaphic acid
2.2 Caco-2 细胞模型评价及细胞毒性试验
2.2.1 Caco-2 细胞模型的评价
Caco-2 细胞细胞培养至20 d 时,TEER 值为703 Ω/cm2,荧光素钠的表观渗透系数Papp值为(4.06±0.17)×10-7cm/s,表明所建立Caco-2 细胞模型符合摄取和转运实验要求。
2.2.2 野鸦椿酸细胞毒性实验
野鸦椿酸的浓度在50 μg/mL 以内,Caco-2 细胞的存活率在95%以上。在此基础上,双向转运的低、中、高浓度分别设置为12.5、25、50 μg/mL。
2.3 野鸦椿酸摄取实验
2.3.1 时间对摄取的影响
在0~180 min 内,随着时间延长野鸦椿酸的吸收量逐渐增加,180 min 吸收量为(8.38±0.87)μg/mg,之后呈下降趋势,后续考察时间设为180 min,见图3。

图3 野鸦椿酸不同时间的摄取量(n=3)Figure 3 Content of different time of intake euscaphic acid
2.3.2 温度对摄取的影响
结果表明,随着温度升高,野鸦椿酸的吸收量逐渐增加,37℃吸收量为(8.38±0.87)μg/mg,后续考察温度设为37℃,见图4。

图4 不同温度下野鸦椿酸的摄取量(n=3)Figure 4 Content for different temperature intake euscaphic acid
2.4 野鸦椿酸双向转运实验
2.4.1 浓度对野鸦椿酸双向转运的影响
野鸦椿酸的Qr值和Papp值随着浓度增加而增加,并呈正相关,且Papp值>10-6cm/s;A→B 的Qr值明显低于B→A 的Qr值,RB→A/A→B值范围为1.20~1.40,见表3。表明野鸦椿酸吸收良好,主要转运方式为被动转运,且无明显方向性。

表3 不同浓度野鸦椿酸对Caco-2 细胞模型Qr、Papp 和RB→A/A→B 值的影响(n=3)Table 3 Effect of different concentrations of euscaphic acid on Qr, Papp and RB→A/A→B values in Caco-2 cell model
2.4.2 P-gp 抑制剂对野鸦椿酸双向转运的影响
加入P-糖蛋白(P-gp)抑制剂Ver 和CsA 后,野鸦椿酸双向转运的Qr值和Papp值无明显变化,RB→A/A→B值范围为1.20~1.40,表明野鸦椿酸不是P-gp 的底物,见表4。

表4 P-gp 抑制剂对野鸦椿酸在Caco-2 细胞模型Qr、Papp 和RB→A/A→B 值的影响(n=3)Table 4 Effect of P-gp inhibitors on euscaphic acid in Caco-2 cell model Qr, Papp and RB→A/A→B values
2.4.3 EGTA 螯合剂对野鸦椿酸双向转运的影响
加入EGTA 螯合剂后,野鸦椿酸双向转运的Qr值和Papp值无明显变化,RB→A/A→B值范围为1.10~1.40,表明野鸦椿酸不存在细胞旁路转运,见表5。

表5 EGTA 螯合剂对野鸦椿酸在Caco-2 细胞模型Qr、Papp 和RB→A/A→B 值的影响(n=3)Table 5 Effect of EGTA on euscaphic acid in Caco-2 cell model Qr, Papp and RB→A/A→B values
2.4.4 pH 对野鸦椿酸双向转运的影响
在设定的pH 中,野鸦椿酸的Qr值和Papp值存在明显差异(P<0.01),见表6。Qr值和Papp值均有pH=6.00>pH=5.00>pH=7.20,RB→A/A→B值范围为0.80~1.40,表明弱酸性环境有利于野鸦椿酸的转运。

表6 pH 值对野鸦椿酸在Caco-2 细胞模型Qr、Papp 和RB→A/A→B 值的影响(n=3)Table 6 Effect of pH on euscaphic acid in Caco-2 cell model Qr, Papp and RB→A/A→B values
3 讨论
Caco-2 单层细胞模型可模拟小肠上皮细胞的形态和功能,其对药物的吸收特性与药物在肠道的吸收相关性良好,因此,建立和验证可靠、稳定、重复性好的Caco-2 细胞体外吸收模型是进行药物吸收特性的基础,并以细胞形态学特征、TEER、Papp和碱性磷酸酶活性等指标进行验证[12]。本研究建立了Caco-2 单层细胞吸收模型,并评估了细胞形态学、TEER 和荧光素钠Papp值等指标,表明建模成功,符合后续摄取和转运实验要求。采用Caco-2 单层细胞吸收模型研究药物吸收特性,细胞存活率应高于85%,当细胞存活率低于85%后,Caco-2 单层细胞吸收模型的TEER 明显降低。采用MTT 法考察野鸦椿酸对Caco-2 细胞的毒性[10]。结果显示,当野鸦椿酸浓度≤50 μg/mL 时,细胞存活率>95%,因此,后续实验中设置的低、中、高浓度(12.5、25、50 μg/mL)符合要求。
表观渗透系数(Papp)是反映物质在肠道内的吸收能力。在人的空肠中0~100%吸收率的物质在Caco-2 细胞中转运的Papp值介于5×10-8~5×10-5cm/s 之间。吸收良好药物的Papp值>10×10-6cm/s;中等吸收药物的Papp值为1.0×10-6~1.0×10-5cm/s;吸收不良药物的Papp值<1.0×10-6cm/s[13]。本研究结果显示,野鸦椿酸的Papp值与浓度呈正相关,介于(61.41±2.92)×10-4~ (167.18±6.72)×10-4cm/s 之间,属于吸收良好物质。在Caco-2 细胞吸收模型中,外排比率(RB→A/A→B)可评价药物双向转运是否具有方向性。当RB→A/A→B值接近于1时,表明药物主要以被动扩散方式转运;当RB-A/A-B值<<1(一般<0.6)时,表明药物主要被小肠顶侧膜的转运载体所摄取[14];而当RB-A/A-B值>>1 时(一般>1.5),表明药物被小肠顶侧膜的转运蛋白外排。野鸦椿酸的RB→A/A→B介于0.8~1.4 之间,表明其转运以被动扩散方式为主。
在Caco-2 单层细胞吸收模型中,当药物是P-gp的底物,P-gp 会降低其摄取以及双向转运速率,而P-gp 抑制剂能够发挥拮抗作用,从而促进药物的吸收[15]。本研究选取2 种典型的P-gp 抑制剂Ver 和CsA,考察它们对野鸦椿酸在Caco-2 细胞中摄取转运的影响。结果表明,加入P-gp 抑制剂后野鸦椿酸的Qr和Papp值均无明显变化,表明野鸦椿酸不是P-gp 的底物。EGTA 是Ca2+专属螯合剂,其可通过拮抗Ca2+通过细胞膜进入细胞,减少细胞收缩,打开细胞之间的间隙,从而明显增加药物的转运能力。结果表明,加入EGTA 后,野鸦椿酸双向转运的Qr和Papp值均无明显变化(P>0.05),即野鸦椿酸不存在细胞旁路转运[16]。
肠道吸收理论认为药物电离后呈离子状态,不易通过肠道屏障被吸收,而药物电离主要由于溶剂pH 值发生改变[17-18]。本实验考察了不同pH 值(7.20、6.00、5.00)对野鸦椿酸吸收特性的影响。结果表明,当(pH=6.00)条件下野鸦椿酸的Qr和Papp值最高,在中性(pH=7.20)条件下Qr和Papp值最低,由于野鸦椿酸为三萜酸类化合物,弱酸性环境抑制了电离,有利于其透膜吸收。
综上所述,基于Caco-2 细胞模型研究了野鸦椿酸的双向转运特性,考察了不同浓度、pH、温度、时间、P-gp 抑制剂对药物吸收的影响。结果表明,野鸦椿酸双向转运特性包括主动转运和被动扩散,在设定的浓度内吸收良好,同时弱酸性的环境可提高野鸦椿酸的转运吸收,提高其生物利用度。

