川芎嗪-丹参配伍前后在急性心肌缺血模型大鼠体内的组织分布差异研究
李 容勾 健刘 亭巩仔鹏陆 苑刘春花黄 勇孙 佳*
(1.贵州医科大学 贵州省药物制剂重点实验室 省部共建药用植物功效与利用国家重点实验室,贵阳 550004;2.贵州医科大学 民族药与中药开发应用教育部工程研究中心,贵阳 550004;3.贵州医科大学 药学院,贵阳 550004)
冠状动脉心脏病是全球流行病中发病率和死亡率的主要原因,心肌缺血是冠心病的代表性病理过程,其特征是心肌血氧供需失衡,引起心脏代谢紊乱、心律失常、心肌梗死、猝死[1]。由盐酸川芎嗪和丹参配伍组成的参芎葡萄糖注射液(Shenxiong glucose injection, SGI)在临床上广泛用于治疗无症状心肌缺血、心力衰竭、心绞痛、急性缺血性中风等多种疾病,且临床效果显著[2-3]。药理作用研究显示SGI 具有抗氧化应激和抗凋亡作用[4],同时SGI可能通过环氧合酶途径等生物过程治疗缺血再灌注损伤,其主要与脂肪细胞脂解、血小板活化的调控等信号通路密切相关[5]。
中药复方是中药临床应用的主要形式,配伍通过引起药物代谢酶和转运蛋白的改变从而导致药物的吸收、分布、代谢和排泄(ADME)过程发生变化[6]。而机体是否处于病理状态以及疾病的严重程度同样对药物的ADME 过程有不同的影响,因此在病理状态下研究药物配伍前后的体内过程具有更重要的临床意义。目前对于丹参和川芎嗪的报道主要集中在正常状态下单一成分的药动学和体内分布研究[7-8],课题组前期研究发现,在单次给药后,川芎嗪-丹参配伍组急性心肌缺血(AMI)大鼠体内川芎嗪的AUC 显著降低,Vz 升高[9],提示配伍降低了川芎嗪的吸收而加快了分布。可见配伍改变了活性成分在体内的药动学行为,但是对其组织分布的影响不得而知。鉴于该部分研究未见报道,本实验基于AMI 大鼠模型,通过考察川芎嗪-丹参配伍前后各组中川芎嗪和丹参素这两种活性成分的组织分布差异,进一步从体内过程变化的角度揭示药物配伍的机理,对临床合理用药提供参考。
1 材料和方法
1.1 实验动物
7~9 周龄SPF 级健康雄性Sprague-Dawley(SD)大鼠96 只,体重为230~270 g,由辽宁长生生物技术股份有限公司提供[SCXK(辽)2020-0001],实验动物饲养于贵州医科大学实验动物中心[SYXK(黔)2018-0001],于温度为22~25℃、相对湿度为45%~60%的动物房内适应性饲养1 周后用于后续实验。所有实验方案研究都得到了贵州医科大学动物伦理委员会的批准(1801210),并按实验动物使用的3R 原则给予人道关怀。
1.2 主要试剂与仪器
丹参浸膏(贵州景峰注射剂有限公司,批号07200801);盐酸异丙肾上腺素(上海阿拉丁生化科技股份有限公司,批号G2028261,纯度≥99%);丹参素、盐酸川芎嗪、葛根素对照品(上海源叶生物科技有限公司; 批号分别为 H09N10S102463、X08O9C71471、S02 M9B54875,纯度均≥98%);木犀草苷对照品(成都埃法生物科技有限公司,批号AF20072618,纯度≥98%);甲醇(色谱纯,美国Fisher 公司);乙腈、甲酸(色谱纯,德国Merck 公司);其他试剂均为分析纯;实验用水为屈臣氏蒸馏水。
ACQUITY UPLC I-Class/Xevo TQ-S 型超高效液相串联三重四极杆质谱联用仪(TQS, 美国 Waters公司)、ACQUITY UPLC-TQD 型超高效液相串联三重四极杆质谱联用仪(TQD, 美国Waters 公司);低温高速离心机(Allegra 64R,美国Beckman Coulter公司);氮吹浓缩装置(MTN-2800D,天津奥特赛恩斯仪器有限公司);电子天平(EL204,上海梅特勒-托利多有限公司);匀浆机(T10 basic,德国IKA 公司)。
1.3 实验方法
1.3.1 供试品的制备
临床上SGI 的单次每日剂量为100~200 mL。因此,按物种间转换计算后大鼠所需剂量为10.5~21.0 mL/kg。然而,实验所需的注射量将超过大鼠的正常注射量(10 mL/kg)。因此按照参芎葡萄糖注射液国家药品标准(WS-10001-(HD-1136)-2002)“处方”和“制法”项下进行供注射用实验样品的制备,川芎嗪组(LG,不含丹参提取物)、丹参组(DS,不含川芎嗪)和川芎嗪-丹参组(LD)同比例加入葡萄糖、甘油和注射用水量,调至pH=5.5~6.5,并进行过滤、灭菌。采用HPLC 测得LD 组中各成分的质量浓度为川芎嗪1.368 mg/mL、丹参素0.378 mg/mL。
1.3.2 盐酸异丙肾上腺素溶液的配制
称取盐酸异丙肾上腺素0.1 g 于10 mL 容量瓶中,加入生理盐水溶解并定容至刻度,配制成质量浓度为10 mg/mL 的盐酸异丙肾上腺素溶液,现配现用。
1.3.3 对照品溶液的配制
精密称取丹参素、盐酸川芎嗪、木犀草苷(TQD内标)、葛根素(TQS 内标)对照品适量至10 mL 容量瓶,加甲醇适量,超声溶解并定容至刻度,得丹参素、川芎嗪、木犀草苷、葛根素的浓度分别为1.030 mg/mL、0.9986 mg/mL、1.052 mg/mL、1.023 mg/mL的储备液。分别精密吸取丹参素、川芎嗪对照品储备液适量,加50%甲醇稀释得8.240 μg/mL、29.958 μg/mL 的混合对照品母液,再用50%甲醇2 倍逐级稀释得到不同浓度梯度的混合对照品工作液。
1.3.4 色谱与质谱条件
采用实验室前期建立的色谱和质谱条件[9],保护柱:Waters Van Guard BEH C18(2.1×5 mm,1.7 μm),色谱柱:Waters BEH C18(2.1×150 mm,1.7 μm),柱温:40℃,流速:0.35 mL/min,流动相:0.1%甲酸水-0.1%甲酸乙腈,梯度洗脱:0~1.0 min,92%A;1.0~1.5 min,92%~70% A;1.5~2.0 min,70%~60% A;2.0~2.5 min,60%~10% A;2.5~3.0 min,10% A;3.0 ~ 4.0 min,10% ~ 92% A,进样体积:1 μL。
由于SGI 中川芎嗪与丹参素在仪器中响应差别较大,故本实验中川芎嗪采用TQD 检测(内标为木犀草苷),丹参素采用TQS 检测(内标为葛根素)。采用电喷雾电离源(ESI),电毛细管电压3 kV,离子源温度120℃,喷雾气与反吹气N2,去溶剂气温度350℃,去溶剂气流速650 L/hr,扫描方式为多反应监测(MRM),Masslynx 4.1 工作站进行数据采集及处理。TQS 中用于定量分析的离子对分别为丹参素为m/z197.5→162.7、葛根素(内标)m/z415.1→267.0,锥孔电压分别为25、35 V,碰撞电压分别为20、25 V,均为负离子扫描模式;TQD 中用于定量分析的离子对分别为川芎嗪为m/z137.1→55.1、木犀草苷(内标)m/z449.1 →250.9,锥孔电压分别为40、30 V,碰撞电压分别为20、25 V,均为正离子扫描模式。
1.3.5 动物分组、给药与组织样品收集
取96 只健康SD 大鼠,实验前禁食12 h,自由饮水。按50 mg/kg 剂量皮下注射盐酸异丙肾上腺素,每天给药1 次,连续给药2 d 制备AMI 模型大鼠[9]。造模后,随机分为川芎嗪组(ligustrazine,LG)、丹参组(Danshen,DS) 和川芎嗪-丹参组(ligustrazine-Danshen,LD)(每组30 只)、空白组6只。除空白组大鼠给予等量生理盐水,其余组大鼠按10 mL/kg(相当于川芎嗪13.68 mg/kg,丹参素3.78 mg/kg)剂量进行尾静脉注射。于给药后1、5、10、30、60 min 处死大鼠,空白组于注射60 min 后处死,在冰床上迅速剥离心脏、肝、脾、肺、肾、脑组织,各组织按w∶v=1 ∶2 加入生理盐水在冰浴中匀浆,8000 r/min 离心10 min,分离上清液于-20℃保存备用。
1.3.6 组织样品前处理
对实验室前期采用的样品处理方法[9]进行优化后用于本部分实验。取上述组织匀浆上层液200 μL,依次加入20 μL 内标(葛根素1 μg/mL,木犀草苷150 μg/mL),60 μL 盐酸(1 mol/L),1 mL 乙酸乙酯,涡混5 min,超声10 min,于4℃下14 000 r/min离心10 min,取上清液a;沉淀中依次加入40 μL NaOH(1 mol/L),1 mL 乙酸乙酯,涡混5 min,超声10 min,于4℃下14 000 r/min 离心10 min,取上清液加入100 μL 盐酸甲醇溶液(1 mol/L),得b 液,合并a、b 液,30℃氮气吹干,剩余残渣用200 μL 50%甲醇溶解,于4℃下15 000 r/min 离心10 min,取上清液进样分析。
1.4 统计学方法
采用WinNonLin 8.2(Phoenix, 美国Pharsight公司)软件中的非房室模型计算川芎嗪和丹参素在组织中的AUC0-t参数。用SPSS 22.0 软件对数据进行统计分析,实验结果以平均数±标准差(±s)表示,采用独立样本t检验进行组间比较,以P<0.05计为差异具有统计学意义。
2 结果
2.1 方法学考察
通过对心脏、肝、脾、肺、肾、脑各组织间基质效应比较,质量控制样本(QC)在不同基质中没有明显的基质效应影响。因此随机抽取了心脏、肝两个组织进行了方法学考察。
2.1.1 专属性
取各空白组织匀浆上层液、加入一定浓度对照品溶液和内标溶液的空白组织匀浆上层液、大鼠给药后的组织匀浆上层液各200 μL,分别按“1.3.6”方法操作,进样分析分别得到色谱图。在选定的色谱条件和质谱条件下,空白组织匀浆上层液中的内源性物质不干扰丹参素等成分的测定,各成分的分离度和峰形良好,提示该方法专属性良好(图1)。

注:A:空白组织;B:空白组织加入混合对照品;C:含药组织。图1 大鼠组织中两种成分及内标的MRM 专属性色谱图Note.A, Blank tissue.B, Add mixed reference substance to blank tissue.C, Medicated tissue.Figure 1 MRM specific chromatograms of two components and internal standards in rat tissues
2.1.2 标准曲线和线性范围
取各空白组织匀浆上层液200 μL,加入混合标准品溶液20 μL,配制成相当于大鼠血浆药物浓度,其余按“1.3.6”项下方法操作,进样分析,以2 种待测成分的峰面积与内标的峰面积之比(A/Ai)为纵坐标(Y),各物质浓度(C)为横坐标(X),以1/X2为加权系数,求得直线方程,即为标准曲线。两种成分在相应的线性范围内线性关系良好,相关系数R2均大于0.9907,结果见表1。

表1 川芎嗪和丹参素在组织中的标准曲线Table 1 Standard curves of the ligustrazine and Danshensu in tissues
2.1.3 准确度和精密度
取心脏和肝空白组织匀浆上层液200 μL,加入低、中、高3 个浓度的QC 样本,再按“1.3.6”项下方法操作,每个浓度平行5 个样本,日内连续进样,且与标准曲线同时进行,3 个浓度连续测定3 d,分别计算日内和日间准确度、精密度。川芎嗪和丹参素在心脏和肝组织中的日内准确度范围为87.00%~106.66%,日间准确度范围为89.32%~108.20%,日内、日间精密度RSD 均小于15%。提示该方法重现性好,符合生物样品分析方法的基本要求,见表2。
表2 川芎嗪和丹参素在不同给药组大鼠体内的分布(±s, n=6)Table 2 Distribution of the ligustrazine and Danshensu in rats among different administration groups

表2 川芎嗪和丹参素在不同给药组大鼠体内的分布(±s, n=6)Table 2 Distribution of the ligustrazine and Danshensu in rats among different administration groups
注:与LG 组相比,*P<0.05,**P<0.01,***P<0.001;与DS 组比较,#P<0.05,##P<0.01,###P<0.001;-,未检出。Note.Compared with LG group,*P<0.05,**P<0.01,***P<0.001.Compared with DS group,#P<0.05,##P<0.01,###P<0.001.-, Not detected.
成分Compound组织Tissue组别Groups含量(μg/g)Concentration 1 min 5 min 10 min 30 min 60 min药时曲线下面积(μg/(g·min))AUC0-t川芎嗪Ligustrazine心脏Heart肝Liver脾Spleen肺Lung肾Kidney脑Brain LG 1.12±1.10 0.88±0.59 0.45±0.28 0.39±0.18 0.22±0.12 26.21±7.78 LD 3.51±1.38** 3.44±1.45** 10.63±4.68*** 6.74±3.33*** 1.57±0.76** 351.06±59.3***LG 0.82±0.50 0.29±0.12 0.18±0.06 0.22±0.06 0.15±0.07 13.92±3.01 LD 0.09±0.04** 0.10±0.09* 0.21±0.13 0.08±0.05** 0.05±0.02** 5.95±1.72***LG 7.45±1.10 6.44±1.47 4.76±0.79 3.79±0.64 1.15±0.47 223.18±15.48 LD 6.79±3.34 9.90±1.85* 8.77±0.96*** 3.59±1.47 1.63±0.69 288.65±44.7**LG 11.28±4.44 4.02±3.07 1.15±0.58 0.87±0.48 0.22±0.15 94.33±17.49 LD 8.07±6.48 4.41±3.75 4.27±2.62* 1.4±0.57 0.93±0.70 147.16±50.33*LG 30.58±9.48 16.30±6.52 13.34±2.02 7.38±2.58 1.71±0.92 545.14±87.5 LD 30.11±18.81 24.12±5.73 19.32±2.69** 8.04±0.92 4.09±2.20* 705.12±102.27*LG 39.42±13.93 33.75±23.95 16.64±7.03 14.42±4.07 6.20±3.09 958.3±131.65 LD 90.83±70.26 43.77±34.45 45.44±21.6* 26.75±6.70** 4.31±3.00 179.1±498.74**心脏Heart肝Liver丹参素Danshensu脾Spleen肺Lung肾Kidney脑Brain DS 0.68±0.14 0.37±0.05 - - - 2.83±0.48 LD 1.47±0.41## 0.59±0.12## - - - 5.80±1.27###DS 0.58±0.07 0.31±0.07 0.21±0.06 0.12±0.01 0.11±0.00 10.46±0.88 LD 0.99±0.42 0.6±0.21# 0.24±0.10 0.17±0.03 0.13±0.01 14.97±1.76##DS 0.57±0.25 0.27±0.07 0.15±0.07 0.07±0.01 0.05±0.01 7.44±1.53 LD 0.61±0.15 0.42±0.06# 0.28±0.04## 0.11±0.04# 0.06±0.02 10.95±0.69##DS 2.39±0.50 1.00±0.26 0.78±0.18 0.3±0.03 0.23±0.01 32.67±1.52 LD 2.47±0.25 1.09±0.05 0.81±0.16 0.3±0.05 0.27±0.02 34.35±1.51 DS 45.14±9.19 17.61±7.43 10.08±2.90 0.98±0.37 0.35±0.18 377.25±64.9 LD 40.56±13.81 30.14±11.18# 12.47±3.17 1.81±0.74# 0.49±0.23 468.27±98.86 DS 0.10±0.02 0.06±0.03 0.03±0.01 - - 0.63±0.13 LD 0.08±0.03 0.06±0.01 0.04±0.02 0.02±0.00 - 1.22±0.19###
2.1.4 提取回收率和基质效应
取心脏和肝空白组织匀浆上层液200 μL,加入低、中、高3 个浓度的QC 样本,每个浓度平行5 份,按“1.3.6”项下操作(样品A);另取空白组织匀浆上层液200 μL(不加混合标准溶液和内标) 按“1.3.6”项下操作,向获得的上清液中加入低、中、高浓度的混合标准溶液和内标,氮气吹干,残渣以200 μL 初始流动相溶解(样品B);另取低、中、高浓度的混合标准溶液与内标,氮气吹干,残渣以200 μL 初始流动相溶解(样品C)。以A 样品与B 样品色谱峰面积之比为提取回收率,以B 样品与C 样品的色谱峰面积之比为基质效应。心脏和肝组织中川芎嗪和丹参素在低、中、高3 个浓度下的提取回收率在97.87%~112.38%, 基质效应在95.47%~106.05%,RSD 均小于15%,说明该方法提取回收率良好,不存在明显的基质效应。
2.1.5 样品稳定性
配制低、中、高3 个浓度的QC 样本,每个浓度平行5 份,考察心脏和肝样品在自动进样器放置24 h,-20℃条件下冻存30 d 和经-20℃至室温反复冻融3 次的稳定性。结果显示3 种条件下心脏和肝组织样品中川芎嗪和丹参素的稳定性良好,RSD 均小于15%,符合生物样品体内分析方法要求。
2.2 丹参素和川芎嗪在AMI 大鼠体内的组织分布
AMI 模型大鼠静脉注射DGI、LGI 和SGI 后,川芎嗪和丹参素在大鼠心脏、肝、脾、肺、肾、脑组织中不同时间点下的含量见表2,药物浓度-时间曲线见图2、图3。除SGI 组大鼠的心脏、肝、脾组织中川芎嗪分别在给药后10 min、10 min 和5 min 达分布峰值,其余组织中川芎嗪和丹参素在各组织中均在1 min 达分布峰值,丹参素可在心脏中快速分布并消除,10 min 后心脏中未能检测到丹参素。川芎嗪在大鼠脾、肾、脑组织中含量较高,其中脑组织中含量最高,与LGI 组相比,SGI 组大鼠各组织中川芎嗪的AUC0-t有所增加,其中心脏、脾、肺、肾、脑组织中分别增加12.39 倍、0.28 倍、0.56 倍、0.29 倍、0.87倍,差异有统计学意义(P<0.05)。丹参素在大鼠心脏、肺、肾组织中含量较高,其中肾中含量最高;与DGI 组相比,SGI 组大鼠各组织中丹参素的AUC0-t有所增加,其中心脏、肝、脾、脑组织中分别增加1.04 倍、0.47 倍、0.83 倍,含量增加有统计学意义(P<0.05)。其中川芎嗪和丹参素在心脏中的含量均显著增加(P<0.001),可见配伍延长了川芎嗪分布至靶器官心脏的达峰时间,同时增加了川芎嗪和丹参素在心脏中的含量。
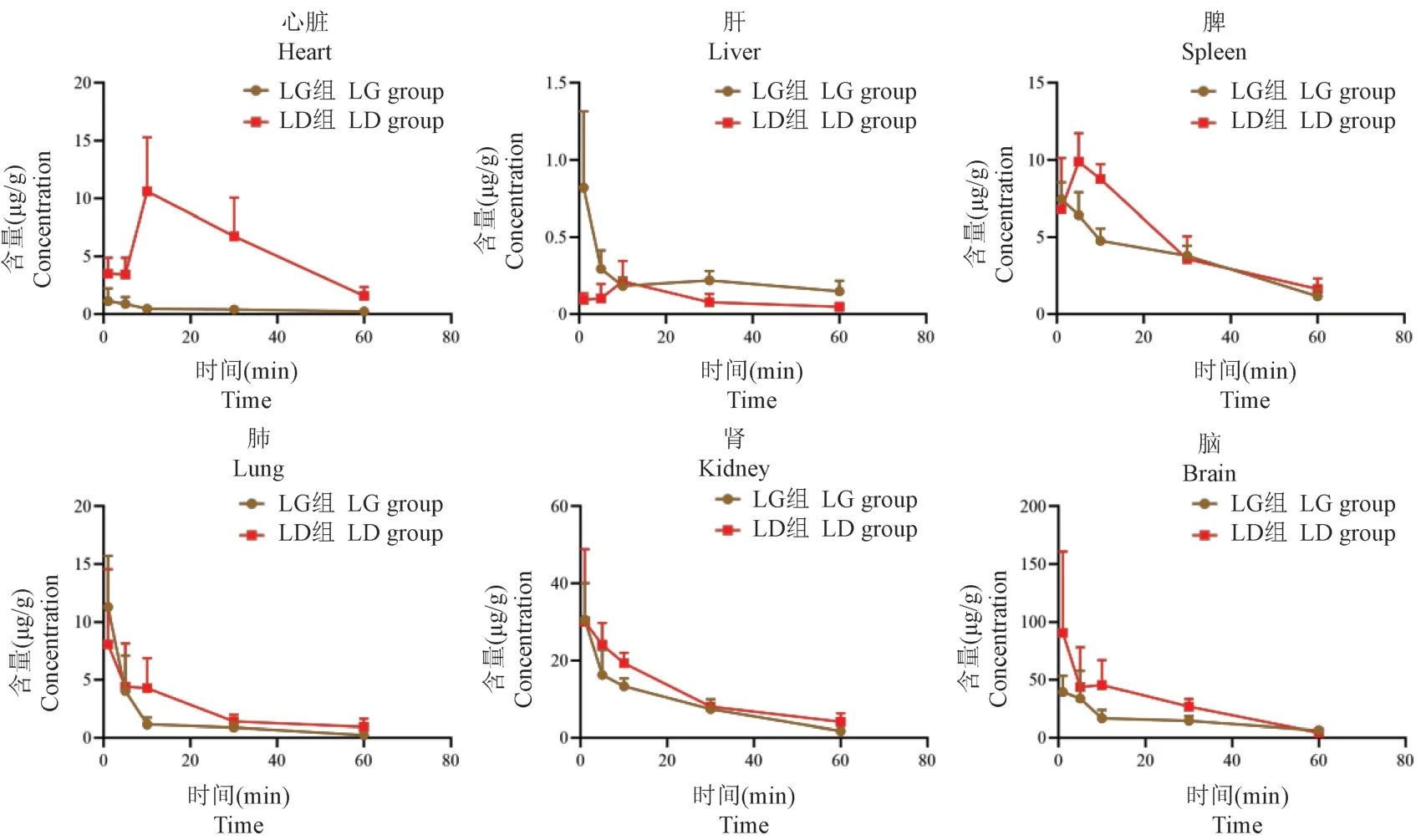
图2 配伍前后川芎嗪大鼠体内的分布(±s, n=6)Figure 2 Distribution of ligustrazine in rats before and after compatibility

图3 配伍前后丹参素大鼠体内的分布(±s, n=6)Figure 3 Distribution of Danshensu in rats before and after compatibility
3 讨论
课题组前期对SGI 进行含量测定时发现,除丹参素外的丹酚酸类成分含量较低。每100 mL 的SGI 含药效成分丹参素20 mg,盐酸川芎嗪100 mg,占总成分的95%以上[10],其中含量较高的成分为川芎嗪和丹参素。前期预实验发现注射给药后,仅在心脏和肾中检测到痕量迷迭香酸,在其他组织中均未检测到,故本实验选择川芎嗪和丹参素作为检测对象。
大量研究表明中药相互作用会影响效应成分的体内分布[11-13],本研究比较了川芎嗪-丹参配伍前后在AMI 模型大鼠体内的组织分布差异。结果显示,从组织中药物含量的角度分析,配伍后多数组织中川芎嗪和丹参素的AUC0-t有所增加,配伍前川芎嗪在各组织中的含量顺序为脑>肾>脾>肺>心脏>肝,配伍后其含量顺序为脑>肾>心脏>脾>肺>肝。川芎嗪在心脏、脑组织中的含量远高于其他组织,表明该药物在AMI 状态下更易于分布,且配伍后能显著提高川芎嗪在靶器官心脏中的含量。配伍前后丹参素在各组织中的含量顺序均为肾>肺>肝>脾>心脏>脑,丹参素在肾、肺、心脏等组织中含量较高,可见丹参素对上述血流较丰富的组织具有较好的亲和力,也证实了丹参素的分布取决于组织器官的血流和灌流速度[14],这与其具有防治心血管疾病和肺保护作用的药理活性相对应[15-16]。
同时有研究报道显示丹参素主要经肾通过尿液排泄[17],与本研究中其在肾中含量较高的结论一致。现有文献报道有机阴离子转运蛋白1(OATP1)和3(OATP3)在肾中特异性表达,介导了许多药物的肾积累[18],而丹参素对有OATP1 和OATP3 表现出竞争性抑制作用[19]。丹参素为酸性化合物,符合OATP1 和OATP3 的底物特性,但丹参素是否为OATP1 和OATP3 的底物,目前尚无相关报道。本研究发现,配伍后丹参素和川芎嗪在肾中含量有增加趋势,推测可能与OATPs 的抑制有关。丹参素在给药60 min 后基本从体内清除,没有明显的蓄积反应;川芎嗪消除较丹参素慢,60 min 未完全消除。现有文献报道川芎嗪在各组织中的半衰期在39~67 min[20],本研究发现川芎嗪在病理状态下消除较正常组更快,但其配伍后在心脏中消除明显减慢。
结合课题组前期研究结果,盐酸川芎嗪与丹参合用后, 介导川芎嗪Ⅰ相代谢的 CYP1A2、CYP2C11、CYP3A2 这3 种酶表达升高,使川芎嗪的代谢加快[9],AMI 大鼠体内血药浓度降低,但是二者联用可显著增加川芎嗪和丹参素在靶器官心脏中的AUC,且在体内滞留更久,消除更慢,从而以协同作用增强对心脑血管疾病的治疗效果。

