煤微生物甲烷化的石墨烯强化机制
周艺璇 , 苏现波,2,3,4 , 赵伟仲 , 王 乾,2 , 于世耀 , 汪露飞
(1.河南理工大学 资源环境学院, 河南 焦作 454000;2.河南理工大学 非常规天然气研究院, 河南 焦作 454000;3.中国地质大学 资源学院, 湖北 武汉 430074;4.中原经济区煤层(页岩) 气协同创新中心, 河南 焦作 454000)
在绿色高效煤层气增产技术研发领域,相继提出了微生物增产煤层气(Microbially Enhanced Coalbed Methane, MECBM)[1]和煤层气生物工程(Coalbed Gas Bioengineering, CGB)的理念[2]。其中,煤层气生物工程是将营养液或经过选育、驯化、改良的菌种注入地下煤层,通过厌氧发酵(Anaerobic Digestion, AD)把煤的部分有机组分转化为甲烷,从而实现微生物强化煤层气产出的一种特殊发酵工程[3-5]。煤层气生物工程作为一种新的煤层气增产与碳减排技术,有着潜在的生命力。由于煤的分子结构复杂,其厌氧发酵产甲烷需要不同代谢功能微生物的协同作用[6-7]。近年来关于强化煤制生物甲烷产出的研究主要集中在3 个方面:煤层(水)本源微生物的多样性研究[8-9];通过发酵系统参数优化、生物驯化、生物刺激和生物强化等方法来提高生物甲烷的产出[10-14];通过生物化学手段提高煤在厌氧发酵系统中的生物可利用度[15-16]。可见促进发酵系统中微生物的代谢活性是提高生物甲烷产气量的有效途径。
向发酵系统中添加导电材料不仅可以减少温度、pH 等环境条件的变化对微生物活性的影响,还可以有效促进直接种间电子传递(Direct Interspecies Electron Transfer, DIET)提高甲烷产率,在强化有机物厌氧降解方面潜力巨大。2012 年,KATO 等[17]在稻田土壤富集的菌种的厌氧发酵系统中添加导电材料磁铁矿后,发现Geobacter和Methanosaeta被富集,并且甲烷产气量也得到了显著的提升,证明了添加导电材料可以刺激DIET 过程产生CH4。导电性能优秀的碳材料,如生物炭、石墨、石墨烯、碳纤维布、碳纳米管等已经被广泛用于促进DIET 机制以增强厌氧发酵过程中甲烷产气量[18-22]。人们通过向有机废物、动物粪便和餐厨垃圾等厌氧发酵系统中添加不同性质的导电碳材料,发现可有效缩短厌氧发酵的延滞期,强化厌氧发酵效率,使得甲烷产气量得到了明显的提升[23-26]。将生物炭加入以污泥和餐厨垃圾为底物的厌氧发酵体系中,不仅会使整个系统的pH 缓冲能力显著上升,还能够减缓厌氧消化过程中的氨抑制作用,促进产甲烷过程,提升甲烷产率[27-28]。石墨烯作为一种由单层碳原子紧密排列形成的2D 蜂巢晶格结构的平面薄膜,具有优良的电子、热力学导电性能和较强的吸附性能,这种新兴材料因其独特的物理及电化学性质引起了世界范围内的广泛关注[29]。在添加石墨烯的条件下,以污泥为底物的厌氧发酵体系的产甲烷效率显著增强,并且增强了乙酸营养型产甲烷微生物的活性[30]。在连续流污泥厌氧消化系统中添加石墨烯能够在提高甲烷产气量的同时原位去除CO2,最终可使沼气中甲烷体积分数提高到95%,显著提升了厌氧消化系统产气效果[31]。
导电碳材料介导的厌氧微生物种间互营关系的强化为进一步提高厌氧发酵效果开辟了一条新的思路,目前的研究大多运用导电材料强化一些简单底物的降解,然而对于煤这种复杂的有机物降解过程中的机制尚不清楚,对发酵系统内功能菌群的分析以及相关群落结构和机理分析的研究鲜有报道。笔者以长焰煤为研究对象,石墨烯作为导电材料,通过对比分析添加导电材料的发酵系统和传统厌氧发酵系统在产甲烷过程中气相、固相、液相、菌群群落结构和产甲烷代谢路径的差异性,揭示导电材料石墨烯对煤层生物甲烷产出的强化机制,为煤层气增产提供新途径。
1 实验材料与方法
1.1 实验材料
选取河南省义马千秋矿长焰煤(CYM)作为实验样品(表1)。实验所用石墨烯购于中科雷鸣(北京)科技有限公司,相关参数见表2。煤样在105 ℃的烘箱中放置12 h,随后对煤块进行研磨和筛分,获得0.15~0.18 mm 煤样。厌氧发酵产气菌源来源于实验室长期驯化的菌群。

表1 煤样的工业分析和元素分析Table 1 Proximate analysis and ultimate analysis of coal samples %

表2 石墨烯基本特性参数Table 2 Characteristic parameters of graphene
1.2 实验设计
(1)石墨烯最佳添加量筛选:在5 个250 mL 发酵瓶中分别加入25 g 长焰煤,其中4 个分别加入0.2、0.4、0.6、0.8 g/L 的石墨烯作为实验组,剩余1 个不加石墨烯的作为对照组;同时倒入富集好的产甲烷菌液250 mL,充入氩气形成无氧环境,密封后放入25 ℃恒温培养箱,每隔4 d 记录产气数据,以甲烷累计产气量作为评价标准,确定石墨烯的最优添加量。
(2)确定石墨烯最佳添加量后,以此进行下一步实验。采用2 个1 000 mL 锥形瓶作为厌氧发酵容器,分别加入100 g 长焰煤,其中1 个加入石墨烯作为实验组,另一个作为对照组,接种富集6 d 的菌液,充入氩气形成厌氧环境,密封后放入25 ℃恒温培养箱,每隔4 d 记录产气数据。
(3)每隔4 d 对各个发酵系统的发酵液分别取液100 mL,对所取菌液进行液相产物分析与高通量测序。
1.3 分析检测方法
1.3.1 发酵系统气体分析
本研究厌氧发酵产生的气体用GC-4000A 气相色谱仪进行分析检测,手动进样,进样量为1 mL,用注射器抽取气袋中收集的气体测定产气量。
1.3.2 关键液相产物定量分析
标品甲酸、乙酸、丙酸、丁酸、甲醇、乙醇、十五烷、十六烷、十八烷购于北京中科质检生物技术有限公司。配置不同质量浓度(mg/L)标品混合溶液,按照液液萃取方法用二氯甲烷萃取浓缩后进行GC-MS(气相色谱质谱联用仪7890-5977A)测定,并建立标准变化曲线,然后再次运用同样方法对发酵液处理测定并求出各物质的质量浓度。
1.3.3 发酵系统煤样XPS 分析
将发酵结束后剩余发酵液倒出,用筛子过滤出煤样,用蒸馏水反复冲洗煤样去除煤样上的发酵液,将处理好的煤样放入80 ℃的烘干箱干燥24 h,取适量样品用X 射线光电子能谱仪(Thermo Scientific Escalab 250Xi 型)进行XPS 测试。
1.3.4 高通量测序
本实验进行的高通量测序均交付上海美吉生物医药科技有限公司完成,具体方法见文献[32]。取液时将厌氧发酵瓶放在厌氧工作站内,摇匀菌液,抽取50 mL 菌液于离心管中,用封口膜密封、编号,放入干冰箱中,进行低温冷冻邮寄。微生物功能通过PICRUSt 软件进行预测,基于KEGG 甲烷代谢通路(Map: 00680),挑选出预测丰度大于100 的相关物质的代谢基因,对其降解及甲烷生成途径进行评估。
2 结果与讨论
2.1 实验结果
2.1.1 石墨烯添加量优选
添加不同质量石墨烯的发酵系统中甲烷的阶段产气量与累计产气量(图1、表3)表明当添加0.4 g/L石墨烯时累计甲烷产气量最高,为4.72 mL/g,比对照组的3.89 mL/g 提高了21.3%,并且煤的阶段产气量峰值时间(16 d)相比于对照组(20 d)提前了4 d;当石墨烯添加量增加到0.6 g/L 时,相比于对照组甲烷累计产气量提高但和添加0.4 g/L 石墨烯的发酵系统相比甲烷累计产气量开始下降,当石墨烯添加量继续增加到0.8 g/L 时,甲烷累计产气量为3.63 mL/g相比于对照组下降,这可能是高质量浓度的石墨烯会沉降到微生物表面抑制了微生物的生长及繁殖并且石墨烯锋利边缘可将细菌的细胞膜刺破,导致细胞失活[33-34]。因此,选取0.4 g/L 石墨烯作为后续导电材料促进煤厌氧发酵实验的添加量。

图1 不同添加量石墨烯发酵系统中甲烷和二氧化碳阶段产气量和累计产气量Fig.1 Stage gas production and cumulative gas production of methane and carbon dioxide in graphene digestion system with different additive levels

表3 不同石墨烯添加量发酵系统中甲烷阶段产气量和累计产气量Table 3 Stage gas production and cumulative gas production of methane in digestion systems with different graphene additions
2.1.2 石墨烯对厌氧发酵系统甲烷产气量的影响
确定石墨烯最佳添加量为0.4 g/L 后,据此构建一个厌氧发酵系统作为实验组和一个不加入石墨烯的作为对照组。在整个发酵过程中,对照组的阶段产气量在第20 天时达到峰值,为1.50 mL/g;而添加石墨烯的系统在第16 天达到产气峰值,为1.81 mL/g,比对照组提前了4 d,而且峰值产气量也提高了20.67%(图2(a))。对照组和添加石墨烯组中甲烷累计产气量分别为4.48 mL/g 和5.35 mL/g(图2(b)),添加石墨烯使得发酵系统甲烷产气量提升19.42%(表4)。产甲烷动力学分析(修正的Gompertz 模型)表明添加石墨烯的系统中模拟最高甲烷日产气量为0.35 mL/g,比对照组(0.31 mL/g)提高了12.9%(表5、图3)。同时,添加石墨烯和对照组中的产甲烷迟滞期(λ)分别为7.18 d和8.20 d,说明石墨烯的添加增强了菌群对底物的适应能力调高了产甲烷效能。
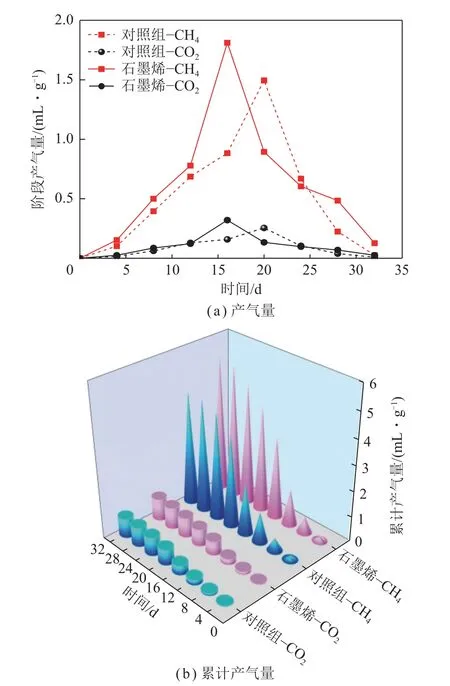
图2 添加石墨烯和对照组厌氧发酵系统中甲烷和二氧化碳阶段产气量和累计产气量Fig.2 Stage gas production and cumulative gas production of methane and carbon dioxide in the anaerobic digestion system with graphene and the control group

图3 添加石墨烯和对照组厌氧发酵系统中累积产甲烷曲线拟合Fig.3 Curves fitting of cumulative methane production in the graphene and control anaerobic digestion systems
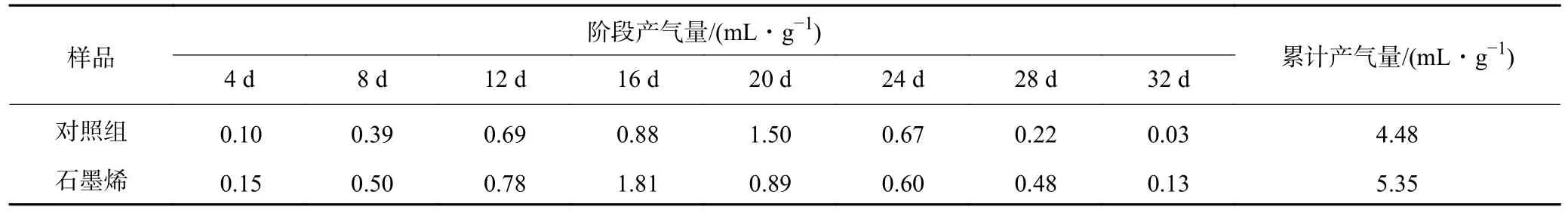
表4 添加石墨烯和对照组厌氧发酵系统中甲烷阶段产气量和累计产气量Table 4 Stage gas production and cumulative gas production of methane in the anaerobic digestion system with graphene and the control group

表5 添加石墨烯和对照组厌氧发酵系统中累积产甲烷曲线的拟合结果Table 5 Fitting results of cumulative methane production curves in the anaerobic digestion system with graphene and the control group
2.1.3 厌氧发酵前后煤表面碳元素含量及化学赋存状态变化特征
微生物通常以附着方式对煤固体进行厌氧降解,这一过程必定会使得煤表面结构发生一定变化。由原煤、对照组与添加石墨烯的系统经过厌氧发酵残余煤的C1s 谱图及其分峰拟合(图4)可以看出,芳香单元及其取代烷烃(C—C、C—H)在煤样表面都占有绝对优势,不同条件下经厌氧发酵产气残煤表面的芳香单元及其取代烷烃(C—C、C—H)相对于原煤均增加,相对含量为原煤 < 对照组 < 石墨烯(表6)。煤厌氧发酵过程中,键能相对较低的非规则部分从煤结构中脱落进入发酵液,从而使含氧有机碳(C—O、C=O、COO—)的总相对含量下降,导致产气残煤表面芳香单元及其取代烷烃(C—C、C—H)相对含量增加。其中添加石墨烯的厌氧发酵系统产气残煤表面的羰基碳(C=O)和羧基碳(COO—)相对于对照组明显减少,分别下降了42.8%和49.5%。

图4 煤样C1s 窄扫谱图分峰拟合Fig.4 Peak fitting of coal sample C1s narrow sweep spectrum

表6 煤样C1s 拟合结果Table 6 Peak fitting results of C1s spectrogram from coals
2.1.4 石墨烯对厌氧发酵系统中关键液相物质的影响
由厌氧发酵系统产气过程中酸类(图5(a))、醇类(图5(b))和烷烃类(图5(c))的变化可知,在对照组中,丁酸大量生成的时间在第12 天左右,呈先升高后降低的变化趋势,直至产气结束;而添加石墨烯的系统大量生成的时间提前了6 d,从前期大量生成至产气结束一直在降低,且下降速率高于对照组。对于甲酸、乙酸和丙酸,在对照组中呈先升高后降低又升高的变化趋势;添加石墨烯的系统则先降低后升高(图5(a))。在整个产气过程中两组发酵系统中的烷烃类物质均呈先降低后升高的变化趋势,第6 天左右烷烃类大量生成且石墨烯组高于对照组(图5(c))。两组发酵系统中的醇类在整个产气过程中一直降低,在产气高峰期之前下降速率较快,高峰期之后下降速率减缓(图5(b)、表7)。石墨烯的添加使得甲醇和乙醇在整个产气过程中利用率均高于对照组。

图5 添加石墨烯和对照组发酵系统中液相产物的定量变化趋势Fig.5 Trends of liquid phase products in the digestion system with graphene and the control group

表7 添加石墨烯和对照组发酵系统中液相产物的标准定量(质量浓度)Table 7 Standard quantifications of liquid phase products in the digestion system with graphene addition and control mg/L
2.1.5 石墨烯对厌氧发酵系统中微生物群落结构的影响
整个厌氧发酵过程中,分别对对照组和添加石墨烯的系统发酵前期(对照组-1,石墨烯-1)、产气高峰期(对照组-2,石墨烯-2)和产气末期(对照组-3,石墨烯-3)的菌群进行分析可知,在细菌群落结构中,添加石墨烯后各个时期功能菌属的丰度和多样性明显高于对照组(图6(a)),石墨烯的添加有效刺激了各个时期菌群的活性。对照组和添加石墨烯的系统各个时期均主要以Paraclostridium为主,添加石墨烯的系统发酵前期、产气高峰期和产气末期Geobacter的丰度均高于对照组,并且该菌属在石墨烯-2(15.6%)丰度最高,比对照组-2(7.0%)提高了122.9%;Anaerovorax和Sedimentibacter均在两组产气高峰期丰度最高,且添加石墨烯组高于对照组。Sphaerochaeta作为煤大分子降解中的主要功能菌属在对照组和添加石墨烯的系统中产气初期丰度最高,添加石墨烯组仍高于对照组(图7(a))。在古菌群落结构中,对照组和添加石墨烯的系统各个时期均主要以参与多种代谢途径的Methanosarcina和氢营养型的Methanoculleus为主,添加石墨烯后Methanosarcina丰度提高,且各个时期该菌属丰度均高于对照组(图7(b))。添加石墨烯后,各个时期菌属的丰度高于对照组,但在产气高峰期(石墨烯-2,21.5%)发酵系统菌群多样性低于对照组(对照组-2,22.6%)(图6(b))。
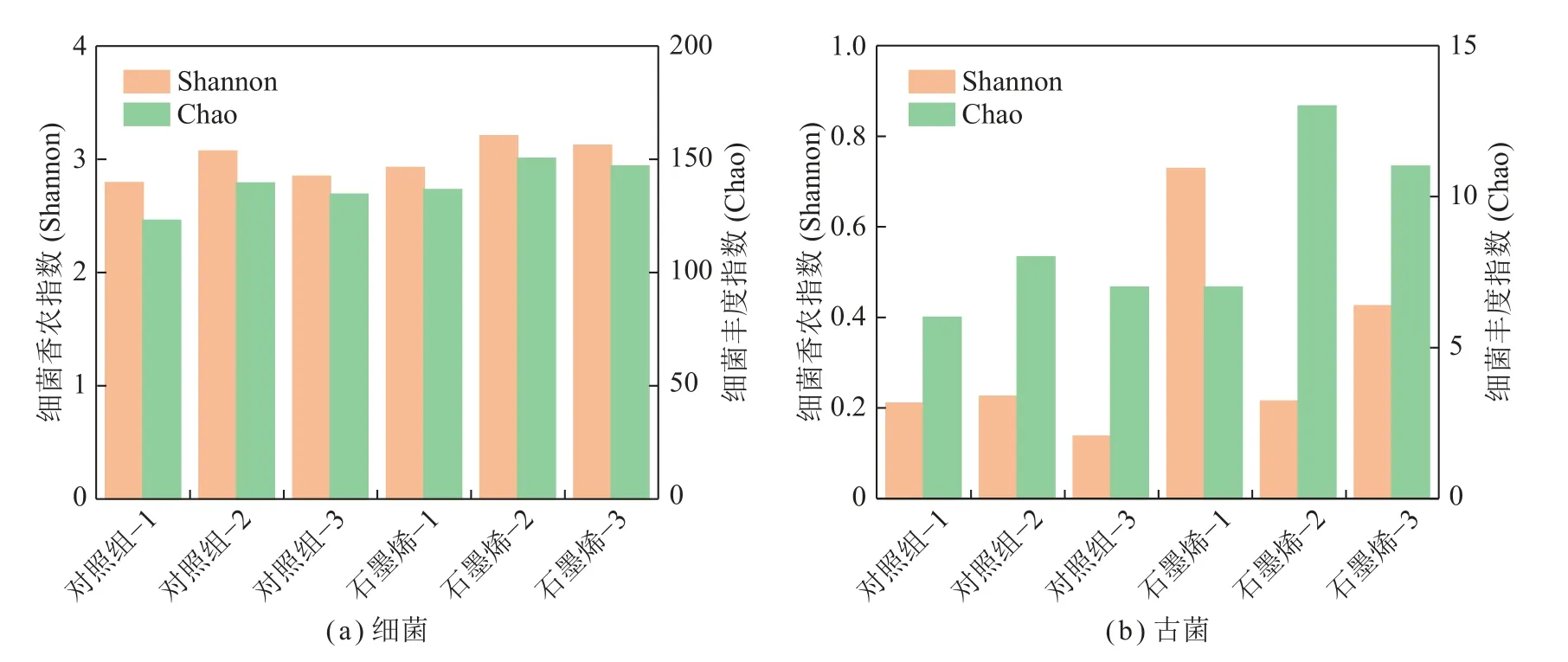
图6 添加石墨烯和对照组发酵系统中细菌和古菌多样性与丰度Fig.6 Diversity and abundance of bacteria and archaea in the digestion system with graphene and the control group

图7 添加石墨烯和对照组发酵系统中细菌和古菌群落结构Fig.7 Community structure of bacteria and archaea in the digestion system with graphene and the control group
2.1.6 产甲烷代谢路径分析
煤中有机质被微生物降解利用需经过多种菌群协同作用,煤中的大分子物质向小分子的转化的水解阶段尤为重要。产酸菌的酸化途径主要包括糖酵解、单糖代谢、氨基酸代谢和丙酮酸代谢。添加石墨烯后参与糖酵解(Ko00010)、氨基酸代谢(Ko01230)和丙酮酸代谢(Ko00620)的基因丰度分别增加了42.1%、24.9%和27.1%;参与糖酵解的2-脱氢-3-脱氧葡萄糖酸醛缩酶,与氨基酸代谢有关的氨基酸还原酶和转氨酶,以及丙酮酸代谢相关的铁氧还蛋白氧化还原酶、乙酸激酶和磷酸转乙酰酶与对照组相比显著增强,使得代谢酸类等物质的菌群(Geobacter、Anaerovorax)丰度显著升高。
在产甲烷阶段,依据底物类型的不同可以将该过程分为氢营养型、乙酸营养型和甲基营养型3 类。在乙酸营养型产甲烷路径中,添加石墨烯的系统中参与乙酸转化的乙酸激酶(K00925, EC: 2.7.2.1)、乙酸辅酶A 连接酶(K00193, EC: 6.2.1.1)、磷酸乙酰转移酶(K00625, EC: 2.3.1.8)、乙酰辅酶A 脱羰基酶/合成酶β 亚 基(K14138, EC: 2.3.1.169)和γδ 亚 基(K00194,EC: 2.1.1.245)相对丰度都显著高于对照组(表8),其中乙酰辅酶A 脱羰基酶/合成酶β 亚基和γδ 亚基作为乙酸合成途径中的关键酶,添加石墨烯后分别增加了233.54%和3.32%(图8)。

图8 添加石墨烯和对照组厌氧发酵系统甲烷代谢路径Fig.8 Methane metabolism pathway in the anaerobic digestion system with graphene and control group

表8 三种甲烷生成途径相关酶基因及其相对丰度Table 8 Genes of enzymes associated with three methanogenesis pathways and their relative abundance
2.2 分析与讨论
2.2.1 厌氧发酵系统中生物甲烷的生成机制
在厌氧发酵的4 d 内开始有生物甲烷生成,此时优势菌属为Paraclostridium、Alcaligenes和Sphaerochaeta,有研究表明Paraclostridium主要存在于厌氧发酵的水解阶段,具有很强的降解能力,通过代谢短链、长链烷烃生成乙酸等物质[35]。Alcaligenes和Sphaerochaeta可代谢氨基酸产生乙醇、乙酸、乳酸、氢气和二氧化碳,属于产氢产乙酸菌[36]。此时液相小分子物质烷烃(十五烷、十六烷、十八烷)、挥发性脂肪酸(甲酸、乙酸、丙酸和丁酸)和醇类(甲醇、乙醇)均有一定的积累,产气残煤表面的羰基碳(C=O)、羧基碳(COO—)也表明煤表面的官能团被微生物降解作为小分子有机酸类等物质的组成部分。与此同时,古菌群落中的优势菌属为Methansarcina能够进行多种产甲烷途径代谢。由于在初期阶段能够为微生物利用的营养物质有限,因此甲烷产气量较低。在第5~20 天内是甲烷产气量进行快速增长的阶段,在此阶段,活跃的细菌(Sedimentibacter、Paraclostridium)通过降解煤提供了充足的底物,同时烷烃、挥发性脂肪酸和醇类的快速消耗也说明了此时厌氧发酵系统中产氢产乙酸菌(Anaerovorax)起到了良好的承上启下作用,既消耗了水解阶段的产物,同时为产甲烷菌提供了充足的营养物质,Methanosarcina丰度的增加也表明了此时生物甲烷主要以乙酸营养为主,该阶段主要进行的反应见式(1)~(6)。在产气末期的20~32 d 内,细菌群落变化较大的是Alcaligenes与Anaerovorax;古菌群落此时主要以Methanosarcina为主,同时液相小分子物质中的挥发性脂肪酸和醇类物质下降缓慢,而烷烃类物质呈小幅度上升,这表明随着厌氧发酵的进行发酵液中可被微生物利用的营养物质越来越少,处于核心生态位的产氢产乙酸菌受环境因素的改变难以为下阶段的产甲烷菌提供底物,且烷烃类物质的小幅上涨也说明了在整个厌氧发酵过程中时刻在进行煤的水解,但因参与每个阶段的核心菌群很难保持代谢的连贯性,使得发酵系统中微生物活性受到抑制,产甲烷随之停止。
2.2.2 石墨烯对生物甲烷产出的促进机制
整体来看,石墨烯的添加(0.4 g/L)有效增强了整个厌氧发酵的进行。不仅提高了产气初期的甲烷产气量,同时也提前了产甲烷的产气高峰期。在发酵初期,细菌群落中添加石墨烯后Sedimentibacter丰度上升,将发酵液中烷烃类降解为乙酸。水解菌群和产氢产乙酸菌群的活性增强,前期积累的营养物质更充足,使得甲烷产气量高于对照组。在产甲烷高峰期,添加石墨烯后Methanoculleus丰度降低而Methanosarcina丰度显著提高,一方面参与乙酸转化的乙酸激酶、乙酸辅酶A 连接酶、磷酸乙酰转移酶、乙酰辅酶A 脱羰基酶/合成酶β 亚基和γδ 亚基相对丰度都显著高于对照组,这些酶主要与Methanosarcina有关[37],其中乙酰辅酶A 脱羰基酶/合成酶β 亚基和γδ 亚基作为乙酸合成途径中的关键酶,分别增加了233.54%和3.32%,这使得Methanosarcina丰度明显上升且主要进行乙酸营养型产甲烷,已有研究发现石墨烯具有较大的比表面积和较强的吸附性能,通过吸附固定或促进功能微生物富集等作用达到减缓或消除厌氧消化过程中抑制性物质(如NH3、NH4+-N、VFAs、酚类以及重金属等)对厌氧消化效果的影响[38-40],这为发酵系统中的微生物提供了良好的生长环境,提高了各类功能菌群的活性,加快了厌氧发酵进程,为产甲烷菌群提供了丰富的底物;另一方面,细菌群落中Geobacter和Methanosarcina丰度增高,研究表明这2 种菌属能够在厌氧发酵系统中进行直接种间电子传递(DIET)[41],石墨烯的导电性比菌毛更高,可以替代c型细胞色素和导电菌毛成为电子传递媒介,为细胞节省能量[42],同时实现远距离的电子传输,Geobacter氧化有机物产生的电子通过石墨烯转移到充当电子受体的Methanosarcina中用于消耗乙酸/CO2产生CH4,进一步促进了生物甲烷的生成(图9),这也与实验组产甲烷高峰期早于对照组相一致。产气残煤表面的羰基碳(C=O)、羧基碳(COO—)在添加石墨烯后分别下降了42.8%和49.5%,说明石墨烯有效促进了微生物对煤的降解。

图9 石墨烯对厌氧发酵系统强化机制Fig.9 Enhancement mechanism of graphene to anaerobic digestion system
3 结 论
(1)在以煤为底物的厌氧发酵系统中添加0.4 g/L的石墨烯能够有效促进生物甲烷的产出,添加石墨烯的发酵系统中累计甲烷产气量为5.35 mL/g,比对照组(4.48 mL/g)高出19.42%。
(2)在发酵初期,水解菌群(Paraclostridium)和产氢产乙酸菌群(Alcaligenes、Sphaerochaeta)的活性增强,前期积累了充足的营养物质。在产甲烷高峰期,添加石墨烯后Methanoculleus丰度降低而Methanosarcina丰度显著提高,一方面乙酰辅酶A 脱羰基酶/合成酶β 亚基和γδ 亚基作为乙酸合成途径中的关键酶,分别增加了233.54%和3.32%,这使得Methanosarcina丰度明显上升且主要进行乙酸营养型产甲烷,说明添加石墨烯的系统对于发酵液中各类物质的降解速率明显高于对照组,说明石墨烯的添加提高了菌群的活性和降解效率,加快了厌氧发酵进程,为产甲烷菌群提供了丰富的底物;
(3)细菌群落中能够利用乙酸乙醇类物质的Geobacter和Anaerovorax丰度增高,其中丰度升高较明显的Geobacter可能通过与石墨烯辅助的生物电连接与Methanosarcina进行DIET,这种电子传递方式在一定程度上加速了生物甲烷的生成。
(4)产气残煤表面的羰基碳(C=O)、羧基碳(COO—)在添加石墨烯后分别下降了42.8%和49.5%,说明石墨烯有效促进了微生物对煤的降解。

