鸡腿菇产纤溶酶液体发酵体系优化
王今雨,刘晓兰,3*,景 言,郑喜群,3
(1.哈尔滨商业大学 食品工程学院,黑龙江 哈尔滨 150028;2.齐齐哈尔大学 食品与生物工程学院 黑龙江省玉米深加工理论与技术重点实验室,黑龙江 齐齐哈尔 161006;3.黑龙江八一农垦大学 食品学院,黑龙江 大庆 163319)
血栓栓塞性疾病(cardiovascular diseases,CVDs)已成为影响人类健康的第一大杀手,其成因主要是由于纤溶系统异常导致可溶性的纤维蛋白原在凝血酶的作用下转化为不溶的纤维蛋白并在血液中沉积形成血栓[1]。当前主要的溶栓剂有纤溶酶和纤溶酶原激活剂,通过直接或间接溶解血纤维蛋白来降解血栓[2],虽具有较好的溶栓效果,但因特异性差、半衰期短、易引起过敏反应等缺点严重限制了其应用[3],因此,亟需开发安全可靠、副作用小的新型溶栓酶。
纤溶酶是一种特异性水解纤维蛋白的蛋白水解酶。广泛存在于动物、植物和微生物中,其中微生物以其种类繁多、繁殖快、易培养、易改造的特点为开发新型溶栓剂提供了更多可用的资源[4-6]。微生物发酵法是生产纤溶酶的主要方法,可在较短的时间内获得大量的目的产物,目前已从多种微生物代谢产物中分离得到纤溶酶[7-11]。研究发现,在大型真菌的子实体、菌丝体和培养液中均可分离得到纤溶酶,LI G L等[12]从茶树菇子实体中分离得到具有纤溶活性的丝氨酸蛋白酶ACase,并发现其具有体外抗栓活性;CHOI J H等[13-14]从阿魏菇子实体中分离得到纤溶酶,发现该酶可以直接水解纤维蛋白聚合物,抑制纤维蛋白凝块的形成;从牛肝菌子实体中分离得到纤溶酶并研究其酶学性质,发现其属于丝氨酸蛋白酶;LIU X L等[11]以蛹虫草为原料,通过液态深层发酵生产一种新型纤溶酶;崔日花等[15]研究发现,榆干离褶伞纤溶酶对大鼠血栓具有一定的缓解作用。以上结果表明,大型真菌是生产纤溶酶的优良菌种。因此,开发新型食用菌菌种,生产高活性食源性纤溶酶具有现实意义。
鸡腿菇(Coprinus comatu)学名毛头鬼伞,味道鲜美,营养丰富,蛋白质含量高,富含包括人体8种必需氨基酸在内的20种氨基酸及多种生物活性因子,已被联合国粮农组织和世界卫生组织确定为集“天然、营养、保健”功能为一体的16种珍稀食用菌之一[16-17]。其具有抗氧化、降血糖、防止肝损伤、抗肿瘤、提高免疫力、抑菌等多种生理功能[18-19],但目前对鸡腿菇的研究多集中在多糖,尚未发现有其产纤溶酶相关方面的研究。因此,本研究以鸡腿菇为菌种,采用菌丝体液体发酵培养基及发酵法生产纤溶酶,通过单因素试验及响应面试验对其发酵条件进行优化,旨在提高纤溶酶活力,为开发具有溶栓效果的功能性产品提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和材料
鸡腿菇(Coprinus comatus)CGMCC NO.40393:中国普通微生物菌种保藏管理中心。豆饼粉、大米、玉米粉、豆粕、玉米胚芽粕:市售;玉米浆、玉米浆水解液、玉米浆水解粉:齐齐哈尔龙江阜丰生物科技有限公司。
1.1.2 化学试剂
果糖、葡萄糖、蔗糖、麦芽糖、可溶性淀粉、糊精、乳糖(均为分析纯或生化试剂):天津百伦斯生物技术有限公司;氯化钠、硫酸镁、磷酸二氢钾、磷酸氢二钾、硝酸钾、硫酸铵、硝酸铵、磷酸二氢铵、磷酸氢二铵、氯化铵(均为分析纯):天津市科密欧化学试剂有限公司;牛肉膏、酵母粉、胰蛋白胨、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;巴比妥钠(分析纯):天津市凯通化学试剂有限公司;牛凝血酶(酶活2 000 IU/mg)、牛血纤维蛋白原(纯度≥98%)、尿激酶(酶活50 000 U/g):上海经科生物技术有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:将土豆去皮,称质量后切小块煮沸25 min后,用8层纱布进行过滤,取过滤好的土豆汁20%,分别加入琼脂2.5%,葡萄糖2%,蛋白胨0.5%,KH2PO40.1%,MgSO40.05%,pH自然。115 ℃灭菌20 min。
PDA液体培养基:土豆汁20%,葡萄糖2%,蛋白胨0.5%,KH2PO40.1%,MgSO40.05%,pH自然。115 ℃灭菌20 min。
液体发酵培养基:葡萄糖2%,豆粕3%,(NH4)2SO40.2%,装液量30 mL/250 mL,接种量10%,pH自然(pH 6.06)。115 ℃灭菌20 min。
1.2 仪器与设备
pH S-25型酸度计:上海精密科学仪器有限公司;Himac CF15RX冷冻离心机:天美科学仪器有限公司;SX-700压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;ZQZYCF9.9振荡培养箱:上海知楚国仪器有限公司;SW-CJ-2FD超净工作台:苏州净化设备股份公司;0-150 mm电子游标卡尺:桂林广陆数字测控有限公司。
1.3 方法
1.3.1 鸡腿菇种子液、发酵液及粗酶液的制备
在传代培养的PAD培养基上打孔取下直径为0.9 cm的鸡腿菇菌片1片,接种于PDA液体培养基中,24℃、160r/min振荡培养8 d,得到种子液。鸡腿菇种子液按照10%(V/V)接种量接种至发酵培养基中,24 ℃、160 r/min振荡培养6 d,得到发酵液。发酵结束后,将发酵液在4 ℃、10 000 r/min 离心15 min,收集上清液即为鸡腿菇液体发酵粗酶液。
1.3.2 生长曲线及产酶曲线的测定
将鸡腿菇菌种经PDA斜面培养基活化后,接种至装液量为50 mL/250 mL PDA液体培养基中,24 ℃、160 r/min振荡培养,分别在培养时间1~13 d内取样,测定生物量及纤溶酶酶活力。
1.3.3 鸡腿菇纤溶酶液体发酵培养基优化
采用单因素试验,分别探究添加量均为2%的碳源种类(葡萄糖、蔗糖、果糖、麦芽糖、乳糖、糊精、可溶性淀粉、大米粉、麸皮、玉米粉)、最佳碳源添加量(1%、2%、3%、4%、5%)、添加量均为3%的无机氮源种类(KNO3、NH4H2PO4、(NH4)2SO4、NH4NO3、(NH4)2HPO4、NH4Cl)及有机氮源种类(豆粕、豆粕水解液、豆饼粉、豆饼粉水解液、玉米浆、玉米浆水解液、玉米浆水解粉、玉米胚芽粕、牛肉膏、酵母粉、蛋白胨、胰蛋白胨)、最佳有机氮源添加量(1.5%、2.5%、3.5%、4.5%、5.5%),无机盐种类(CaCl2、KH2PO4、MgSO4、K2HPO4、NaCl)及最佳无机盐添加量(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%、0.45%、0.50%)对鸡腿菇产纤溶酶酶活力的影响。每个试验做3个平行。
1.3.4 鸡腿菇产纤溶酶液体发酵培养条件优化
(1)单因素试验
在接种量(3%、5%、10%、15%、20%)、装液量(25mL/250mL、50mL/250mL、75mL/250mL、100mL/250mL、125mL/250mL、150 mL/250 mL)、初始pH值(4.0、5.0、6.0、7.0、8.0)、发酵温度(22 ℃、24 ℃、26 ℃、28 ℃、30 ℃、32 ℃、34 ℃、37 ℃)、发酵时间(4 d、5 d、6 d、7 d、8 d)条件下,考察各单因素对鸡腿菇产纤溶酶活力的影响,每个试验做3个平行。
(2)Plackett-Burman试验
根据单因素试验结果,进行Plackett-Burman试验筛选重要影响因素。选取培养基成分和发酵条件等8个因素作为优化的输入因子。试验选用N=12的设计安排,对果糖(A)、豆饼粉(B)、磷酸二氢钾(C)、硫酸镁(D)、接种量(E)、装液量(F)、发酵时间(G)、发酵温度(H)8个因素进行考察,设置3个虚拟项,每个因素分别取两个水平,响应值为酶活力。Plackett-Burman试验设计因素与水平见表1。

表1 Plackett-Burman试验设计因素与水平Table 1 Factors and levels of Plackett-Burman experiments design
(3)Box-Behnken试验
根据单因素及Plackett-Burman试验结果,选取果糖(X1)、豆饼粉(X2)和发酵时间(X3)3个因素为自变量,以纤溶酶活力(Y)为响应值,进行Box-Behnken试验设计,各因子编码值及自变量水平见表2。

表2 Box-Behnken试验设计的因素及水平Table 2 Factors and levels of Box-Behnken experiments design
1.3.5 分析检测
(1)纤溶酶活力的测定
纤溶酶的活力与其在血纤维蛋白平板上水解纤维蛋白后所形成的溶圈直径呈正相关[20],因此,采用血纤维蛋白平板法[11]测定鸡腿菇纤溶酶活力。取10 μL粗酶液点加于血纤维蛋白平板表面,37 ℃保温6 h后测溶圈直径。以尿激酶为标准蛋白绘制标准曲线,用0.9%的氯化钠溶液分别配制浓度为10 U/mL、30 U/mL、50 U/mL、100 U/mL、150 U/mL、200 U/mL、250 U/mL、300 U/mL的尿激酶溶液,测定尿激酶在血纤维平板上的溶圈直径。纤溶酶酶活力计算公式如下:
y=0.050 6e5.4285x
式中:y为酶活力,U/mL;x为溶圈直径,cm。
(2)生物量的测定
采用干质量法[21],分别将培养1~13 d的菌丝体在8 000 r/min条件下离心后,将菌丝体转移至已称质量的干燥滤纸上,置于60 ℃恒温干燥至水分完全除去,称质量,计算菌丝体干燥前后质量差值即为菌丝体的干质量。
1.3.6 数据处理
采用Origin 8.5绘图及处理数据、Design-Expert 8.0.6软件进行Plackett-Burman及Box-Behnken试验设计和数据分析、SPSS25.0分析软件对数据进行统计分析,并结合Duncan氏法多重比较,实验均重复3次,P<0.05为差异显著性水平。
2 结果与分析
2.1 鸡腿菇菌生长曲线及产酶曲线
鸡腿菇菌丝体生长曲线及产酶曲线如图1所示,在培养时间1~6 d时,菌体生长处于延滞期,鸡腿菇孢子处于萌发状态,生长速率低。培养时间6 d后菌丝干质量迅速生长,培养时间8 d时,菌丝干质量达到最大值,说明菌丝开始分枝繁殖进入快速生长期,此时菌体活力最为旺盛,最适合作为种子液进行发酵培养。培养时间8 d后菌丝干质量逐渐下降,菌体生长逐渐进入衰退期,出现自溶。由于处于快速生长期的菌种酶系活跃,代谢旺盛,发酵生长所需时间短,能够提高代谢物活力,由图1亦可知,当鸡腿菇菌种种龄为8 d时,菌丝干质量及纤溶酶活力均达到最大值。因此,最适鸡腿菇菌种种龄为8 d。

图1 鸡腿菇菌液体种子生长曲线及产酶曲线Fig.1 Growth curve and enzyme production curve of Coprinus comatus
2.2 鸡腿菇纤溶酶液体发酵培养基优化
2.2.1 碳源种类及最适碳源添加量的确定
碳源种类及最适碳源添加量对纤溶酶活力的影响结果见图2。由图2A可知,以果糖为碳源时,鸡腿菇纤溶酶酶活力最高。这可能是因为果糖为单糖,作为速效碳源在发酵中易被微生物直接利用,使菌体迅速生长,与同样是单糖的葡萄糖相比,虽二者分子式相同,但分子结构中羟基的位置不同且代谢途径不同,果糖相较于葡萄糖,在进入糖酵解过程中消耗更少的三磷酸腺苷(adenosine triphosphate,ATP),这可能为微生物发酵产酶提供了更加充分的发酵能量。因此,选用果糖为最优碳源类型,并进一步确定其最适添加量,由图2B可知,在果糖添加量为3%时,纤溶酶活力最高(58.46 U/mL),之后纤溶酶活力随果糖添加量的升高而降低。其原因可能是碳源浓度过高导致细胞渗透压失衡,菌体代谢受到抑制,阻滞鸡腿菇纤溶酶的积累[22-23]。因此,最佳碳源为果糖,最适果糖添加量为3%。

图2 碳源种类(A)及果糖添加量(B)对纤溶酶活力的影响Fig.2 Effects of carbon sources types (A) and fructose addition (B) on fibrinolytic enzyme activities
2.2.2 氮源种类及最适氮源添加量的确定
由于微生物生长环境中存在纤溶酶底物的结构类似物,同时又缺乏其他可利用的氮源,因此,氮源的选择对纤溶酶的生产具有一定的诱导作用[25-26]。本实验分别选取无机氮源和有机氮源,其中有机氮源主要来自蛋白含量丰富的大豆和玉米的农副产物,综合考察不同氮源对鸡腿菇纤溶酶活力的影响。
由图3A可知,无机氮源中磷酸二氢铵所产纤溶酶活力最高为68.8 U/mL。由图3B可知,有机氮源中以豆饼粉所产鸡腿菇纤溶酶活力最高,可达87.25 U/mL。因此,从诱导酶角度,选用有机氮源豆饼粉作为发酵培养基的氮源。豆饼粉是大豆榨油后的下脚料,来源广泛,成分稳定,存在较为丰富的大豆蛋白且含量高、种类多、结构复杂,推测有较多纤溶酶可作用的位点与血纤维蛋白结构相似或一致,有利于诱导鸡腿菇纤溶酶的产生[27-28]。由图3C可知,豆饼粉添加量为3.5%时,所产纤溶酶活力最高,之后纤溶酶活力随豆饼粉添加量的增加而减少,其原因可能由于添加过多的豆饼粉使培养基过于黏稠,溶氧量降低,不利于鸡腿菇的生长及代谢产物的积累。因此,最佳氮源为豆饼粉,最适豆饼粉添加量为3.5%。

图3 无机氮源(A)、有机氮源(B)种类及豆饼粉添加量(C)对纤溶酶活力的影响Fig.3 Effect of inorganic nitrogen source (A), organic nitrogen source (B) types and soybean cake addition (C) on fibrinolytic enzyme activities
2.2.3 无机盐种类及组成的确定
不同无机盐种类对鸡腿菇纤溶酶活力的影响见图4。由图4A可知,不同无机盐中MgSO4、KH2PO4对酶活力的影响最大,NaCl次之。推测K+、Mg2+、Na+容易被菌体利用,积累代谢产物,其中KH2PO4对发酵体系的pH具有一定的缓冲作用,为菌体提供稳定的生长环境,同时其所含磷酸盐可参与ATP、三磷酸鸟苷(guanosine triphosphate,GTP)在内的能量转移反应,为菌体生长和代谢提供能量;Mg2+可能是鸡腿菇纤溶酶活性中心的组分,有助于维持酶的特定构象,对酶的活性有激活作用[29];Na+影响细胞和培养基之间的渗透压,可以提高酶的活力[30]。因此,本实验优先选用MgSO4、KH2PO4为培养基的无机盐组分,并进一步优化其添加量。由图4A和4B可知,随着MgSO4和KH2PO4添加量的增加,所产鸡腿菇纤溶酶活力呈现先增加后降低的趋势,MgSO4和KH2PO4添加量分别为0.20%、0.25%时,纤溶酶活力最高。分析原因可能是由于本发酵培养基配制用水为自来水,自来水中本身还有少量的金属离子,外添加过高的Mg2+和K+可能造成了对菌株产纤溶酶的抑制作用。因此,最适MgSO4添加量为0.20%,最适KH2PO4添加量为0.25%。

图4 无机盐种类(A)及硫酸镁(B)、磷酸二氢钾(C)添加量对纤溶酶活力的影响Fig.4 Effects of inorganic salt types (A), magnesium sulfate (B) and potassium dihydrogen phosphate (C) addition on fibrinolytic enzyme activities
2.3 鸡腿菇纤溶酶培养条件优化单因素试验
2.3.1 装液量的确定
由图5可知,随着装液量在25mL/250mL~150mL/250mL范围内的增加,鸡腿菇纤溶酶活力呈现先增加再缓慢降低的趋势。由于装液量影响发酵液与空气的接触面积,当转速一定时,装液量与氧的传递密切相关[30]。装液量为50 mL/250 mL时,纤溶酶活力最高;当装液量过少时,发酵液中水分随着发酵时间延长而逐渐蒸发,过少的发酵基质不利于菌体生长和发酵产物积累;鸡腿菇是好氧微生物,当装液量过多时,会导致瓶内溶氧不足,不能满足菌体繁殖旺盛期耗氧量大的需求,影响鸡腿菇的生长代谢。因此,最适装液量为50 mL/250 mL。
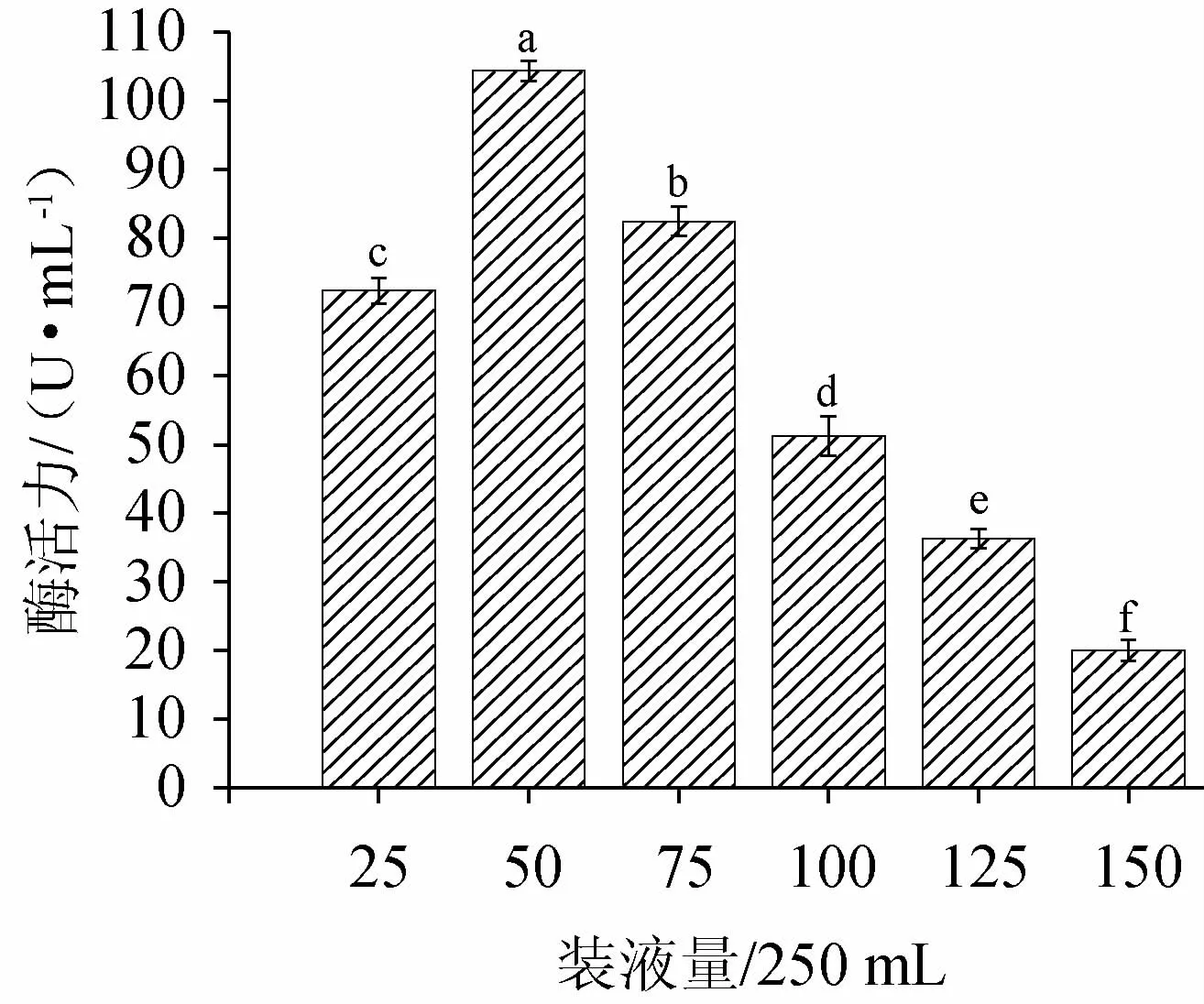
图5 装液量对纤溶酶活力的影响Fig.5 Effect of liquid volume on fibrinolytic enzyme activities
2.3.2 接种量的确定
在发酵实验中,为了加速产物的合成,使菌体能够迅速进入快速生长期,往往会加大接种量,但接种量过大会增加生产成本,因菌体生长过快,使菌体过早的进入快速生长期,产生大量孢子消耗营养物质,同时因培养液黏稠度增加导致溶氧不足,进而影响代谢物的合成[31]。由图6可知,当接种量为10%时,纤溶酶活力最高。接种量<10%时,因接种量过小,菌体未生长饱和,代谢速率缓慢,目标产物产率较低;当接种量>10%时,接种量过多,导致过多菌丝体同时生长繁殖,发酵液黏稠度迅速增加,营养物质消耗过快,影响代谢产物的合成。因此,最适接种量为10%。
2.3.3 初始pH值的确定
在发酵过程中,微生物不断分解和同化营养物质并将其转化为代谢产物,引起发酵液中pH的不断变化,直接影响酶的产量和质量,在发酵过程中主要通过调节培养基初始pH的方法来在控制发酵液的pH值。发酵培养基的自然pH值在6.03~6.12范围,用HCl和NaOH调节发酵培养基的初始pH值,不同初始pH值对纤溶酶活力的影响结果见图7。

图7 初始pH值对纤溶酶活力的影响Fig.7 Effect of initial pH value on fibrinolytic enzyme activities
由图7可知,酶活力随培养基初始pH值的变化呈现先增加后减小的趋势,当初始pH值为6.0时,纤溶酶活力达到最高值,为108.20U/mL。因此,最适培养基初始pH值为自然。
2.3.4 发酵温度的确定
控制发酵温度对菌体生长和产物形成有重要作用。由图8可知,纤溶酶活力随发酵温度的升高呈现先增加后降低的趋势。在发酵温度为22~24 ℃时,纤溶酶活力随之增加;在发酵温度24 ℃时,纤溶酶活力达到最大值(122.73 U/mL);在发酵温度高于24 ℃之后,纤溶酶活力随之下降。因此,最适发酵温度为24 ℃。
2.3.5 发酵时间的确定
由图9可知,纤溶酶活力随发酵时间的延长呈现先增加后降低的趋势。在发酵时间为4~6 d时,纤溶酶活力随之增加;在发酵时间为6 d时,纤溶酶活力达到最大值,为132.02 U/mL;发酵时间>6 d之后,纤溶酶活力随之下降。因此,最适发酵时间为6 d。

图9 发酵时间对酶活力的影响Fig.9 Effect of fermentation time on fibrinolytic enzyme activities
2.4 鸡腿菇纤溶酶培养条件优化Plackett-Burman试验
Plackett-Burman试验共设计12组试验,每组试验重复3次,试验结果见表3,运用Design-Expert 8.0.6软件对表3中的结果进行统计学回归性分析,所得各因素的回归系数及重要性评价见表4。由表4可知,对鸡腿菇纤溶酶活力影响最为显著的3个因素分别为果糖添加量、豆饼粉添加量、发酵时间,其中,果糖、豆饼粉的添加量对纤溶酶活力的影响显著(P<0.05),发酵时间对酶活力的影响极显著(P<0.01),其他因素对酶活的影响不显著(P>0.05)。对纤溶酶活力的影响程度依次为:发酵时间>果糖添加量>豆饼粉添加量。
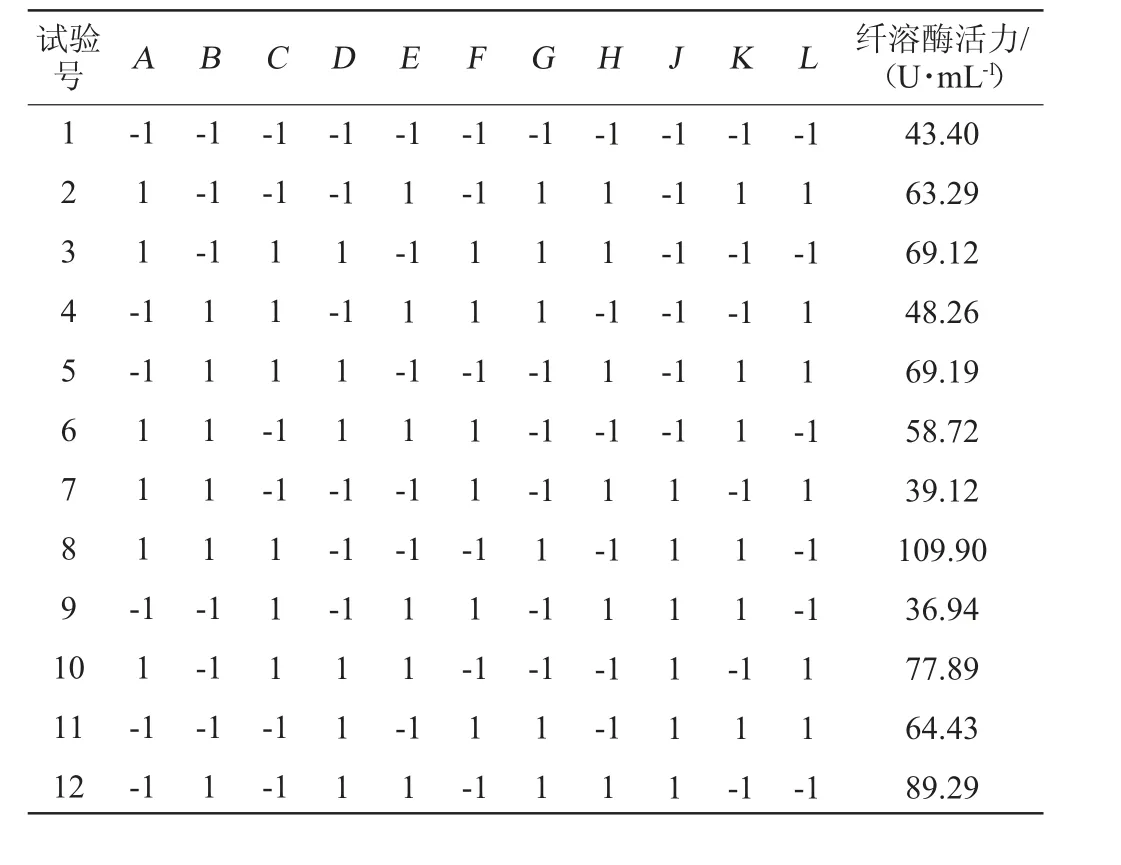
表3 Plackett-Burman试验设计及结果Table 3 Design and results of Plackett-Burman experiments

表4 Plackett-Burman试验设计主效应分析Table 4 Main effect analysis of Plackett-Burman experiments design
2.5 鸡腿菇纤溶酶培养条件优化Box-Behnken试验结果及响应面分析
根据单因素及Plackett-Burman试验结果,选取果糖添加量(X1)、豆饼粉添加量(X2)和发酵时间(X3)为自变量,以纤溶酶活力(Y)为响应值,进行Box-Behnken试验设计,Box-Behnken试验结果表5,回归模型方差分析结果见表6。
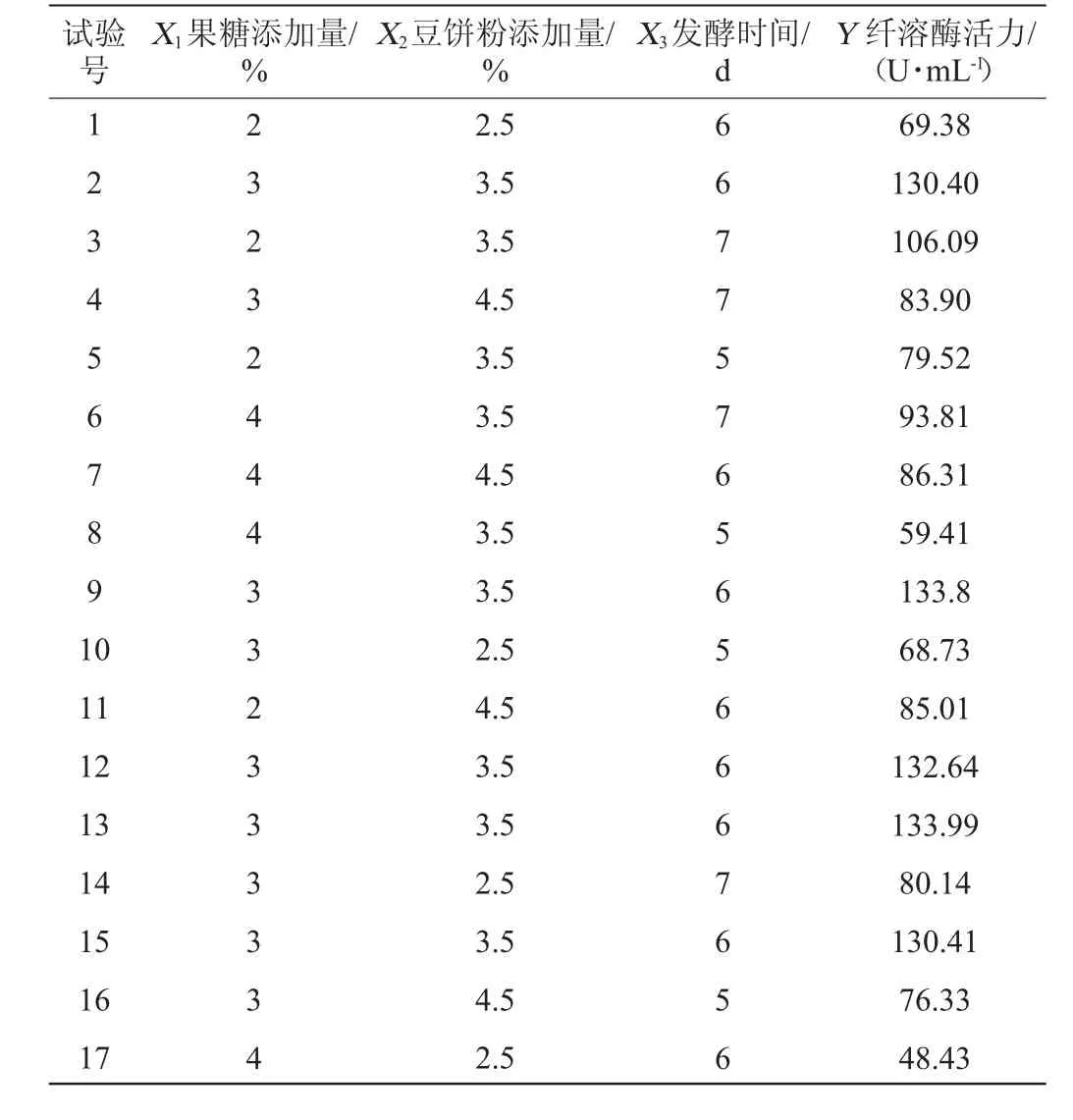
表5 Box-Behnken试验设计及结果Table 5 Design and results of Box-Behnken experiments
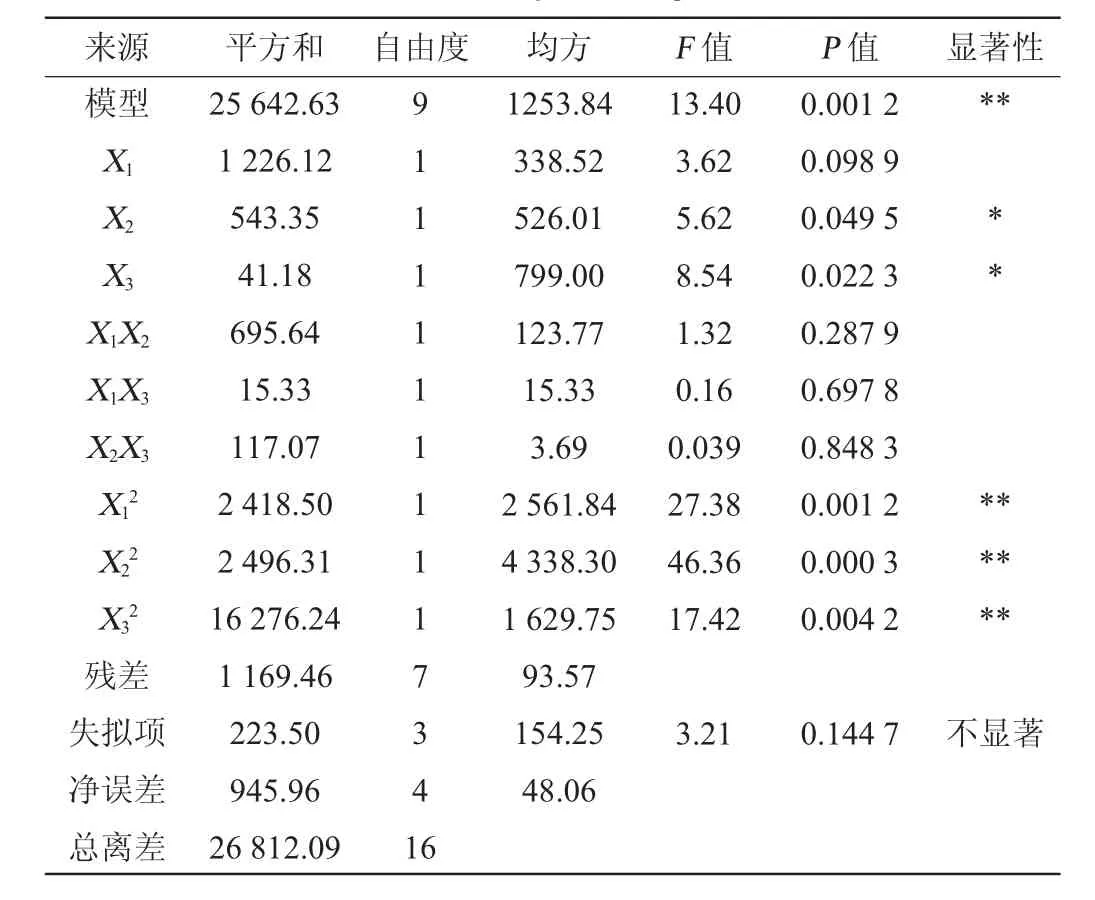
表6 回归模型方差分析Table 6 Variance analysis of regression model
采用Design-Expert 8.0.6 软件,对表5数据进行多元回归拟合,得到果糖添加量(X1)、豆饼粉添加量(X2)和发酵时间(X3)对纤溶酶活力(Y)影响的二次多项回归方程为:Y=129.05-6.5X1+8.11X2+9.99X3+5.56X1X2+1.96X1X3-0.96X2X3-24.67X12-32.10X22-19.67X32
由表6可知,所得回归模型P<0.01,极为显著,说明模型设计合理可用,且失拟项检验P>0.05,不显著,说明试验误差较小,该模型数据可用,此模型决定系数R2=0.965 1,说明模型与实际实验拟合度较高,回归模型理想,故可用此回归模型预测培养基组分和发酵条件与纤溶酶活力之间的关系。由P值可知,一次项X2、X3对结果影响显著(P<0.05),二次项X12、X22、X32对结果影响极显著(P<0.01)。由F值可知,3个因素对结果影响顺序依次为X3>X2>X1,即发酵时间>豆饼粉添加量>果糖添加量。
利用Design-Expert 8.0.6软件对回归方程求解,得到最佳发酵条件为:果糖添加量2.89%,豆饼粉添加量3.61%,发酵时间6.25 d。在此条件下模型预测鸡腿菇纤溶酶活力为131.091 U/mL。为便于实际操作,修正发酵条件为果糖添加量2.9%、豆饼粉添加量3.6%,发酵时间6 d。为了验证模型预测的准确性,在次最佳发酵条件下进行3次平行验证试验。平均纤溶酶酶活实际值为(136.89±2.32)U/mL,与模型预测值相差不大,因此该模型可以较好的预测实际酶活力。
通过对鸡腿菇发酵产酶条件的优化,确定最佳产酶条件为果糖2.9%、豆饼粉3.6%、KH2PO40.25%、MgSO40.2%、pH自然、接种量10%、装液量50 mL/250 mL、发酵温度24 ℃、发酵时间6 d、摇瓶转速160 r/min。在此优化条件下,鸡腿菇纤溶酶活力136.89 U/mL,比优化前提高了4.28倍。
3 结论
本研究以鸡腿菇为菌种,通过单因素试验、Plackett-Burman试验及Box-Behnken试验对其液体发酵产纤溶酶的培养基组分和培养条件进行研究。最终确定最佳发酵培养基为果糖2.9%、豆饼粉3.6%、KH2PO40.25%、MgSO40.2%;最佳发酵条件为液体种子种龄8 d,接种量10%,装液量50 mL/250 mL、发酵温度24 ℃、发酵时间6 d、摇瓶转速160 r/min。在此优化条件下,鸡腿菇纤溶酶活力可达136.89 U/mL,比优化前提高了4.28倍。本研究采用的液体发酵方法是微生物产纤溶酶及提高酶活力的有效途径,为挖掘优良食用菌种来源的纤溶酶,开发新型具有溶栓抗栓作用的酶制剂和功能性食品奠定理论基础。

