L-酪氨酸高产菌株的构建及发酵培养基优化
杜丽红,吕思琪,战俊杰,2,马志鹏,马丽媛,马 雪,范恒军,孟天星
(1.绥化学院 食品与制药工程学院,黑龙江 绥化 152000;2.象屿金谷生化科技有限公司,黑龙江 绥化 152000)
作为芳香族氨基酸之一,L-酪氨酸在人类及动物新陈代谢和生长发育中发挥着重要作用,L-酪氨酸缺乏会使人体在代谢和智力等方面出现异常,同时以L-酪氨酸为前体物质合成的多种衍生物对帕金森、精神分裂等疾病有着很好的疗效[1-2],此外,L-酪氨酸在食品、化工、饲料等行业也有着广泛应用[3]。
目前,L-酪氨酸主要依靠提取法进行工业化生产,提取法以干酪素等含蛋白质丰富的物质为原料,经水解、脱色、结晶等工艺得到L-酪氨酸,但是提取工艺一直存在着原料成本较高、生产周期长、提取收率低、对环境污染较重等问题[4],近几年酶法催化制备L-酪氨酸虽然也得到研究[5],但成本相对较高,而具有成本低、原料广泛、环境污染相对较小等优势的微生物发酵法是目前最具前景的氨基酸生产方式[6-9]。目前,随着生物技术和代谢工程的快速发展,通过合理设计和优化微生物的代谢途径获得可实现氨基酸工业化生产的高效菌株成为了研究热点[10-11]。虽然相关研究不断取得突破性进展,但发酵周期较长、发酵工艺复杂等问题仍未得到有效解决,目前,微生物发酵法生产L-酪氨酸的最高产量为55 g/L,但发酵周期长达为48 h[12]。在L-酪氨酸生产菌株构建过程中,实现L-酪氨酸绿色高效生产的关键是对代谢途径理性设计和调控机制的优化[13-14],通过分子生物学手段获得具有高效生产L-酪氨酸能力且性状稳定的细胞工厂[15]。目前,多数研究将编码L-酪氨酸合成影响关键酶分支酸变位酶/预苯酸脱氢酶(chorismate mutase/prephenate dehydrogenase,TyrA)编码基因tyrA作为重点研究靶点,tyrA基因解反馈和上调表达一直被认为是获得L-酪氨酸生产菌株的必备条件[16-20],而关于基因tyrR敲除对L-酪氨酸积累影响的研究鲜见报道。
本研究以大肠杆菌(Escherichia coli)TRP1为出发菌株,通过上调表达解除反馈抑制的基因aroGfbr,强化莽草酸途径,同时敲除基因tyrR,解除TyrR对aroG、tyrB、aroF、tyrA、aroL、aroP、tyrP多个基因的转录抑制,得到高产L-酪氨酸的重组工程菌株,并以L-酪氨酸产量为评价指标,采用单因素试验及正交试验对重组菌株的发酵培养基进行优化,充分挖掘菌株生产潜力,进一步提高L-酪氨酸产量,为该菌株实现工业化生产提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种、质粒及引物
本研究所用菌株及质粒见表1,所用引物及序列见表2。

表1 本研究所用的菌株及质粒Table 1 Strains and plasmids used in this study

表2 本研究所用引物序列Table 2 Primer sequences used in this study
1.1.2 培养基
LB液体培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,pH 7.0~7.2,121 ℃高压蒸汽灭菌20 min。固体LB培养基:LB液体培养基中添加琼脂20 g/L。
种子培养基[21]:葡萄糖30 g/L,酵母粉10 g/L,蛋白胨5g/L,K2HPO42g/L,MgSO4·7H2O0.8g/L,MnSO4·H2O 2mg/L,FeSO4·7H2O 5 mg/L,VB10.5 mg/L,VH0.5 mg/L。115 ℃高压蒸汽灭菌15 min。
发酵培养基[21]:葡萄糖20 g/L,酵母粉4 g/L,(NH4)2SO45g/L,KH2PO43g/L,MgSO4·7H2O3 g/L,FeSO4·7H2O 20mg/L,MnSO4·H2O 20 mg/L,VB14 mg/L,VH8 mg/L,苯酚红2%。115 ℃高压蒸汽灭菌15 min。
1.1.3 化学试剂
葡萄糖(分析纯):西王药业有限公司;(NH4)2SO4、KH2PO4、MgSO4·7H2O、FeSO4、MnSO4(均为分析纯):天津光复科技有限公司;VB1、VH(均为分析纯):国药集团化学试剂有限公司;蛋氨酸、氨苄青霉素、奇霉素(均为分析纯):上海阿拉丁生物科技有限公司;酵母粉(生化试剂):英国OXOID公司;阿拉伯糖(分析纯):北京鼎国生物技术有限责任公司。其他试剂均为国产分析纯。
1.2 仪器与设备
LRH-250A生化培养箱:广东省医疗器械厂;5 L离位灭菌发酵罐:上海保兴生物设备工程有限公司;BL-75A立式压力蒸汽灭菌器:上海申安医疗器械厂;722可见分光光度计:上海美谱达仪器有限公司;SBA-40E生物传感仪:山东省科学院研究所;Agilent 1200高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Thermo Scientific公司;HZQ-F160振荡培养箱:上海旻泉仪器有限公司。
1.3 方法
1.3.1 大肠杆菌TRP1中基因aroGfbr整合至yjiv位点[22]
gRNA-yjiv表达质粒构建:两条单链DNA(gRNA-yjivup、gRNA-yjiv-down)经退火形成双链DNA,双链DNA包括靶基因的gRNA spacer序列和质粒pGRB的同源序列,经同源重组酶的作用,将双链DNA与线性化质粒pGRB同源重组得到gRNA-yjiv表达质粒。
Ptrc-aroGfbr整合片段构建:用于整合的目的基因片段包括上下游同源臂和目的基因三个片段。以大肠杆菌TRP1的基因组DNA为模板,采用引物对上游同源臂-aroG-up和上游同源臂-aroG-down、下游同源臂-aroG-up和下游同源臂-aroG-down分别PCR扩增得到整合aroG需要的上游同源臂和下游同源臂。以pTrcTAS质粒为模板,采用引物对目的片段-aroG-up和目的片段-aroG-down PCR得到Ptrc-aroGfbr目的基因片段,采用引物对上游同源臂-aroG-up和下游同源臂-aroG-down对上游同源臂、Ptrc-aroGfbr目的基因片段和下游同源臂和进行重叠PCR,得到Ptrc-aroGfbr整合于yjiv位点的片段。
电转化:将包括200 ng Ptrc-aroGfbr整合片段和100 ng gRNA-yjiv表达质粒的电转化体系电转至细胞TRP2,经电转后的细胞立即转入1 mL LB液体培养基中,32 ℃复苏2 h。取100 μL培养液涂布于含有50 μg/mL氨苄青霉素(Ampr)和100 μg/mL奇霉素(Sper)的LB固体培养基平板中,32 ℃培养12 h。
阳性克隆子的筛选:挑选LB固体培养基平板中的单菌落采用引物对上游同源臂-aroG-up和下游同源臂-aroGdown进行PCR扩增验证,同时以出发菌株E.coliTRP1基因组作为对照,通过1%琼脂糖凝胶电泳检测基因条带大小,筛选阳性克隆子。
gRNA-yjiv质粒的消除:将阳性克隆子接种于含有0.2%阿拉伯糖的LB液体培养基中,32 ℃培养12 h,取少量菌液涂布于LB固体培养基平板,32 ℃培养12 h。将同一个单菌落先后分别划线接种于含有50 μg/mL氨苄青霉素的LB固体培养基平板和含有100 μg/mL奇霉素的LB固体培养基平板,32 ℃培养12 h,挑选表型正确的单菌落,将成功消除gRNA-yjiv质粒的菌株命名为TY01。
pREDCas9质粒的消除:将成功消除质粒gRNA的阳性克隆子接种于LB液体培养基中,42 ℃培养12 h。取少量菌液划线接种于LB固体培养基平板中,37 ℃培养12 h。挑选单菌落,并将同一个单菌落先后划线接种于含有100 μg/mL奇霉素的LB固体培养基平板和LB固体培养基平板,37 ℃培养12 h。挑选表型正确的单菌落,得到重组菌株TY02(TRP1,Ptrc-aroGfbr::yjiv)。
1.3.2 重组菌株TY02基因tyrR的敲除[22]
gRNA-tyrR表达质粒构建:两条单链DNA(gRNA-tyrRup、gRNA-tyrR-down)经退火形成双链DNA,双链DNA包括靶基因的gRNA spacer序列和质粒pGRB的同源序列,经同源重组酶的作用,将双链DNA与线性化pGRB同源重组得到gRNA-tyrR表达质粒。
敲除片段构建:用于敲除的目的基因片段包括上下游同源臂两个片段。以大肠杆菌TRP1的基因组DNA为模板,采用引物对上游同源臂-tyrR-up和下游同源臂-tyrR-down、上游同源臂-tyrR-up和下游同源臂-tyrR-down分别进行PCR扩增,得到tyrR的上游同源臂和下游同源臂,采用引物对上游同源臂-tyrR-up和下游同源臂-tyrR-down对两个片段进行重叠PCR,得到敲除基因tyrR的片段。
电转化:将包括200 ngtyrR敲除片段和100 ng gRNAtyrR表达质粒的电转化体系电转至细胞TY01,经电转后的细胞立即转入1 mL LB液体培养基中,32 ℃复苏2 h。取100 μL培养液涂布于含有50 μg/mL氨苄青霉素(Ampr)和100 μg/mL奇霉素(Sper)的LB固体培养基平板中,32 ℃培养12 h。
阳性克隆子的筛选:挑选LB固体培养基平板中的单菌落采用引物对上游同源臂-tyrR-up和下游同源臂-tyrR-down进行PCR扩增验证,同时以出发菌株E.coliTRP1基因组作为对照,通过1%琼脂糖凝胶电泳检测基因条带大小,筛选阳性克隆子。
gRNA质粒的消除:将阳性克隆子接种于含有0.2%阿拉伯糖的LB液体培养基中,32 ℃培养12 h,取少量菌液涂布于LB固体培养基平板,32 ℃培养12 h。将同一个单菌落先后分别划线接种于含有50 μg/mL氨苄青霉素的LB固体培养基平板和含有100 μg/mL奇霉素的LB固体培养基平板,32 ℃培养12 h,挑选表型正确的单菌落。
pREDCas9质粒的消除:将成功消除质粒gRNA的阳性克隆子接种于LB液体培养基中,42 ℃培养12 h。取少量菌液划线接种于LB固体培养基平板中,37 ℃培养12 h。挑选单菌落,并将同一个单菌落先后划线接种于含有100 μg/mL奇霉素的LB固体培养基平板和LB固体培养基平板,37 ℃培养12h。挑选表型正确的单菌落,得到菌株TY03(TY02ΔtyrR)。
1.3.3 高产L-酪氨酸重组菌株TY03的培养条件
种子培养:采用接种环在活化斜面上划取适量菌落转接于装液量为30 mL/500 mL的种子培养基中,37 ℃、200 r/min条件下振荡培养10~12 h作为种子液。
发酵培养:取3 mL种子液接种于含有26 mL发酵培养基的500 mL挡板三角瓶中,37 ℃、200 r/min条件下振荡培养24h。苯酚红为酸碱指示剂,通过发酵液颜色变化补加氨水和葡萄糖,使pH维持在7.0~7.2,每次补加1 mL600 g/L葡萄糖。
1.3.4 高产L-酪氨酸重组菌株TY03发酵培养基组成优化试验
(1)单因素试验
以发酵培养基为基础培养基,分别考察葡萄糖添加量(15 g/L、20 g/L、25 g/L、30 g/L、35 g/L)、酵母粉添加量(2 g/L、4 g/L、6 g/L、8 g/L、10 g/L)、(NH4)2SO4添加量(4 g/L、5 g/L、6 g/L、7 g/L、8 g/L)、KH2PO4添加量(2 g/L、3 g/L、4 g/L、5 g/L、6 g/L)、MgSO4·7H2O添加量(2 g/L、3 g/L、4 g/L、5 g/L、6 g/L)、FeSO4·7H2O添加量(10 mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L)、MnSO4添加量(10mg/L、20mg/L、30mg/L、40mg/L、50mg/L)、VB1添加量(2mg/L、3mg/L、4mg/L、5mg/L、6 mg/L)、VH添加量(6 mg/L、8 mg/L、10 mg/L、12 mg/L、14 mg/L)对重组菌株TY03生长(OD600nm值)及产L-酪氨酸的影响。
(2)正交试验
根据单因素试验结果,选取对重组菌株TY03产L-酪氨酸影响较大的因素酵母粉(A)、MgSO4·7H2O(B)、FeSO4·7H2O(C)、MnSO4(D)、VB1(E)及VH(F)添加量为考察因素,L-酪氨酸产量为评价指标,采用SPSS 22.0软件设计6因素3水平的L18(36)正交试验,试验因素与水平见表3。

表3 重组菌株TY03发酵产L-酪氨酸培养基优化正交试验因素与水平Table 3 Factors and levels of orthogonal experiments for medium optimization of L-tyrosine production fermented by recombinant strain TY03
1.3.5 测定方法
OD600nm值的测定:采用紫外分光光度计测定菌液在波长600 nm处的吸光度值;L-酪氨酸含量的测定[16]:采用高效液相色谱法。
1.3.6 数据处理每一个试验重复3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 重组工程菌株的构建
重组菌株TY02和TY03的PCR鉴定结果见图1。由图1a可知,Ptrc-aroGfbr整合前原基因片段大小为3 356 bp,整合成功后基因片段大小为2 103 bp,说明在Escherichia coliTRP1中成功将Ptrc-aroGfbr整合至假基因位点yjiv,得到菌株TY02。由图1b可知,tyrR基因敲除前片段大小为2 399 bp,敲除成功后基因片段大小为797 bp,说明tyrR基因敲除成功,得到菌株TY03(TY02 ΔtyrR)。

图1 重组菌株TY02(a)及TY03(b)的聚合酶链式反应验证结果Fig.1 Verified results of polymerase chain reaction for recombinant strain TY02 (a) and TY03 (b)
2.2 重组菌株的发酵
为探究基因aroGfbr的上调表达和基因tyrR的敲除对大肠杆菌积累L-酪氨酸的影响,以大肠杆菌TRP1为对照组,采用相同条件对得到的菌株TY02和TY03进行培养,测定OD600nm值及L-酪氨酸产量,结果见图2。由图2可知,三株菌株的生长情况基本一致,发酵24 h后,OD600nm值稳定在33~35。大肠杆菌TRP1的L-酪氨酸产量为(0.2±0.02)g/L,重组菌株TY02的L-酪氨酸产量为(5.8±0.03)g/L,重组菌株TY03的L-酪氨酸产量为(17.4±0.15)g/L,说明两个基因的定向修饰对细胞的生长繁殖影响较小,且细胞积累L-酪氨酸的能力显著提升至86倍,因此强化表达aroGfbr和敲除tyrR的代谢途径修饰策略具有广泛应用性,且具有深入研究的意义。

图2 菌株TRP1、TY02及TY03的生长情况及L-酪氨酸产量Fig.2 Growth and L-tyrosine production of strains TRP1, TY02 and TY03
2.3 重组菌株TY03发酵产L-酪氨酸培养基优化单因素试验结果
2.3.1 不同葡萄糖添加量对重组菌株TY03生长和L-酪氨酸产量的影响
碳源是微生物发酵的基础营养源,碳源利用效率直接影响着生物转化能力[23-24]。因此,考察不同葡萄糖含量对重组菌株TY03生长和L-酪氨酸产量的影响,结果见图3。由图3可知,葡萄糖含量的改变对重组菌株TY03的生长和L-酪氨酸产量没有造成明显差异,最终OD600nm值为34~35,L-酪氨酸产量为17.2~17.4 g/L。因此后续实验中未对该因素进行深入研究。
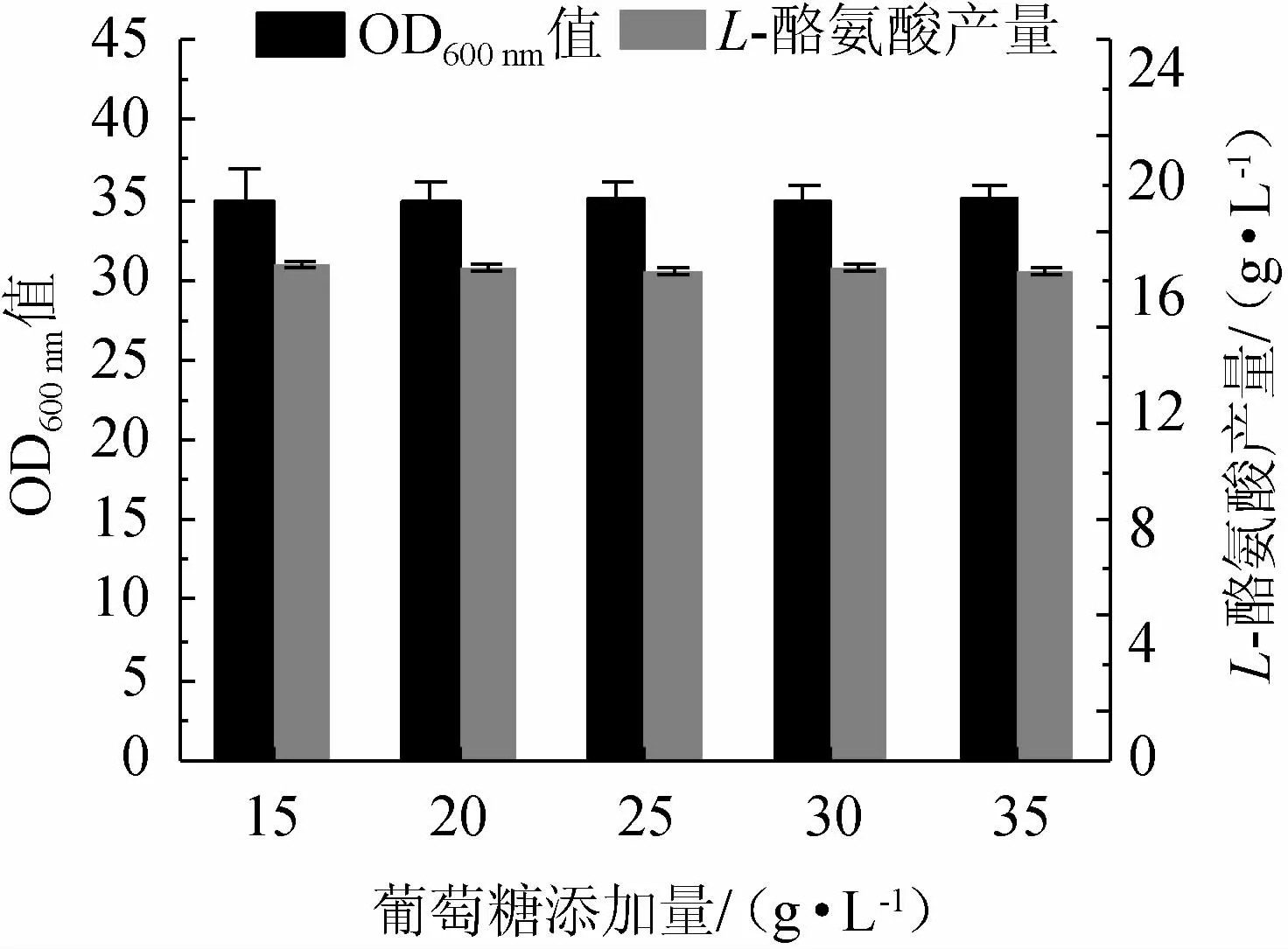
图3 不同葡萄糖添加量对重组菌株TY03生长和L-酪氨酸产量的影响Fig.3 Effect of different glucose addition on growth and L-tyrosine yield of strain TY03
2.3.2 不同酵母粉添加量对重组菌株TY03生长和L-酪氨酸产量的影响
氮源为细胞中蛋白质、氨基酸等含氮物质的合成提供氮元素,因此,氮源的供应影响着细胞积累氨基酸能力[25]。考察不同酵母粉添加量对重组菌株TY03生长和L-酪氨酸产量的影响,结果见图4。由图4可知,随着酵母粉添加量的升高,重组菌株TY03的OD600nm值及L-酪氨酸产量均呈先升高后下降的趋势,分析原因可能是酵母粉添加量过低,无法满足细胞生长需求。当酵母粉添加量为8 g/L,重组菌株TY03的OD600nm值最高达到38,L-酪氨酸产量最高达到(18.9±0.12)g/L。因此,确定最佳酵母粉添加量为8 g/L。

图4 不同酵母粉添加量对重组菌株TY03生长和L-酪氨酸产量的影响Fig.4 Effect of different yeast powder addition on growth and L-tyrosine yield of strain TY03
2.3.3 不同无机盐添加量对重组菌株TY03生长和L-酪氨酸产量的影响
考察(NH4)2SO4、KH2PO4、MgSO4·7H2O、FeSO4·7H2O和MnSO4·H2O添加量对重组菌株TY03生长和L-酪氨酸产量的影响,结果见图5。

图5 不同无机盐添加量对重组菌株TY03生长和L-酪氨酸产量的影响Fig.5 Effect of different inorganic salt addition on growth and L-tyrosine yield of strain TY03
由图5a和图5b可知,(NH4)2SO4及KH2PO4添加量的改变对重组菌株TY03的生长和L-酪氨酸产量没有造成明显差异,最终OD600nm值均维持在35,L-酪氨酸产量分别为(17.3±0.09)g/L、(17.5±0.09)g/L。因此后续实验中未对这两个因素进行深入研究。由图5c~图5e可知,MgSO4·7H2O、FeSO4·7H2O和MnSO4·H2O对重组菌株TY03生长和产酸有较大影响。随着MgSO4·7H2O、FeSO4·7H2O和MnSO4·H2O添加量的升高,重组菌株TY03的OD600nm值及L-酪氨酸产量均呈先升高后下降的趋势。当MgSO4·7H2O添加量为5 g/L时,OD600nm值最高为36,L-酪氨酸产量最高为(18.1±0.21)g/L;当FeSO4·7H2O添加量为30 mg/L时,OD600nm值最高为37,L-酪氨酸产量最高为(18.6±0.18)g/L;当MnSO4·H2O添加量为30 mg/L时,OD600nm值最高为36,L-酪氨酸产量最高为(18.3±0.15)g/L;L-酪氨酸产量较初始发酵培养基下分别提高4.0%、6.8%和5.2%。因此,确定MgSO4·7H2O、FeSO4·7H2O和MnSO4·H2O的最佳添加量为5 g/L、30 mg/L、30 mg/L。
2.3.4 不同维生素添加量对重组菌株TY03生长和L-酪氨酸产量的影响
维生素B1和维生素H对重组菌株TY03生长及L-酪氨酸产量的影响见图6。由图6可知,重组菌株TY03的OD600nm值和L-酪氨酸产量随着VB1、VH添加量的升高均呈先上升后下降的趋势;当VB1添加量为5 mg/L时,重组菌株TY03的OD600nm值和L-酪氨酸产量均达到最大值,分别为37、(18.5±0.15)g/L;当VH添加量为10 mg/L时,重组菌株TY03的OD600nm值和L-酪氨酸产量均达到最大值,分别为37、(18.2±0.14)g/L。因此,确定VB1和VH的最佳添加量为5 mg/L、10 mg/L。

图6 不同维生素添加量对重组菌株TY03生长和L-酪氨酸产量的影响Fig.6 Effect of different vitamin addition on growth and L-tyrosine yield of strain TY03
2.4 重组菌株TY03发酵产L-酪氨酸培养基优化正交试验结果
基于单因素试验结果,确定对结果影响较大的酵母粉(A)、MgSO4·7H2O(B)、FeSO4·7H2O(C)、MnSO4·H2O(D)、VB1(E)和VH(F)添加量为考察因素,以L-酪氨酸产量为评价指标,采用SPSS 22.0软件设计6因素3水平的正交试验,试验设计及结果见表4。

表4 重组菌株TY03发酵产L-酪氨酸培养基优化正交试验设计及结果Table 4 Design and results of orthogonal experiments for medium optimization of L-tyrosine production fermented by recombinant strain TY03
由表4可知,通过极差分析得出各因素对结果的影响主次顺序是FeSO4·7H2O>酵母粉>MnSO4·H2O>MgSO4·7H2O>VH>VB1,最佳试验组合为A2B1C2D3E2F1,在此条件下L-酪氨酸产量为(19.8±0.17)g/L,低于第8组(A2B1C3D3E2F1)试验结果(20.9±0.19)g/L,因此,确定最佳培养基配方组合为A2B1C3D3E2F1,即酵母粉8g/L,MgSO4·7H2O 4 g/L,FeSO4·7H2O 40 mg/L,MnSO4·H2O 40mg/L,VB15mg/L,VH8mg/L,在最佳培养基条件下L-酪氨酸产量比优化前提高了20%。
3 结论
本研究通过在大肠杆菌(Escherichia coli)TRP1中上调表达解除反馈抑制的基因aroG,强化莽草酸途径,同时敲除基因tyrR,解除TyrR蛋白对aroG、tyrB、aroF、tyrA、aroL、aroP、tyrP多个基因的转录抑制,构建得到高产L-酪氨酸的重组工程菌株TY03,L-酪氨酸产量为(17.4±0.15)g/L,是出发菌株大肠杆菌TRP1的86倍。通过单因素试验及正交试验确定重组菌株TY03产L-酪氨酸的最佳培养基组成为酵母粉8 g/L,MgSO4·7H2O 4 g/L,FeSO4·7H2O 40 mg/L,MnSO4·H2O 40 mg/L,VB15 mg/L,VH8 mg/L,(NH4)2SO45 g/L、KH2PO43 g/L,在此条件下,重组菌株TY03的L-酪氨酸产量为(20.9±0.19)g/L,比优化前提高了20%。该L-酪氨酸生产菌株构建工作简单高效,打破了传统L-酪氨酸生产菌株构建思路,为以后L-酪氨酸等氨基酸生产菌株定向构建提供一种全新的思路。
——紫 苏

