戊型肝炎高风险人群的防治进展
朱月萍, 朱传武
苏州市第五人民医院感染科, 苏州市感染性疾病临床医学中心, 江苏 苏州 215131
世界卫生组织(WHO)提出在2030 年消除病毒性肝炎对人类健康的危害。戊型肝炎是常见的病毒性肝炎之一,自发现以来,一直为肝病基础和临床研究领域的专家所关注。戊型肝炎病毒(HEV)主要通过受病毒污染的水或食物经粪口途径传播。据WHO 估计,全球每年约有2 000 万人感染HEV,2015 年全球有44 000 人因HEV 感染导致的急性严重或暴发性肝炎而死亡[1]。我国戊型肝炎主要为散发病例。据国家统计局数据[2]显示,2021年我国戊型肝炎发病人数为26 049例,死亡14例,发病率为1.847 7/10万,死亡率为0.001/10 万。死亡的患者主要见于HEV 感染的高风险人群。并且,既往认为的HEV 感染仅限于急性病程,但在免疫功能低下人群也会发展为慢性HEV感染,出现慢性肝炎,甚至进展到肝硬化[3-4]。因此,加强对HEV 的监测、预防和治疗已引起肝病学界的高度重视。本文就HEV 感染的高风险人群预防和治疗进展进行综述。
1 HEV感染的现状
HEV 基因组为单股正链RNA,有8 个基因型和36 个基因亚型,其中感染人类的HEV 主要是基因1、2、3、4型[5]。基因1型和2型仅限于人类感染,主要因水源受病毒污染而引起感染,可导致孕妇罹患严重肝炎[6];3 型和4 型为人畜共患疾病的基因型,主要通过不洁饮食引起感染,如饮用水源受到粪便污染、未煮熟的受到病毒污染的肉类食物等,感染后可导致老年患者发生严重肝损伤,以及具有慢性肝病的患者发生慢加急性肝衰竭[7]。HEV 感染的主要风险人群是孕妇、免疫功能低下者、老年人、慢性肝病患者以及与HEV感染动物密切接触的人员。
HEV感染时间持续3个月以上可诊断为慢性戊型肝炎,这往往发生于免疫功能低下的人群。慢性HEV感染首次报道于2008年,主要见于多例接受器官移植感染HEV 基因3 型的患者,随后在人类免疫缺陷病毒(HIV)感染者、接受化疗和/或免疫治疗的癌症患者、接受免疫抑制或免疫调节治疗的自身免疫性疾病(如风湿性疾病)患者中也发现有慢性戊型肝炎[8-10]。在实体器官移植中,淋巴细胞计数低以及使用他克莫司的患者,在暴露于HEV 后易发生慢性感染[11]。泰国的一项横断面研究[12]显示,来自东南亚的儿童在肝移植后,抗HEV IgG 和IgM 血清抗体阳性率分别为15%和4%。由于HEV 血清阳性与不明原因的转氨酶升高有关,因此在排除其他病因后,应对患有肝炎的肝移植患儿进行HEV 检测。鉴于器官移植后发生慢性HEV感染的风险较高,一些国家已考虑对器官捐献者进行HEV RNA和抗原筛查,以防受体受到感染[13]。在HIV感染者中,慢性HEV 感染主要见于CD4+T淋巴细胞计数<200/μL 的患者[9]。最近英国报道了1 例COVID-19患者感染基因3 型HEV 并发展为慢性感染,推测其原因可能与长期淋巴细胞减少和使用Tocilizumab(托珠单抗)及类固醇等免疫抑制治疗有关[14]。基因4 型慢性HEV 感染首次报道于我国,为1 例急性淋巴细胞白血病患儿在化疗期间发生[15]。同样Lenglart 等[16]研究提示,接受化疗的免疫功能低下儿童出现肝功能异常,必须及时筛查HEV。欧洲肝病学会(EASL)戊型肝炎临床实践指南[17]建议,对所有不明原因肝功能异常的免疫抑制患者进行HEV检测。但是,在免疫功能低下的慢性戊型肝炎患者中,HEV 抗体检测通常为阴性,因此,往往需要在血液或粪便中检测HEV RNA。
在HBV 和HEV 高流行地区,双重感染的可能性较大。我国一项血清流行病学调查表明,HBV和HEV重叠感染率约为17.6%[18]。在慢性乙型肝炎患者中,重叠感染HEV 会导致肝病急性加重。如果是代偿期肝硬化患者,重叠感染HEV 会导致失代偿期肝病,病死率明显增加。重叠感染是乙型肝炎肝硬化失代偿的危险因素,也是病死率增加的独立预测因素[19]。Tseng 等[20]报道HBV 和HEV 重叠感染的肝硬化患者1 年病死率为50%,而非肝硬化患者仅为2.4%。一项回顾性、观察性队列研究[21]显示,老年乙型肝炎肝硬化患者易重叠HEV 感染。在乙型肝炎肝硬化患者中,HEV 重叠感染发生率为3.3%,高于非肝硬化患者(0.2%~2%)[22]。肝硬化患者合并HEV感染,并发症的发生率高达77%,主要为腹水、肝性脑病、胃肠道出血、细菌感染等[23]。因此,HBV和HEV重叠感染在临床上需引起高度重视。两者重叠感染会加重原有肝病,特别是乙型肝炎肝硬化患者感染HEV 后,并发症的发生率和病死率均明显增加。
孕妇感染HEV主要发生于孕晚期,可以表现为隐性感染、急性感染,严重者可发生肝衰竭[24]。基因1型HEV 在发展中国家最为流行,因此也是绝大多数孕妇HEV感染的主要病毒株。早期症状和临床特征并无特殊,但可迅速发展为急性肝衰竭。暴发性肝衰竭和孕产妇死亡在妊娠晚期尤为常见,凝血功能障碍、弥散性血管内凝血、脑病和脑水肿是常见特征,其发生率高达70%[24-25]。在东南亚和非洲国家已经暴发数次HEV疫情,流行期间在妊娠妇女中发生急性肝衰竭较为常见,病死率高达20%左右[26]。妊娠期发生严重肝损伤的确切机制尚不清楚,严重程度与多种宿主因素有关,包括妊娠期细胞免疫功能下降,雌激素、黄体酮和人绒毛膜促性腺激素水平增加,酮受体信号通路失调,以及氧化应激水平增加、微量营养素和叶酸缺乏等[27-28]。体外研究[29]表明,基因1型HEV在蜕膜和胎盘组织外植体以及基质细胞中比基因3 型能更有效地复制,并产生更具传染性的病毒粒子。同时,基因1 型HEV 可使几种可溶性因子分泌失调,导致严重的组织改变,这些细胞因子的变化与病毒载量相关,并促进组织损伤。
此外,早产、死产和新生儿死亡在HEV 感染的孕妇中也很常见。胎儿死亡主要发生于肝损伤严重的病例,特别是在妊娠晚期。感染孕妇早产风险高,婴儿存活率较低。在印度发生的一次HEV流行期间,感染孕妇中有56%的婴幼儿发生流产、死产或新生儿死亡。死亡的新生儿中,15%~50%死于出生后1周[27]。一项回顾性研究[30]分析了42 例急性戊型肝炎肝衰竭的孕妇,其中40 例发生于孕中晚期,死亡23 例。在分娩的22 例孕妇中,13 例为自然分娩(存活8 例),9 例为死胎引产。
此外,妊娠期HEV感染者发生母婴垂直传播也有明确的证据。研究[31]表明,血液HEV IgM阳性母亲发生HEV垂直传播率高达46.09%。无症状HEV感染母亲母乳喂养一般认为是安全的,但Rivero-Juarez 等[32]在急性肝炎期的母亲乳汁中分离出HEV。因此,母乳喂养可能也是一条潜在的传播路径。
2 HEV感染的预防
预防HEV 感染,重要的措施是切断粪口传播途径,不饮用生水、不食用未煮熟的肉类食品、加强食品和水源管理、改善环境卫生、养成良好的卫生习惯。急性戊型肝炎患者视病情轻重居家或住院隔离治疗至发病后3周。患者粪便和排泄物应严格消毒。对疑似患者和密切接触者应进行医学观察4~6 周[33]。除此之外,血源传播也不容忽视。在全球范围内对献血者HEV 的流行情况已有研究。在多个欧洲国家,献血者HEV 病毒血症的发病率为0.006%~0.19%[34]。由于病毒血症的献血者是无症状的,因此,筛查HEV RNA阳性者是控制传播的唯一可行办法。目前爱尔兰、英国、法国等近10 个欧洲国家已经对献血者实施了强制性HEV筛查[35]
对HEV 感染高危人群,如老年人、慢性肝病患者、育龄期女性应优先接种戊型肝炎疫苗。我国自主研发的重组戊型肝炎疫苗HEV 239(Hecolin®)是目前世界上唯一正式批准的预防HEV 的疫苗。Zhu 等[36]在Lancet上发布了一项用于评估重组戊型肝炎疫苗HEV 239 在健康成人中的疗效和安全性的大规模、随机、双盲、安慰剂对照的Ⅲ期试验结果。在第三剂疫苗接种后的13 个月内,安慰剂组中有15 例受试者确诊患戊型肝炎,而疫苗组则没有,三剂疫苗的有效保护率为100.0%(95%CI:72.1%~100.0%)。疫苗引起的不良反应少且轻微,未发现与疫苗接种相关的严重不良事件。随后对预防效果、免疫原性和安全性进行了持续的随访[37],在4.5 年的随访期间,共确诊60例戊型肝炎病例,其中疫苗组7例(3例接种全程三剂疫苗,1 例接种两剂疫苗,3 例接种一剂疫苗),安慰剂对照组53 例。在接受免疫原性评估且基线血清学阴性的受试者中,接受三剂戊型肝炎疫苗者HEV抗体阳性率为87%,对照组为9%。研究表明疫苗HEV 239在短期和较长期均具有良好的保护效力,安全性高,不良反应少。目前戊型肝炎疫苗的接种对象为16 岁及以上的易感人群,接种剂量为30 μg,按照0-1-6 月方案完成3针疫苗的全程接种。WHO呼吁,对于特殊人群,比如免疫受损患者及孕妇,尚需对疫苗HEV 239给予进一步的研究,以评估其安全性和免疫原性。
最近,Øverbø 等[38]报道了一项在孟加拉国农村地区健康成人中开展的HEV 疫苗的免疫原性和安全性Ⅱ期试验结果。试验纳入100例健康男性和16~39岁的非妊娠女性,按1∶1随机分组,试验组(HEV疫苗)和对照组(HBV疫苗)分别接受两剂疫苗注射(0、1个月)。结果显示,试验组产生了高水平的HEV IgG 抗体,并且除1 例外,其余均维持抗体阳性达2 年之久。研究结果提示,缩短疫苗接种时间仍可获得较高保护力,这为旅游者接种疫苗的可行性提供了参考。HEV 239疫苗含有强力的颗粒免疫原p239,是目前一种有效的疫苗。但也有研究[39-40]报道,将白喉毒素的无毒突变体CRM 197(cross-reacting material 197)作为偶联疫苗的载体蛋白,单独作为分子内佐剂,显著提高了非颗粒形式的目标靶点的免疫原性,有进一步提高疫苗疗效的作用。
3 戊型肝炎的治疗
在大多数情况下,戊型肝炎是自限性的,不需要特殊治疗。只有少数出现急性肝炎症状,如黄疸、乏力、纳差、尿黄,或者出现肝外受累时需给予治疗。在急性发作期,患者需居家或者住院隔离,注意休息,低脂肪/中等量蛋白质、高维生素饮食,密切监测肝功能、凝血功能等指标。肝功能显著异常者,需加强护肝、降酶治疗;表现为胆汁淤积性黄疸者,可使用熊去氧胆酸、S-腺苷蛋氨酸等治疗。重症患者在内科综合治疗基础上,可辅以血浆置换、胆红素吸附等治疗。妊娠期孕妇在确诊为肝衰竭时,应尽早终止妊娠。
接受化疗、免疫抑制剂治疗或免疫功能低下患者,如实体器官移植、骨髓移植、HIV阳性人群,若HEV持续阳性,得不到及时诊断和治疗,可引起肝功能持续异常,并快速进展为肝纤维化、肝硬化[41]。目前在EASL 指南中,对于实体器官移植慢性HEV 感染者首选的治疗方案是减少免疫抑制药物的剂量,这可使30%的HEV感染者自发清除病毒[17,42]。然而,减少免疫抑制并非对所有移植患者都是可行的,因为可能导致急性排斥反应的风险增加,特别是在心脏、肺或胰腺移植患者中。利巴韦林单药治疗3个月已被推荐为慢性HEV感染的一线治疗方案,用药剂量为600 mg/d,大多数病例可实现持续的病毒学应答,复发的患者可使用利巴韦林再治疗6个月[17,33]。Ankcorn等[43]报道65 例英格兰和威尔士的慢性HEV 感染者,接受利巴韦林治疗后,病毒学复发率为17%。除利巴韦林外,干扰素也可用于肝移植患者合并HEV 感染的抗病毒治疗[44]。Gallacher 等[45]报告了1 例利巴韦林难治性患者,该患者应用2 个疗程的利巴韦林和1 个疗程的聚乙二醇干扰素(PEG-IFN)联合利巴韦林治疗均告失败,但在应用Ledipasvir/Sofosbuvir(来迪派韦/索磷布韦)联合利巴韦林治疗后获得应答。研究表明,利巴韦林和索磷布韦联合治疗具有抗HEV 的活性[46],但尚无来迪派韦单药治疗HEV 的相关研究。就该病例而言,取得的疗效是否与加用来迪派韦有关也无法确定。HIV 感染者或血液系统恶性肿瘤接受化疗的患者,如果存在慢性或持续HEV 感染,也可应用利巴韦林进行抗病毒治疗[47]。根据国内外指南或共识[17,33],实体器官移植患者慢性HEV 感染的抗病毒治疗归纳见图1。近期,Zhang等[48]研究表明,热休克蛋白90(heat shock proteins 90,Hsp90)抑制剂在体外显著抑制HEV 复制,其有效性超过常规抗病毒药物利巴韦林和干扰素,靶向ORF1-hsp90 复合物可能是一种安全有效的治疗HEV 感染的新策略。目前,在实验模型和患者中,仍有大量治疗HEV 感染的候选药物或疗法正在研发中[4]。
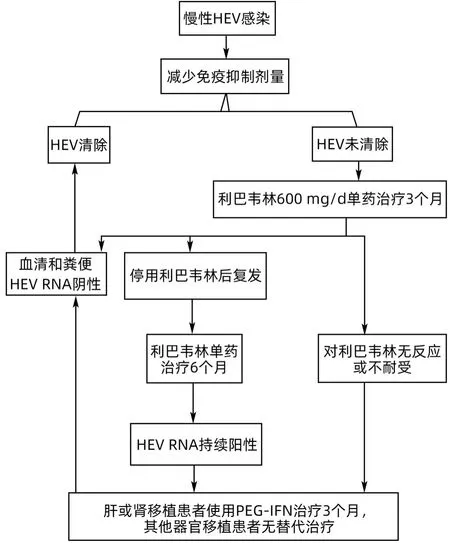
图1 实体器官移植患者慢性HEV感染的抗病毒治疗流程Figure 1 Flow chart of antiviral therapy for chronic HEV infection in solid organ transplant patients
对于妊娠期女性,目前尚无明确的、可供选择的抗HEV 药物。利巴韦林与PEG-IFN 均有致胎儿畸形的风险,索磷布韦虽有抗HEV 的活性,但单药治疗可能也不适合[49]。因此,妊娠期HEV 感染的抗病毒治疗仍是目前的难点。
4 总结
HEV 感染是世界范围内急性病毒性肝炎的主要原因,绝大多数HEV 感染者可无症状或症状轻微,但是孕妇、慢性肝病患者可能会发生严重的肝炎甚至肝衰竭。免疫功能低下者暴露后有发展为慢性戊型肝炎的风险。多项研究表明,接种HEV 239 疫苗后,近期和远期的保护效果良好,老年人、慢性肝病患者、育龄期女性应优先接种戊型肝炎疫苗。慢性戊型肝炎的抗病毒治疗,利巴韦林是一线首选的药物,但对利巴韦林或PEG-IFN 治疗有禁忌证或不耐受的患者,以及对利巴韦林和/或PEG-IFN 再治疗后复发或无应答患者,目前尚无有效的替代药物。
利益冲突声明:本文不存在任何利益冲突。
作者贡献声明:朱月萍负责查阅文献,起草文章;朱传武负责拟定课题,设计写作思路,指导撰写文章并最后定稿。

