环β-1,2-葡聚糖-姜黄素包合物的体外益生特性研究
吴传超,梁瑞雨,张洪涛,高敏杰,朱莉,詹晓北
(江南大学 生物工程学院,江苏 无锡,214122)
环β-1,2-葡聚糖(cyclosophoraose, Cys)是由根瘤菌属和土壤农杆菌属等微生物合成环状低聚糖,由β-1,2连接的D-吡喃葡萄糖单元组成[1]。Cys具有良好的水溶性(Cys为250 g/L;环糊精为18 g/L),且聚合度较环糊精聚合度大(Cys为17~25;环糊精为6~8),环状空腔直径更大(Cys为1.30 nm;环糊精为0.85 nm)[2]。Cys最重要的功能特性是由于其具有适应性的疏水三维腔,能够与广泛的客体分子形成非共价包合物。这些主-客体体系的包合物通过氢键、范德华相互作用和静电吸引等各种相互作用发生[3]。相比于环糊精,单位体积的Cys可以包合更多的物质、携带更大的分子[4],使得Cys在食品、药物递送系统、医学应用中显示出巨大的应用前景[5]。
姜黄素(curcumin, Cur)是一种从干燥的姜黄根茎中提取的传统多酚,被称为黄金营养品[6]。Cur具有多种促进结肠健康作用的膳食多酚而备受关注[7]。但其在水溶液中的溶解度较差(0.6 μg/mL)且稳定性低,在到达结肠之前会在消化道发生降解或代谢,限制其商业应用[8]。因此,增加Cur水溶性从而提高其生物利用度显得尤为重要。Cur结构中含有两个芳香环,携带多个羟基,可以与糖形成缀合物[9]。虽然已有报道环糊精与Cur形成络合物以提高其水溶解度[10],但其强结合力和较低的水膨胀能力可能会给环糊精作为Cur的高效递送系统带来内在缺陷。因此选择更合适载体来改善其溶解度,保护其在胃中的不利条件并保持其在结肠中的释放调节肠道菌群显得尤为重要[7]。
研究表明,肠道微生物对人类健康起着重要作用,包括维持肠道屏障的完整性、增强人体免疫力、抑制肠道病原体和维护肠道生态平衡[11]。因此,保持肠道微生物的多样性和动态平衡对宿主健康至关重要。益生元是一些不被宿主消化吸收,能够选择性促进体内有益生菌代谢和增殖,能够帮助宿主改善机体健康[12]。一些膳食纤维,特别是抗性低聚糖(低聚果糖)(fructo oligosaccharide, FOS)被公认为理想益生元[13]。此外,越来越多的研究[7-8]还证明了酚类物质与肠道微生物群之间的相互作用,表明它们是益生元的候选化合物。酚类物质通过选择性地刺激结肠中有益细菌的生长或活性和抑制潜在的致病性细菌来调节微生物多样性,对宿主产生有价值的影响。相反,肠道微生物也可以调节酚类化合物的活性。这种相互作用可以调节酚类物质的代谢和生物利用度,将其转化为有利代谢物[12]。益生元经过肠道微生物发酵后主要代谢物是短链脂肪酸(short-chain fatty acids,SCFAs),主要成分是乙酸、丙酸和丁酸等,它们对于维持大肠的正常功能和结肠上皮细胞的形态和功能具有重要作用[11]。因此,我们假设结合Cur可能是Cys/Cur对健康益处的关键因素。Cys是肠道远端束结合Cur的载体,在远端束发生潜在的微生物转化。然而,Cys中结合Cur的释放及其对Cys/Cur益生特性的影响尚不清楚。
鉴于上述情况,首先探究Cys/Cur对双歧杆菌属和乳杆菌属体外发酵培养实验,比较FOS、Cys和Cys/Cur对双歧杆菌属和乳杆菌属常见肠道益生菌益生活性的影响,评价其对不同双歧杆菌属和乳杆菌属的生长和产酸能力。在此基础上,通过体外模拟胃肠道消化和健康人粪便发酵进一步探究Cys/Cur潜在益生特性。
1 材料与方法
1.1 实验菌种
动物双歧杆菌(Bifidobacterium.animals)ZJTZ1M2、短双歧杆菌(Bifidobacterium.breve)FWX346、青春双歧杆菌(Bifidobacterium.adolescentis)FHNFQ41M3、嗜酸乳杆菌(Lactobacillus.acidophilu)LA28、干酪乳杆菌(Lactobacillus.casei)FJSSZ4L6、鼠李糖乳杆菌(Lactobacillus.rhamnosus)FFJLY7L1来自江南大学(中国无锡)食品微生物菌种保藏中心。
1.2 试剂与培养基成分
人工胃液和人工肠液,南京新帆生物科技有限公司;薄层色谱板[(thin-layer chromatography, TLC),硅胶60],绿百草科技有限公司;微孔滤膜,南通海之星实验设备有限公司;姜黄素,中国中大公司;其他试剂均为国产分析纯。Cys和Cys/Cur参考WU等[14]的方法,由本实验室合成。
MRS培养基(g/L):胰蛋白胨10.0、牛肉提取物10.0、酵母提取物5.0、葡萄糖3.0、K2HPO42.0、乙酸钠5.0、MgSO40.2、MnSO40.2、CaCl20.45、柠檬酸铵2.0、L-半胱氨酸0.5、吐温80 1 mL,pH 6.5;肠道厌氧基础营养培养基(g/L):蛋白胨2.0、酵母提取物2.0、NaHCO32.0、NaCl 0.1、KH2PO40.04、K2HPO40.04、L-半胱氨酸盐酸盐0.5、牛胆盐0.5、CaCl20.01、MgSO40.01、血红素0.025、刃天青0.001、维生素K 0.002、吐温80 2 mL。
1.3 仪器与设备
HYQX-Ⅱ厌氧培养箱,上海跃进医疗器械有限公司;安捷伦-1260高效液相色谱仪、7890A气相色谱仪,美国Agilent公司;SBA-40生物传感分析仪,山东省科学院生物研究所。
1.4 实验方法
1.4.1 体外模拟Cys及Cys/Cur的唾液、胃液和小肠液消化
参考SHI等[15]的方法在体外模拟Cys和Cys/Cur消化。将100 mL人工唾液加入到100 mL 样品溶液(Cys溶液或超纯水溶液)(0.5 mg/mL)和100 mL超纯水溶液中。唾液消化在37 ℃(100 r/min)的摇床培养箱中进行。分别在0、15、30 min时取5 mL样品,然后煮沸10 min使唾液淀粉酶失活。剩余唾液消化液进一步用于模拟胃消化。
仿生胃肠反应器(biomimetic gastrointestinal reactor,BGR)是本实验室设计的一种新型体外消化模型,本研究中只使用了胃和小肠反应器[12]。剩余的唾液消化液(Cys或超纯水溶液)及Cys/Cur溶液通过蠕动泵输送到BGR胃反应器中等量的人工胃液中。模拟胃消化液pH值控制在3.0。分别在0、0.5、1、2 h下取胃消化液5 mL,煮沸10 min。剩余的胃消化液 (Cys、Cys/Cur溶液或超纯水溶液)通过蠕动泵转移到BGR小肠反应器中,然后与等体积的人工小肠液结合。模拟肠道消化液pH值控制在7.0。随后,分别在0、1、2、4 h收集小肠消化液(5 mL)煮沸后进一步分析。从每个消化阶段提取样品,用蒽酮-硫酸法和DNS比色法测定Cys消化液中的总糖和还原糖的含量。
1.4.2.检测Cys降解和Cys/Cur释放Cur的方法
薄层色谱法测定了Cys的模拟消化过程。样品(2 μL)置于薄层板上,以V(正丁醇)∶V(乙醇)∶V(水)=5∶5∶9为流动相,直至展开至适当位置。在薄层色谱板上喷上地衣酚试剂(3,5二羟基甲苯900 mg+无水乙醇375 mL+蒸馏水25 mL+浓硫酸50 mL),色谱后在105 ℃下加热5 min显色。每个模拟消化阶段的Cys/Cur释放的Cur检测方法参考WU等[14]的方法,Cur的释放率按照公式(1)计算:

(1)
1.4.3 双歧杆菌属和乳杆菌属体外静态培养方法
体外分批发酵系统在严格的厌氧条件下进行单个双歧杆菌属和乳杆菌属菌株的培养。通过在MRS培养基中培养来活化细菌菌株。将FOS、Cys和Cys/Cur分别作为碳源(3 g/L)取代MRS培养基中的葡萄糖,不含葡萄糖的MRS作为空白组(Blank组)。将种子液以10%的接种比接种于厌氧管中,然后转移到厌氧培养箱中于37 ℃培养24 h,并在0、8、16、24 h分别取样(5 mL),测定发酵液的OD600值、pH值、乙酸和乳酸浓度来评价益生活性。
1.4.4 利用人粪便微生物菌群体外发酵
用无菌粪便收集管采集4名健康志愿者(2男2女,年龄20~25岁)的粪便,将这4份新鲜的粪便在厌氧环境下等量混合后,用无菌PBS稀释,得到粪便匀浆10 mg/mL。在无菌条件下通过4层纱布过滤去除残渣,将粪便匀浆接种到不同组的肠道厌氧基础营养培养基中。阴性对照组(Blank组)为肠道厌氧基础营养培养基(无碳源),实验组分别以FOS(阳性对照组)、Cys和Cys/Cur为碳源添加到肠道厌氧基础营养培养基中,质量浓度均为5 mg/mL。37 ℃孵育24 h,在0、8、16、24 h分别采集样品进一步分析。
1.4.5 短链脂肪酸和乳酸的测定
短链脂肪酸浓度的测量采用GAO等[16]的方法。取离心后的发酵上清液(1 mL),添加终浓度为1 mmol/L的2-甲基丁酸作为内标,再向其中添加250 μL浓盐酸和1 mL乙醚,振荡混匀。收集有机层,使用有机滤膜过滤后备用。取样品0.5 μL注入气相系统,采用HP-INOWAX 色谱柱(30 m×0.25 mm×0.25 μm)和火焰离子化检测器。乳酸浓度使用生物传感分析仪测量。
1.4.6 粪便菌群组成的检测方法
用CTAB/SDS法提取基因组DNA,稀释至1 ng/μL。在稀释基因组DNA的基础上选择特异性引物,用PCR扩增16S rRNA基因的V3~V4区。得到的PCR产物被纯化。测序文库使用NEBNext®UltraTMIIDNA Library Prep Kit生成,并用Qubit和Q-PCR进行定量。最后,在Illumina NovaSeq平台上对文库进行测序[8]。
1.5 数据分析
使用Origin 2022软件进行制图,所有实验在3个生物重复中进行。采用单因素方差分析和Duncan′s检验(mean±SD,n=3),用SPSS 19.0软件进行评价。不同字母表示差异显著(P<0.05)。
2 结果与分析
2.1 Cys和Cys/Cur体外消化实验
如附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.034734),Cys的总糖和还原糖含量在不同的消化时间没有显著变化。因此,消化液不会降解Cys,也不会导致还原糖含量的增加(P<0.05)。如附图1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.034734),Cys降解不显著,说明Cys对胃肠道的水解条件和消化酶反应稳定。从而使它们成为有益的结肠细菌可用的、更持久的潜在碳源,还可以作为理想的包埋载体材料来承受胃肠道上部的恶劣环境。
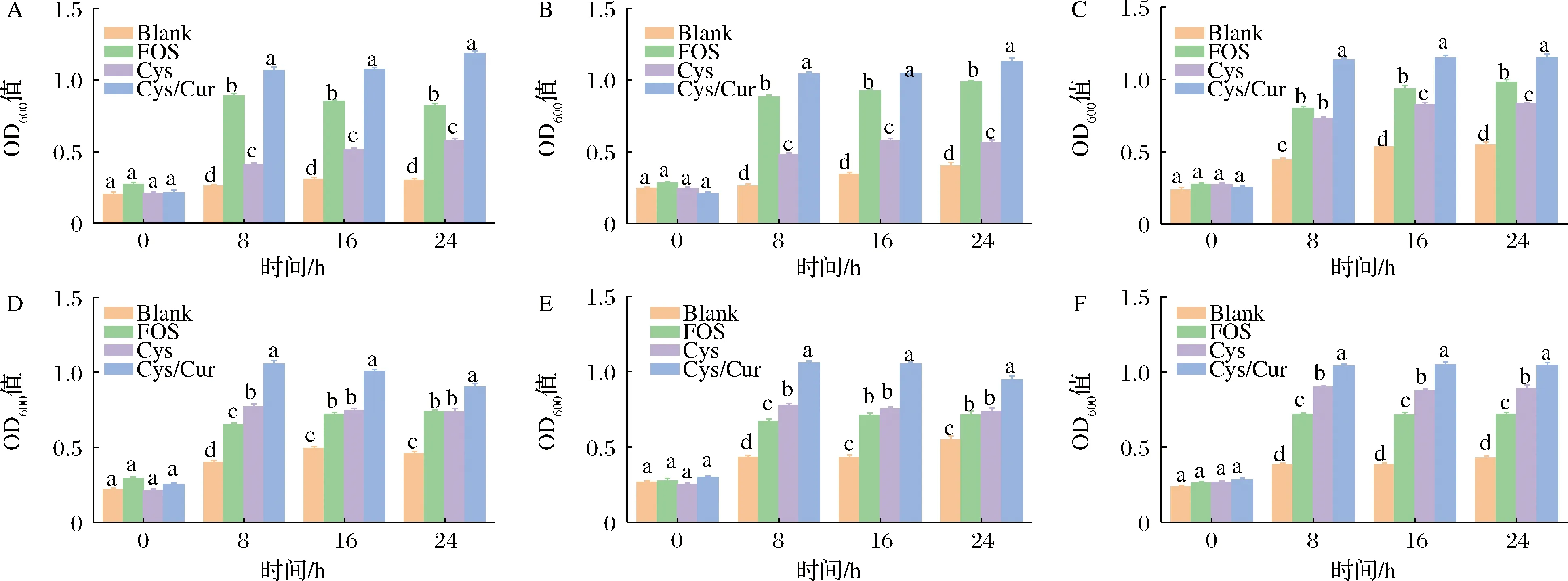
A-B.animals ZJTZ1M2;B-B.breve FWX346;C-B.adolescentis FHNFQ41M3;D-L.acidophilu LA28;E-L.casei FJSSZ4L6;F-L.rhamnosus FFJLY7L1图1 不同碳源对双歧杆菌属和乳杆菌属发酵生物量的影响Fig.1 Effects of different carbon sources on biomass of Bifidobacterium and Lactobacillus fermentation注:不同小写字母代表差异显著(P<0.05)(下同)。
如附图2所示(https://doi.org/10.13995/j.cnki.11-1802/ts.034734),在胃肠道消化过程中,Cys/Cur逐渐分解,释放出Cur,最终的释放率为(88±1.8)%。说明Cys/Cur成功地保护了被包裹的Cur免受暴露于胃消化条件下的消化。这一现象归因于Cys的存在,可以提供界面层和能量屏障,保护Cur不被胃蛋白酶消化。在通过模拟肠道的过程中,Cys/Cur包合物中的Cur逐渐释放。此外,在模拟肠液中,包埋材料聚集并形成团块。这种现象的发生可能是因为包合物被胰酶部分水解,pH值和离子强度的改变改变了包合材料之间的静电相互作用[17]。因此,包埋Cur的Cys可以潜在地携带和稳定Cur,提高其生物利用度。
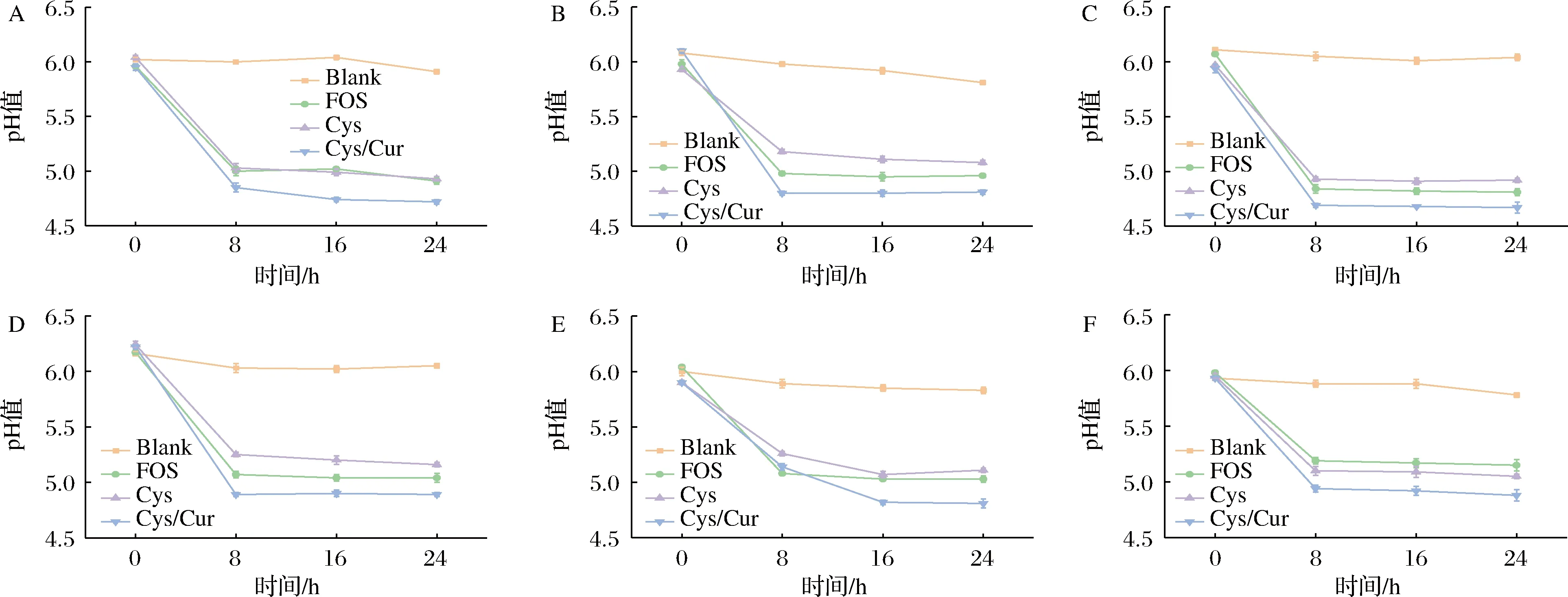
A-B.animals ZJTZ1M2;B-B.breve FWX346;C-B.adolescentis FHNFQ41M3;D-L.acidophilu LA28;E-L.casei FJSSZ4L6;F-L.rhamnosus FFJLY7L1图2 不同碳源对双歧杆菌属和乳杆菌属发酵pH值影响Fig.2 Effects of different carbon sources on pH value of Bifidobacterium and Lactobacillus fermentation
2.2 不同碳源对双歧杆菌属和乳杆菌属活性的影响
2.2.1 不同碳源对双歧杆菌属和乳杆菌属生长的影响
不同种属的益生菌对碳源的吸收利用与酶系及转运能力有很大差异,因此对不同碳源的利用率会有很大的不同[18]。与Blank组相比,在发酵24 h后,不同碳源组(FOS、Cys和Cys/Cur)可以不同程度地促进双歧杆菌属和乳杆菌属生长(图1)。以Cys/Cur为碳源的双歧杆菌属和乳杆菌属的生物量在0~8 h期间内显著增加(P<0.05),在8~24 h生物量增速放缓(P>0.05),在发酵24 h时,Cys/Cur组对B.animals、B.breve、B.adolescentis、L.acidophilus、L.casei和L.rhamnosus的OD600值分别为1.184±0.018、1.129±0.026、1.152±0.023、0.902±0.024、0.946±0.025和1.042±0.020。在Cys/Cur组中,与双歧杆菌属相比,Cys/Cur对于乳杆菌属的增殖作用稍弱,这可能是由于利用碳源的能力取决于其底物偏好性和酶对复杂碳源的水解催化能力。此外,乳杆菌属对多酚更敏感,低浓度的多酚容易起到抑制生长的作用[19]。发酵24 h时,Cys组在双歧杆菌属上的生物量显著低于FOS组(P<0.05),可能的原因是随着寡糖的聚合度和分子质量的增加,其发酵性降低,需要较长的发酵周期[20]。但发酵24 h后,Cys/Cur组在相同益生菌上的生物量显著高于Cys和FOS组(P<0.05),可能的原因是结合的多酚可以通过双歧杆菌属和乳杆菌属中的相关酶促反应从包埋基质中释放成游离形式从而被益生菌修饰成比母体Cur更具益生活性的代谢产物[21]。这些结果证实了Cys中结合Cur可以更好的促进双歧杆菌属和乳杆菌属生长。
2.2.2 不同碳源对双歧杆菌属和乳杆菌属培养基pH值的影响
结肠的pH值下降程度还可以作为发酵过程中的产酸能力的评价指标[22]。如图2所示,在发酵的24 h 期间,Blank组中双歧杆菌属和乳杆菌属的pH值几乎没有变化(P>0.05),始终维持在(6.02±0.02)~(5.78±0.02)。发酵时间从0~24 h,FOS、Cys和Cys/Cur组的pH 值均先显著下降(P<0.05)后趋于稳定,变化趋势与ΔOD600一致。发酵结束时,以Cys/Cur为碳源对培养基pH的影响最大,各组pH值分别下降至4.72±0.02、4.81±0.02、4.67±0.05、4.89±0.02、4.81±0.04和4.88±0.05,FOS和Cys组的变化相似。以上结果表明,FOS、Cys和Cys/Cur组可以为双歧杆菌属和乳杆菌属利用发酵产酸,但同一种益生菌对不同底物的嗜好性,因而代谢形成酸类物质的量不同,致使发酵的pH值也不同。而随着培养时间的延长,培养基中的营养物质基本被分解,益生菌的生长变缓和代谢水平下降,培养基中pH便趋于稳定。由于乳杆菌属在生长量增加量普遍低于双歧杆菌属,导致乳杆菌属培养基的pH值弱于双歧杆菌属,表明乳杆菌属代谢产酸能力要弱于双歧杆菌属。此外,还有一个有趣的发现,Cys和Cys/Cur在0~4 h时具有相似的益生元特性,可能是在发酵初期缺乏足够的多酚释放来影响细菌的益生元特性。
2.2.3 不同碳源对双歧杆菌属和乳杆菌属产乙酸和乳酸的影响
如图3所示,发酵结束时,不同底物对双歧杆菌属和乳杆菌属的促乙酸及乳酸产生效果的差异显著。6株益生菌在体外发酵Cys/Cur过程中产生乙酸浓度分别是(61.11±5.01)、(59.04±2.41)、(57.45±4.46)、(53.63±2.01)、(50.36±4.21)和(52.62±3.01) mmol/L,乳酸质量浓度分别是(3.23±0.01)、(3.22±0.03)、(3.30±0.02)、(2.92±0.05)、(3.15±0.03)、(3.48±0.02)mg/mL,显著高于其他组(P<0.05),此外双歧杆菌属产生的乙酸总体略高于乳杆菌属。
2.3 不同碳源对健康人肠道菌群的影响
2.3.1 不同碳源对健康人肠道菌群发酵pH及SCFAs生成的影响
本研究中,在发酵0、8、16、24 h后测定pH和SCFAs浓度(图4)。益生元可通过降低结肠的pH值抑制病原体的生长[22]。图4-A表明,在无碳源添加(Blank组)的情况下,发酵液的pH值略微下降,以FOS、Cys和Cys/Cur为碳源进行粪菌发酵,各组发酵液的pH值均明显降低,这与单菌发酵的结果相一致。其中Cys/Cur组发酵pH值由7.49±0.11下降至4.32±0.12,显著低于其他组(P<0.05)。这些结果表明,FOS、Cys和Cys/Cur发酵可能产生大量的SCFAs[23]。

A-pH值;B-乙酸;C-丙酸;D-丁酸;E-总短链脂肪酸;F-乳酸图4 不同碳源与粪菌发酵对pH和SCFAs浓度的影响Fig.4 Effects of different carbon sources during fecal fermentation on pH and SCFAs concentration in vitro
由图4-B可知,发酵结束时,各组的乙酸生成量在SCFAs中均占主导地位。乙酸有助于保持肠道环境稳定,并滋养结肠中的其他有益细菌[24]。FOS、Cys和Cys/Cur组的乙酸浓度分别为(22.48±1.6)、(24.29±1.6)和(30.13±2.01)mmol/L均显著高于Blank组[(8.98±2.4)mmol/L]。此外,Cys/Cur组产生的乙酸显著高于FOS和Cys组(P<0.05)。丙酸具有抑制胆固醇的合成、减少脂肪贮存、抗癌和抗炎症的特性[25]。由图4-C所示,FOS、Cys和Cys/Cur组在粪便发酵24 h后所产生的丙酸浓度分别为(5.21±1.2)、(4.16±1.5)、(6.74±1.3)mmol/L,均显著高于Blank组[(3.47±0.8)mmol/L],并且Cys/Cur组产生的丙酸显著高于FOS和Cys组(P<0.05)。而丁酸可以保持结肠细胞稳定,预防或抑制癌症的发生[23]。由图4-D可知,在发酵24 h后,Cys和Cys/Cur组产生的丁酸浓度分别为(1.01±0.2) mmol/L和(1.44±0.2) mmol/L,低于FOS组[(1.77±0.5) mmol/L]。乳酸对免疫系统也有好处,它可以作为促炎细胞因子和抗炎细胞因子产生的调节因子。Cys/Cur组产生的乳酸质量浓度为(1.61±0.03)mg/mL(图4-F)。以上研究结果表明Blank组相比,FOS、Cys和Cys/Cur组能够增加SCFAs的产生。同时,Cys和Cys/Cur对肠道菌群产SCFAs的产量和比例不同,因为Cys和Cys/Cur在结构上存在差异,所以它们在肠道菌群中有不同的酵解途径,进而对肠道菌群的主要代谢产物产生不同的影响。
2.3.2 不同碳源对健康人肠道微生物菌群的影响
基于细菌丰富度(Chao1指数)和多样性(Shannon和Simpson指数)比较,与Cys组相比,Cys/Cur组的Chao1指数略有下降,但差异不显著(P>0.05),但是Simpson和Shannon指数均高于Cys组(图5-A)。因此,与Cys组相比,Cys/Cur组可显著增加肠道微生物的多样性,这可能与多酚的释放和代谢密切相关[26]。基于加权的UniFrac距离进行了主坐标分析(principal co-ordinates analysis,PCoA)(图5-B),各组的菌群结构各成一簇,有明显差异。结果表明肠道微生物菌群对不同碳源的响应机制不同。但是肠道微生物在代谢中的作用是复杂的,为了进一步研究Cys/Cur释放的结合多酚对微生物组成的可能影响,必须在门和属水平上进行研究。
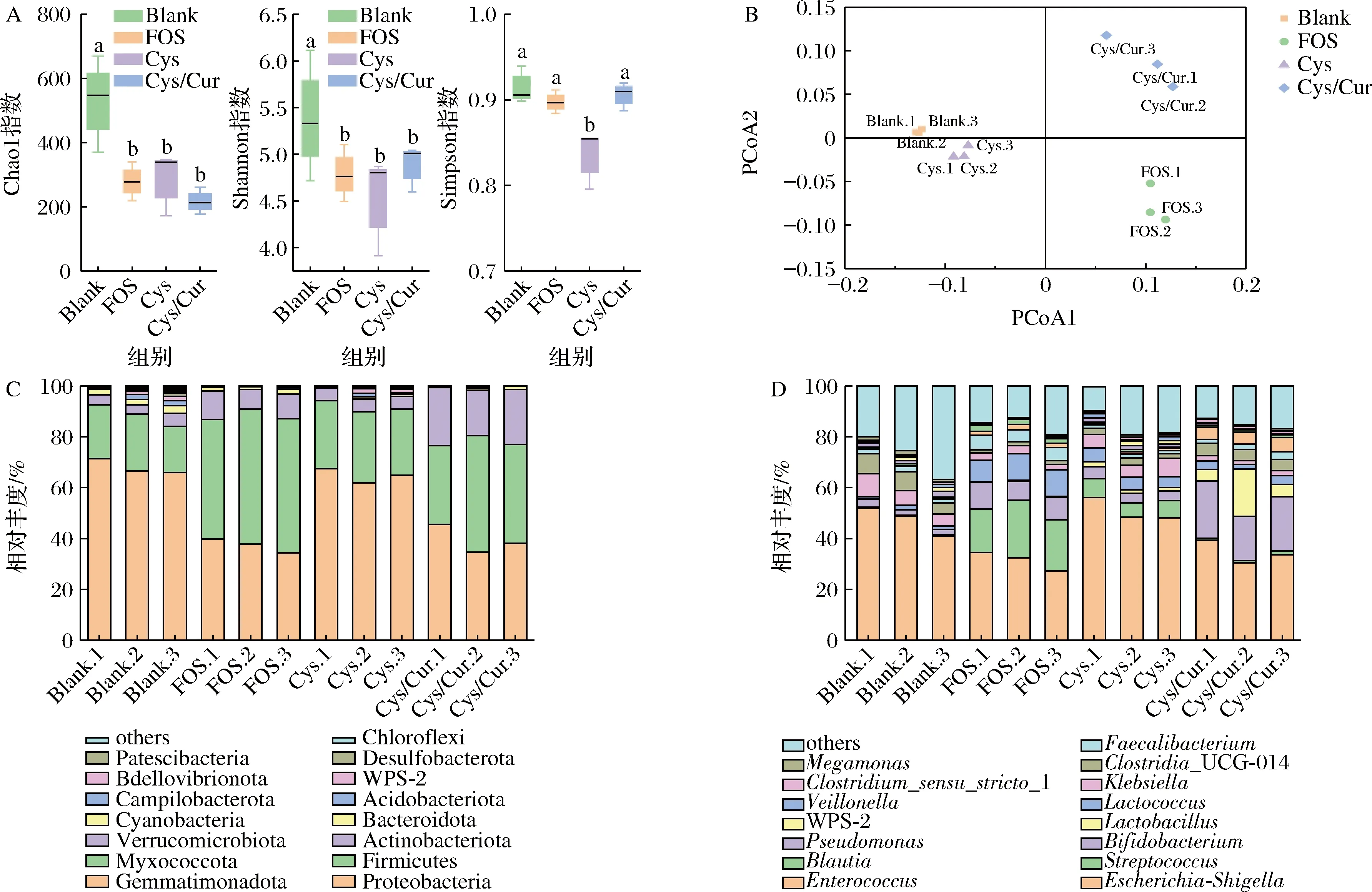
A-肠道菌群α多样性;B-PCoA;C-门水平;D-属水平图5 不同碳源对健康人肠道菌群组成的影响Fig.5 Effects of different carbon sources on gut microbiota composition of healthy human
在门水平上,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)在各组中均占90%以上(图5-C)。由于这些结果与人体肠道菌群的组成和结构一致,体外粪便发酵试验可以很好地模拟人体肠道菌群[9]。与Cys组相比,Cys/Cur组放线菌门和厚壁菌门的相对丰度增加,变形菌门的相对丰度显著降低(P<0.05)。放线菌门则以双歧杆菌为代表;厚壁菌门的大多数成员都是有益菌,如乳酸杆菌;变形菌门中多数细菌对人体具有致病性,如大肠杆菌、沙门氏菌等。发酵24 h后,FOS、Cys和Cys/Cur组中拟杆菌门的相对丰度低于Blank组,这可能与发酵pH值较低有关。先前的研究结果表明[7],酸性条件可以抑制酸敏感拟杆菌的生长,导致发酵24 h后拟杆菌门丰度降低。在属的水平上(图5-D),发酵24 h后,与FOS和Cys组相比,Cys/Cur组的双歧杆菌属和乳杆菌属等益生菌属显著增加(P<0.05),显著抑制了乳球菌属、链球菌属和克雷伯杆菌属等条件致病菌的生长(P<0.05)。此外,与Blank组相比,Cys组双歧杆菌属和乳杆菌属增殖,克雷伯杆菌属减少。综上所述,Cys对Cur的包封具有互惠互利的作用,Cys不仅可以作为合适的包埋载体,还可以作为益生元影响肠道菌群的丰度和组成。Cys/Cur组中包合的Cur也可以影响肠道微生物群的丰度和组成,同时也对肠道屏障功能有积极影响[9]。
通过线性判别分析,以确定各组肠道菌群中具有统计学意义的生物标志物。基于线性判别分析(linear discriminant analysis,LDA)评分大于4分,得到的直方图和分支图如图6所示。总体水平分析显示,Cys/Cur与Blank组间有18个分类操作单元(operational taxonomic units, OTUs)显著差异,Cys/Cur与FOS组间有22个OTUs显著差异,Cys/Cur与Cys组间共有15个OTUs显著差异(图6-A)。结果表明,在Cys组中,富集了多种致病菌,如大肠杆菌志贺菌。但是在Cys/Cur组显著富集很多益生菌,如双歧杆菌属、乳杆菌属。双歧杆菌属负责将Cys/Cur中的Cur生物转化为具有生物活性的酚类代谢产物[9],同时Cur及其位于肠道的生物活性代谢产物影响肠道微生物群的丰度和组成。因此,从致病肠道菌群到有益肠道菌群的改变可能有助于改善肠道健康和相关疾病。综上所述,Cys/Cur调控改变了肠道菌群组成,促进了有益菌群的增殖和抑制了有害菌的生长,具有一定的益生功能。
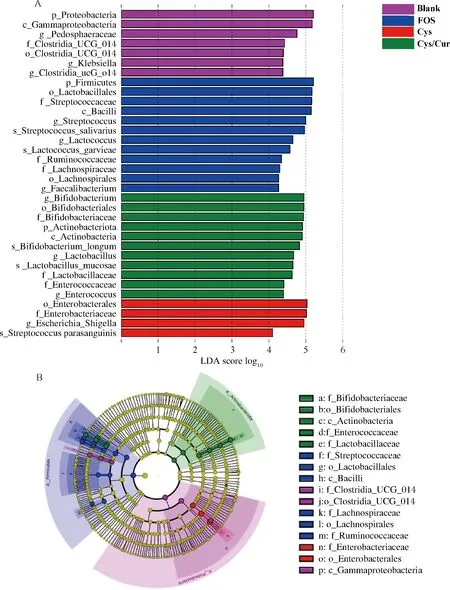
A-不同碳源组的线性判别分析得分分布直方图; B-不同碳源组的线性判别分析得分分布分支图图6 不同碳源粪便体外发酵24 h微生物群落的线性判别分析Fig.6 The LEfSe analysis of gut microbiota communities after in vitro 24 h fecal fermentation with different carbon sources
3 结论
本研究通过体外模拟消化实验表明Cys对模拟唾液、胃液和小肠液具有抗消化性,可以顺利到达结肠。在模拟胃肠道消化的过程中,Cys/Cur包合物中的Cur逐渐释放,最终释放率达到(88±1.8)%。在消化的基础上研究Blank、FOS、Cys和Cys/Cur组与特定肠道益生菌株的增殖效果及乙酸和乳酸浓度进行分析,结果表明,不同底物对模式益生菌表现为不同程度的益生元效应,其中以Cys/Cur组益生效果最好。其次通过健康人粪便的体外发酵进一步验证了不同碳源的益生特性,与Cys和FOS组相比,Cys/Cur在24 h显著增强了乙酸、丙酸和乳酸的产量,其浓度分别达到(30.13±2.01)、(6.74±1.3)mmol/L和(1.61±0.03) mg/mL。与Cys和FOS组相比,Cys/Cur组的双歧杆菌属和乳杆菌属等有益菌增殖,乳球菌、链球菌属和克雷伯杆菌属等潜在致病菌的相对丰度显著减少。与Blank组相比,Cys组的乙酸浓度显著提高,达到(24.29±1.6) mmol/L,Cys组的双歧杆菌属和乳杆菌属等关键细菌种类丰度增加,克雷伯杆菌属等致病菌的相对丰度显著减少。综上,Cys/Cur调控改变了肠道菌群组成,促进了有益菌群的增殖和抑制了有害菌的生长,具有双重的益生功能。但离真正推广到食品领域中还有很长距离,接下来应从细胞实验和体内动物实验入手,为Cys/Cur在食品中应用提供更加充分数据和理论支持。

