榄香烯口服乳联合甲磺酸阿帕替尼治疗晚期胃癌的临床观察*
赵美琴,苏新华,杨 杰,范 晖*
(南通大学附属如皋医院,江苏省如皋市人民医院肿瘤内科,如皋 226500)
胃癌是我国乃至全世界最常见的消化道恶性肿瘤之一,2019 年国家癌症中心数据显示:2015 年中国胃癌的粗发病率和死亡率分别为29.31%和21.16%,两者在所有恶性肿瘤中分别居第2 位和第3 位[1]。由于早期胃癌缺乏特异性的症状及体征,近60%患者就诊时已是晚期,失去了根治性手术机会,通常采用放化疗为主的综合治疗[2]。此类患者治疗困难,预后差,5 年生存率<5%,中位生存期仅6~9 个月[3]。目前对于二线治疗失败的晚期胃癌的三线治疗尚无标准方案[4],因此有必要探索高效低毒的三线治疗方案。目前研究[5-6]证实,小分子抗血管生成靶向药甲磺酸阿帕替尼对于二线治疗失败的晚期胃癌患者疗效较好,主要聚焦于甲磺酸阿帕替尼与化疗方案的联合治疗,但由于晚期胃癌患者多体质较差,化疗药物在治疗肿瘤的同时会引起一系列的不良反应,影响患者的生存质量。同时,研究[7]表明榄香烯口服乳具有直接的抗肿瘤作用,能诱导人胃癌细胞凋亡。因此,本研究旨在探讨榄香烯口服乳联合甲磺酸阿帕替尼在晚期胃癌患者中的疗效及安全性。
1 资料与方法
1.1 一般资料 (1)纳入标准:①经胃镜活检病理检查确诊为胃癌,经分期诊断为不可手术的晚期胃癌(Ⅳ期);②经历过一线、二线治疗,且至少有1 个可测量的病灶;③预期生存时间>3 个月;④年龄18~75 岁;⑤美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分0~2 分;⑥骨髓功能:WBC 总数≥4.0×109/L,中性粒细胞≥2.0×109/L,PLT≥100×109/L,血红蛋白≥90 g/L;⑦肝、肾功能:总胆红素、ALT、AST 均≤2.5 倍正常值上限,若由肝转移所致肝功能异常,上述指标≤5 倍正常值上限,血清肌酐≤1.5倍正常值上限;⑧育龄妇女须在入组前1 周内行妊娠试验(血清或尿液),且结果为阴性,并愿意在试验期间采用恰当的方法避孕。(2)排除标准:①合并活动性结核或其他严重的感染性疾病;②合并影响患者自诉能力的脑转移、严重脑疾病或精神疾病;③高热;④有活动性出血、溃疡;⑤有未能控制的高血压。选取南通大学附属如皋医院2020 年1 月—2021 年6 月收治的符合上述标准的50 例患者按随机数字表法分为两组,各25 例。
1.2 治疗方法 (1)对照组:甲磺酸阿帕替尼(250 mg/粒,江苏恒瑞医药股份有限公司)口服,500 mg/d,4 周为1 个疗程,并予最佳支持治疗。(2)观察组:榄香烯口服乳(20 mL:176 mg/支,大连华立金港药业有限公司)饭前空腹小口吞服,20 mL/次,tid,6 周为1 个疗程,停用2 周后重复下1 个疗程;甲磺酸阿帕替尼500 mg/d 口服,并予最佳支持治疗。
1.3 观察指标
1.3.1 疗效评价 采用实体瘤的疗效评价标准(RE CIST 1.1)进行评价。完全缓解(complete remission,CR):所有靶病灶消失;部分缓解(partial response,PR):与基线相比,靶病灶长径之和缩小≥30%;疾病稳定(stable disease,SD):靶病灶长径之和缩小未达PR 或者增大未达疾病进展(progression disease,PD);PD:靶病灶长径之和增大≥20%或出现新病灶。客观缓解率(overall response rate,ORR)=(CR+PR)/总例数×100%;疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。
1.3.2 无进展生存时间(progression-free-survival,PFS)自患者开始以上治疗方案至患者第1 次发生肿瘤进展或死亡的时间,截至2021 年8 月30 日肿瘤尚未进展者,以最后1 次随访日期作为截止数据。
1.3.3 生存质量(quality of life,QOL)改善情况 采用卡氏功能状态评分标准(Karnofsky performance status,KPS)对每组患者在治疗前后进行评分。提高:治疗后比治疗前KPS 评分提高10 分及以上;稳定:介于提高和下降之间,治疗前后KPS 评分变化不显著;下降:治疗后比治疗前KPS 评分降低10 分及以上。
1.3.4 不良反应 采用药物毒性反应分级标准(NCI-CTCAE 5.0)进行评估,可分为1~5 级,包括高血压、蛋白尿、皮肤反应、WBC 减少、乏力、出血等。
1.4 统计学方法 使用SPSS 22.0 统计软件进行数据分析,计量资料以±s 表示,采用t 检验;计数资料以率表示,采用χ2检验;等级资料采用非参数检验;生存分析采用Kaplan-Meier 法,P<0.05 为差异有统计学意义。
2 结果
2.1 治疗效果 观察组ORR、DCR 均优于对照组,但差异均无统计学意义(χ2=0.15、1.30,P=0.700、0.254)(表1)。

表1 两组患者治疗效果比较n(%)
2.2 PFS 观察组中位PFS 为(3.25±0.74)个月,高于对照组的(2.80±0.63)个月(t=2.28,P<0.05)(图1)。

图1 两组PFS 比较
2.3 QOL 改善情况 治疗后,两组KPS 评分均明显提高(均P<0.05),观察组QOL 较对照组改善显著(P<0.05)(表2)。
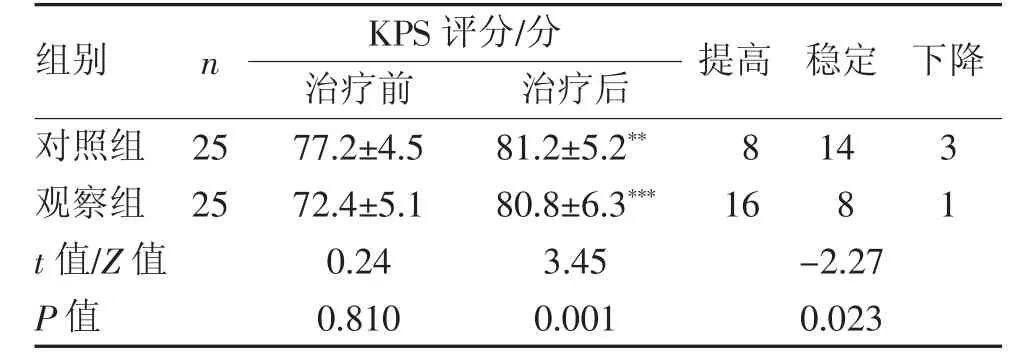
表2 两组患者治疗前后QOL 改善情况比较
2.4 不良反应 两组患者均未出现严重不良反应(4级)。两组患者高血压、蛋白尿、皮肤反应、白细胞减少、乏力等不良反应比较差异均无统计学意义(均P<0.05)(表3)。

表3 两组患者不良反应发生情况比较
3 讨论
胃癌早期症状不明显,初诊时大多已达晚期,失去了外科手术机会,目前临床上对晚期胃癌的治疗也相对单一,主要是以化疗为主的综合治疗[8]。尽管部分一、二线化疗方案临床疗效确切,但仍存在耐药、个体基因差异等因素,许多患者治疗后病情依旧进展[9],且由于化疗药物产生的不良反应,很多患者治疗后反而出现各种生理不适、生存质量下降。因此,三线治疗选择高效低毒的方案就显得尤为重要。随着现代分子生物学、基因组学的进展,一些分子靶向药逐步用于临床治疗[10]。目前关于胃癌的靶向治疗主要聚焦于人类表皮生长因子受体2(human epidermal growth factor receptor-2,Her-2)和血管内皮生长因子(vascular endothelial growth factor,VEGF)/血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)这两条信号通路,前者代表药物曲妥珠单抗,对于晚期Her-2 阳性胃癌的治疗有效率不足20%[9],临床疗效不太理想。但近来大量研究[11]证实,小分子VEGFR 抑制药物甲磺酸阿帕替尼对于二线治疗失败后晚期胃癌的疗效较为显著。甲磺酸阿帕替尼通过高选择性结合VEGF,从而竞争性抑制Her-2 配体,抑制肿瘤新生血管的生长,最终有效抑制肿瘤的生长[12]。此外,研究[13-14]表明,甲磺酸阿帕替尼在人体内生物利用度高,安全性好,患者能耐受。
随着现代抗肿瘤研究的进展,很多从天然植物中被提取的有效抗肿瘤物质越来越多地被应用于临床。榄香烯是从姜黄科植物温郁金(莪术)中提取分离的倍半萜烯类化合物,主要成分为β-榄香烯,具有抗瘤谱较广、疗效确切、不良反应轻微等优点。其可以通过多靶点,多通道来抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡[7,15]。且β-榄香烯可直接作用于细胞膜,破坏肿瘤细胞,诱发和促进机体对肿瘤细胞的免疫反应,提高机体免疫功能,延长患者的生存时间,改善生活质量[16]。榄香烯口服乳作为口服抗肿瘤药物,其对口腔黏膜无刺激,不影响患者的味觉,胃肠道反应小,且无明显肝肾功能损害[17]。
本研究结果显示,观察组PFS 和QOL 改善均优于对照组,且两组不良反应差异无统计学意义,可见榄香烯口服乳与甲磺酸阿帕替尼联合用药在不增加患者不良反应的基础上能提高患者的ORR、DCR,显著延长其PFS。本研究患者均未出血,但甲磺酸阿帕替尼作为抗肿瘤血管生成靶向药,高血压是其最常见的不良反应,同时榄香烯具有一定程度的抗凝活血、抑制血小板聚集作用,两者联用会增加出血风险,因此在临床实际应用中需严格把握用药禁忌,治疗过程中密切监测患者血压、血小板计数及凝血功能,确保用药安全。
综上所述,榄香烯口服乳联合甲磺酸阿帕替尼三线治疗晚期胃癌,能够提高患者的PFS,改善患者的生存质量且安全性良好,值得临床推广。

