微刺激IVF/ICSI 周期中BMI 与优质胚胎形成的关系*
顾小铃,陈艳男,王青欣,仲舒平,王 霞*
(南通大学附属医院生殖医学中心,南通 226001)
由于年龄、遗传、环境和压力等因素的影响,卵巢储备功能下降(diminished ovarian reserve,DOR)的人群呈年轻化趋势[1]。有生育需求的妇女因DOR 导致不孕不育的形势愈发严峻,引起社会的广泛关注[2]。辅助生殖助孕是帮助DOR 患者实现怀孕的重要手段。研究[3-4]显示移植低质量的胚胎导致患者的临床妊娠率和活产率降低、流产率增加。因此,除了“临床妊娠”这个评判辅助生殖技术(assisted reproductive technology,ART)成功与否的金标准以外,“胚胎质量”也是ART 结局的重要替代性指标[5]。多项研究[6-8]表明肥胖与超促排卵周期的不良结局有关。上调的BMI 与不孕患者卵母细胞数量和质量呈负相关[9-10]。然而,鲜有关于BMI 与DOR 患者优质胚胎形成关系的研究。因此,本研究旨在探讨BMI 与DOR 患者微刺激体外受精/卵胞浆内单精子注射(in vitro fertilization/intracytoplasmic sperm injection,IVF/ICSI)周期中优质胚胎形成的关系。
1 资料与方法
1.1 一般资料 回顾性分析南通大学附属医院生殖医学中心2019 年1 月—2021 年7 月接受IVF/ICSI 的不孕不育夫妇的病历资料。纳入标准:(1)DOR患者:双侧卵巢的窦卵泡数(antral follicle count,AFC)<7 枚和抗苗勒管激素(anti-Müllerian hormone,AMH)<1.1 ng/mL[11]。(2)第一次采用微刺激方案进行促排卵治疗。排除标准:(1)使用供卵/供精的周期;(2)未获卵的周期;(3)内分泌异常的患者,如甲状腺疾病、糖尿病等;(4)未控制的高血压、心脏病等合并其他脏器严重疾病者。根据上述标准共筛选出首次采用微刺激方案促排的DOR 患者88 个周期入组本研究,其中女方平均年龄(33.85±5.86)岁,男方平均年龄(34.61±7.03)岁;不孕年限2.54(1.00~3.88)年;原发不孕42例,继发不孕46 例;平均BMI 为(22.10±2.97)kg/m2,平均基础卵泡刺激素(basal follicle stimulating hormone,bFSH)为(12.09±4.53)mIU/mL,平均基础黄体生成素(basal luteinizing hormone,bLH)为(3.93±1.82)mIU/mL,平均基础雌二醇(basal estradiol,bE2)为44.94(30.70~59.56)pg/mL,平均AFC 为(4.20±1.93)枚,平均AMH 为0.80(0.48~1.23)ng/mL。本研究通过南通大学附属医院伦理委员会的审查(伦理号:2020-L031)。
1.2 研究方法
1.2.1 控制性超促排卵(controlled ovarian hyperstimulation,COH)[12]微刺激方案:月经周期第3 天起口服克罗米芬(clomiphene citrate,CC)(法地兰,高特制药有限公司)50 mg/d,同时予促性腺激素(gon-adotropin,Gn)[肌肉注射人绝经期促性腺激素(human menopausal gonadotropin,HMG)(乐宝得,珠海丽珠制药)或皮下注射重组人卵泡刺激素(recombinant human follicle stimulating hormone,rFSH)(默克雪兰诺,德国)]150~225 U 直至肌肉注射人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)当日。Gn 的初始剂量150~225 U 是根据患者的年龄、bFSH 和AFC 确定的。定期进行超声检查和血清激素水平检测,根据卵泡的发育情况调整Gn 剂量和使用天数。当≥2 个优势卵泡直径≥18 mm 时,给予艾泽(默克雪兰诺,德国)250 μg 或HCG 10 000 U 扳机。记录患者的临床用药情况(Gn 天数、Gn 剂量)和HCG 日≥16/14 mm卵泡数及E2。
1.2.2 卵母细胞提取、胚胎培养、分级和冷冻 注射HCG 36~38 h 后,在阴道超声的引导下取卵,取卵后3~4 h 根据男方精液参数,选择进行IVF/ICSI。授精后16~18 h 观察原核,出现双原核表明正常受精。分别于受精后43~45 h 和67~69 h 观察卵裂期胚胎的发育情况。根据卵裂球数目和大小、卵裂速度、胞质碎片量等将卵裂期胚胎分为1~4 级,其中1~2 级为优质卵裂期胚胎[13]。受精后第5、6 天采用Gardner 评分系统[14]评估囊胚质量,将内细胞团多且结合紧密,滋养细胞数量多且形成紧密排列的上皮细胞层的囊胚评为优质囊胚。胚胎培养采用的是商业化的序贯培养液[15],因采用微刺激方案促排的DOR 患者内膜与卵巢不同步,故将周期内的优质胚胎进行玻璃化冷冻保存[16]。记录患者周期结局(有无优质胚胎)。
1.2.3 分析方法 分析以下因素与DOR 患者微刺激IVF/ICSI 周期中优质胚胎形成的关系:夫妇双方的年龄、不孕的年限、不孕的类型、女方BMI、bFSH、bLH、bE2、AFC、AMH、男方精液参数、Gn 天数、Gn 剂量、HCG 日≥16/14 mm 卵泡数和HCG 日E2。
1.3 统计学方法 采用IBM SPSS 19.0 软件分析,将正态分布的计量资料以±s 表示,非正态分布的计量资料采用P50(P25,P75)表示,计数资料以%表示。采用独立样本t 检验、Mann-Whiteny U 检验、χ2检验或Fisher 精确检验比较有优胚组和无优胚组基线资料有无差异,多因素Logistic 回归分析基线资料与胚胎发育结局的关系。构建ROC 曲线,寻找预测DOR患者微刺激IVF/ICSI 周期中优质胚胎形成的相关指标的界值。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者基线资料和临床用药的比较 根据有无优质胚胎将88 例DOR 患者分为两组:有优胚组44 个周期(50%),无优胚组44 个周期(50%);与无优胚组[(22.89±3.12)kg/m2]相比,有优胚组BMI[(21.32±2.61)kg/m2]更小(P<0.05)。两组间夫妇双方的年龄、不孕年限、不孕类型、bFSH、bLH、bE2、AFC、AMH、男方精液参数、Gn 天数、Gn 剂量、HCG 日≥16 mm 卵泡数、HCG 日≥14 mm 卵泡数和HCG 日E2比较差异均无统计学意义(均P>0.05),见表1。

表1 两组基线资料和临床用药的比较[P50(P25,P75),n(%)]
2.2 微刺激IVF/ICSI 周期中优质胚胎形成的预测模型建立 影响DOR 患者超促排卵后优质胚胎形成的多因素Logistic 回归分析结果显示,BMI 是优质胚胎形成的独立影响因素(B=-0.202,OR=0.817,95%CI: 0.693~0.964,P=0.017)。BMI 预测DOR 患者超促排卵后优质胚胎形成的ROC 曲线显示,AUC 为0.679(95%CI: 0.565~0.794),BMI 预测DOR 患者微刺激IVF/ICSI 周期中优质胚胎形成的界值为21.45 kg/m2,灵敏度为61.4%,特异度为79.5%。
2.3 两组患者实验室指标和临床结局的比较 有优胚组获卵数、成熟卵子数、正常受精卵子数、优胚数、可利用胚胎数和累计活产率均高于无优胚组(均P<0.05),见表2。
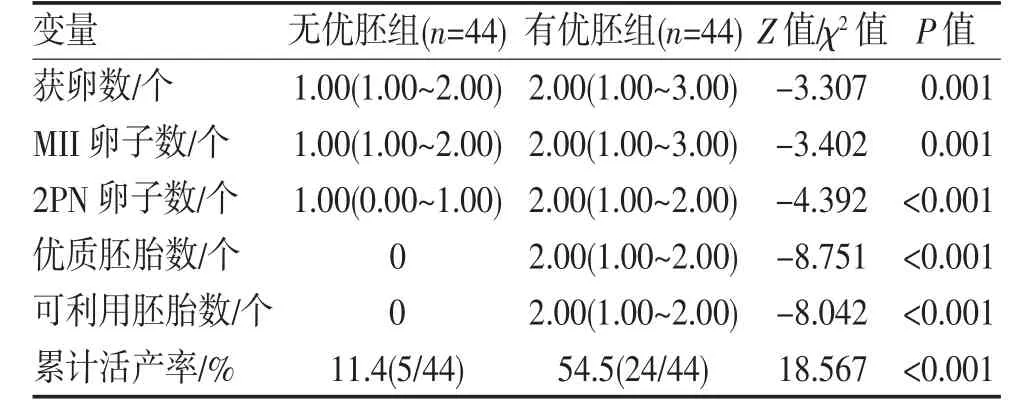
表2 两组患者实验室指标和临床结P50(P25,P75)
3 讨论
卵巢储备指双侧卵巢中窦卵泡的数量,间接反映女性的生殖潜能。DOR 指双侧卵巢中窦卵泡的数量和质量的降低,影响卵泡发育成为高质量的卵母细胞,是导致不孕的主要原因[17]。DOR 患者常对促排卵治疗的反应差,卵子获得量少,胚胎质量差[18],且易发展为卵巢早衰[19]。DOR 患者生殖条件差,但期望怀孕,这就加重了她们的生理和心理负担。临床医师应重视DOR 患者的超促排卵治疗及其预后。
研究[20-22]显示,女性BMI 对IVF 结局有影响,肥胖患者周期取消的风险明显增高。高BMI 与DOR患者卵母细胞回收呈负相关。在不孕女性中,肥胖女性可利用胚胎数较正常体质量女性少[23]。在本研究中,有优胚组BMI 明显低于无优胚组,提示BMI 是影响DOR 患者胚胎发育的重要因素。其机制可能是肥胖女性体内的游离脂肪酸增高,脂肪酸的增高致使线粒体和内质网发生应激,产生大量活性氧(reactive oxygen species,ROS),ROS 增多破坏非脂肪细胞[24]。高游离脂肪酸通过改变卵泡液的环境影响卵母细胞的生长和发育能力[25]。动物实验[26]证实肥胖可导致卵母细胞细胞器损伤。研究[27]表明肥胖女性的血清中瘦素浓度增高,进而导致卵泡液中瘦素呈高浓度状态,直接影响胚胎发育。
既往研究[28-29]显示肥胖女性体质量下降5%~10%能改善月经周期、恢复排卵和提高自然妊娠率,高BMI 与卵母细胞质量或胚胎发育呈负相关。本研究结果与上述研究相似,多因素Logistic 回归分析显示BMI 是DOR 患者微刺激IVF/ICSI 周期中优质胚胎形成的独立影响因子(B=-0.202,OR=0.817,95%CI: 0.693~0.964,P=0.017)。根据约登指数BMI 界值为21.45 kg/m2时,其预测DOR 患者优质胚胎形成的效能最好(灵敏度为61.4%,特异度为79.5%)。因此,在进周期前控制DOR 患者体质量对于改善胚胎质量有重要价值。
本研究中9 例患者BMI>21.45 kg/m2,但超促排卵后有优质胚胎。通过分析发现其原因可能为:该9例患者年龄均<35 岁,AMH 和AFC 处于界值的高值。相关研究[30]证实,年轻的DOR 患者卵巢对Gn 的反应降低,导致获得卵子的数量和胚胎总数减少,但对卵子和胚胎的质量几乎没有影响。因此,年轻DOR 患者一旦获得卵子,这些卵子形成可移植胚胎和高质量胚胎的潜能高于高龄DOR 患者。本研究中11 例患者BMI≤21.45 kg/m2,但超促排卵后无优质胚胎。分析其原因可能为:这些患者年龄偏大,平均为(37.35±2.11)岁,且AMH 和AFC 偏低。因此在评估DOR 患者微刺激IVF/ICSI 胚胎发育结局时,除了考虑BMI 的重要作用外,还应结合患者年龄、AMH 和AFC 等相关指标。
本研究不足之处:(1)病例数较少,需要后期进一步扩大样本量;(2)本研究属于单中心回顾性研究,存在一定的入选偏移。
总而言之,BMI 是DOR 患者微刺激IVF/ICSI 周期中优质胚胎形成的独立影响因素。控制BMI 对于提高DOR 患者微刺激IVF/ICSI 周期中胚胎质量有正向作用。

