瘦素、尿酸与2 型糖尿病合并肥胖的关系
牛 玲,李博一,苗翠娟,张 程,唐 艳,刘 方,马 蓉
(昆明市第一人民医院内分泌科,云南 昆明 650011)
2 型糖尿病(type 2 diabetes mellitus,T2DM)和肥胖是威胁人民健康的常见慢性营养代谢性疾病,是全球性重大的公共卫生问题。且两者关系密切,可能有共同的发病因素并通过一些脂肪细胞因子互相影响。瘦素(leptin,LEP)能通过内分泌、旁分泌等途径对胰岛素在靶组织的生物效应进行调节[1]。动物实验表明,过量摄食后肥胖的动物,体内瘦素水平升高,存在瘦素抵抗[2]。但瘦素对肥胖的2 型糖尿病患者有无影响尚不清楚,本研究拟探讨2 型糖尿病合并肥胖患者瘦素水平,并分析肥胖与血脂、血糖、尿酸等代谢性指标的关系。
1 资料与方法
1.1 研究对象
选取2023 年3 月至2023 年7 月在昆明市第一人民医院内分泌科住院的初诊2 型糖尿病患者111 例,其中男性63 例,女性48 例,依据2020年版《中国2 型糖尿病防治指南》[3]标准诊断糖尿病及肥胖,并排外糖尿病急性并发症,病理性肥胖,其他内分泌疾病者,严重肝肾功能不全,肿瘤、感染者。所有研究对象均签知情同意书,并经昆明市第一人民医院伦理委员会批准(YLS2022-56)。
1.2 分组
按体重指数(body mass index,BMI)将受试者分组为T2DM 正常体重组(18.5<BMI ≤ 24 kg/m2)69 例,T2DM 合并肥胖组(BMI ≥ 28 kg/m2)42 例。
1.3 观察指标
1.3.1 病史采集及查体记录受试者的一般资料,包括吸烟史、饮酒史,测量右上臂收缩压(SBP)/舒张压(DBP),根据体重(W),身高(H)计算体重指数(BMI)。
1.3.2 生化指标次晨取静脉血测空腹血糖(FPG)、糖化血红蛋白(HbA1c)、肝肾功能、电解质、甲功、血脂指标(TC、TG、HDLC、LDLC)、尿酸(UA)、25-羟基维生素D 水平。住院期间按标准方法行OGTT 试验,检测空腹血糖(FPG)、OGTT-2h 血糖,化学发光法检测空腹胰岛素(FINS)、2 h 胰岛素(INS)水平(单位:mIU/L)。采用HOMA-IR 即稳态模型评估胰岛素抵抗HOMAIR=FPG X FINS/22.5)。
1.3.3 脂联素、瘦素测定取静脉血4~5 mL,-80 ℃保存待检。购进试剂盒(Solarbio 公司),采用ELISA 按试剂盒说明书检测LEP。
1.4 统计学处理
本研究数据经SPSS27.0 统计软件包处理。正态计量资料使用均数±标准差()表示。采用t检验进行两独立样本比较。非正态计量资料使用M(P25,P75)表示,采用秩和检验。计数资料采用率表示法,进行χ2检验。采用Logistic回归分析筛选2 型糖尿病合并肥胖的独立危险因素。P<0.05 为差异具有统计学意义。
2 结果
2.1 一般资料比较
饮酒情况、OGTT-2h、HBA1c、UA 相比,差异有统计学意义(P<0.05),而LEP、性别、吸烟情 况、年 龄、SBP、DBP、TC、TG、HDLC、LDLC、FPG、FINS、INS-2h、HOMR-IR 差异均无统计学意义(P> 0.05 ),见表1。
表1 研究对象的一般资料比较 [/M(P25,P75)]Tab.1 Comparison of general data of study [/M(P25,P75)]
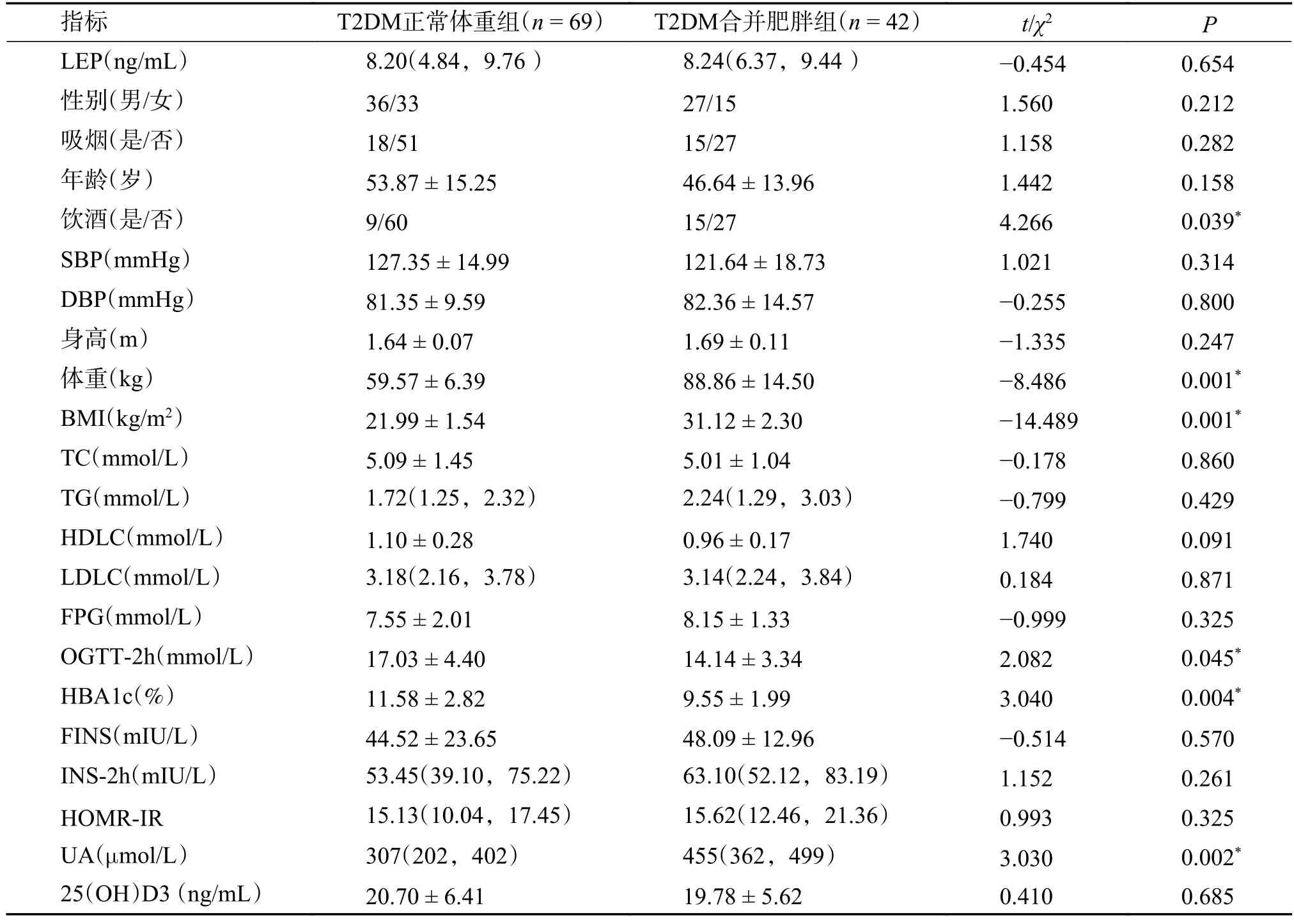
表1 研究对象的一般资料比较 [/M(P25,P75)]Tab.1 Comparison of general data of study [/M(P25,P75)]
*P<0.05 。
2.2 Logistic 回归分析
将LEP 及单因素分析组间差异具有统计学意义的变量,即饮酒情况(1 为无,2 为有)、OGTT-2h、HBA1c、UA 作为因变量,2 型糖尿病有无肥胖作为自变量(1 为无,2 为有),进行二元Logistic回归分析,以筛选2 型糖尿病合并肥胖的独立危险因素。结果显示:OGTT-2h、HBA1c、UA 可进入方程(P<0.05),LEP、饮酒情况未进入方程,见表2。

表2 Logistic 回归分析Tab.2 Logistic analysis
3 讨论
2 型糖尿病是内分泌科住院患者的常见疾病,其持续的高血糖可致糖尿病微血管病变(包括糖尿病肾病、糖尿病视网膜病变),糖尿病神经病变及心脑血管病等一系列并发症的发生发展。目前,我国糖尿病患病率从1980 年的0.67%飙升至2017 年的11.2%[3]。2021 年IDF 糖尿病地图显示[4],我国糖尿病患者人数为1.298 亿,居世界之首,流行趋势不容乐观。
肥胖是营养失调的一种表现,中国2015 年的调查数据显示:18 岁及以上人群超重占比高达30.1%,而肥胖比率11.9%[5]。且肥胖和T2DM 关系密切,超重及肥胖患者糖尿病的发病率更高。中国2015 年至2017 年的调查显示:体重指数在 ≥25 kg/m2,又<30 kg/m2的人群中,糖尿病发病率已达13.8%。若体重指数 ≥ 0 kg/m2,则糖尿病发病率可增加到20.1%[6-7]。另外,在糖尿病患者中,超重人群高达41%、肥胖则为24.3%[8]。
糖尿病和肥胖可能通过一些脂肪细胞因子互相影响。目前认为,瘦素抵抗也称为高瘦素血症可能是肥胖发病机制之一。
对于LEP 与2 型糖尿病、肥胖的关系,国内外已有不少报道,但还是有不同结论。Reilly 等[9]发现T2DM 患者血清瘦素水平与BMI、WHR 等相关。血清瘦素水平增高,胰岛素抵抗也将随之增加[10-12]。李宝新[13]报道,随着BMI 的增加,糖尿病患者LEP 渐增高,其中,在糖尿病肥胖组LEP 水平最高(6.33±0.69)ng/mL;进一步回归分析表明:腰臀比、体重指数、低密度脂蛋白、空腹胰岛素水平、HOMA-IR 均是血清瘦素的独立影响因素。但也有报道[14-16]认为:瘦素并不影响糖尿病的发生发展。周亚茹将2 型糖尿病患者按BMI-25 分组为非肥胖组和肥胖组,同样发现瘦素浓度差异无统计学意义。
目前,云南地区尚未见LEP 与2 型糖尿病合并肥胖关系的报道。笔者将111 例初诊尚未接受治疗的2 型糖尿病患者按BMI-28 分组为正常体重组和肥胖组,结果发现:非肥胖的2 型糖尿病患者LEP 水平已明显升高,为8.20(4.84,9.76 )ng/mL,高于李宝新等[13]报道的LEP 水平(6.33 ±0.69)ng/mL。肥胖组LEP 水平较正常体重组有增加,但差异无统计学意义(P> 0.05 )。与国外Wauters M[10],Fischer S[17],国内周亚茹等[18]的报道一致。进一步Logistic回归分析显示:LEP 未进入方程。各研究结论不一致的原因可能为:(1)研究入组人群要求不一致;(2)采用的肥胖诊断标准不一致;(3)样本量少。下一步笔者将扩大样本量,并采用不同BMI 诊断切点进行比较,希望能够为2 型糖尿病的体重管理提供新思路及依据。
高尿酸血症(hyperuricemia,HUA)是一类嘌呤代谢性疾病。HUA 患病率也呈逐年上升趋势.特别是在经济发达的城市和沿海地区,HUA 患病率达5%~23.5%[19-21],接近西方发达国家水平[22]。HUA 是代谢性疾病(糖尿病、代谢综合征、高脂血症等)、慢性肾病、心血管疾病、脑卒中的独立危险因素。
2 型糖尿病患者往往同时合并肥胖、高尿酸血症、高血压、高血脂等代谢紊乱。国外有报道,尿酸升高与胰岛素抵抗显着相关,可作为2 型糖尿病患者胰岛素抵抗的指标[23]。最近,1 项印度横断面研究[24]在对402 名新发糖尿病患者(男性284 名,女性 118 名)按BMI 分组(< 18.5 kg/m2为体重过轻、18.5~23 kg/m2为体重正常、>23~27.5 kg/m2为超重、> 27.5 kg/m2为肥胖)研究发现:血清尿酸水平与全身性肥胖独立相关(P<0.001)。国内吴敏[25]、朱丽芹[26]的研究也得出相同结论。
目前,云南地区尚未见SUA 与2 型糖尿病合并肥胖的相关性报道。本研究还发现,肥胖组SUA 水平更高,进一步Logistic回归分析显示:尿酸可进入方程(OR值1.015,95%CI:1.002~1.029,P=0.020),提示尿酸是2 型糖尿病合并肥胖的独立危险因素,积极降尿酸治疗可能对改善2 型糖尿病患者的体重有益处。推荐对新发2 型糖尿病患者常规评估血尿酸水平,以预防和治疗高尿酸血症及其相关并发症[27]。
笔者的研究还发现,在初诊2 型糖尿病患者中,无论是否肥胖,其25-羟基维生素D 水平均小于30 ng/mL,提示维生素D 减少。维生素D 减少及慢性负钙平衡,可导致继发性甲旁亢,进而发生另一代谢性疾病骨质疏松症。对于初诊2 型糖尿病患者,积极补充维生素D 意义重大。
本研究还观察到,在初诊2 型糖尿病患者中,无论是否肥胖,均存在高水平HOMR-IR。对于初诊2 型糖尿病患者,应通过改变生活方式,减重,使用二甲双胍,噻唑烷二酮类药物,GLP-I受体激动剂等改善胰岛素抵抗药物,使患者尽早获益。
综上所述,2 型糖尿病和肥胖发病机制复杂,初诊2 型糖尿病患者存在不同程度胰岛素抵抗、高瘦素水平及合并高尿酸血症等其他代谢性疾病,应综合管理其代谢异常指标,尤其是体重的管理尤为重要,从而防治糖尿病慢性并发症,使患者长期获益。

