用于识别细菌的有机荧光探针研究进展
刘志伟,袁振伟
(中国药科大学 工学院,江苏 南京 211198)
青霉素的出现曾被认为是人类现代医学和健康领域的一座丰碑,在二战争期间挽救了无数的生命。然而,随着抗生素的广泛使用,多重耐药细菌的出现越来越普遍。特别是那些接受过外科移植和癌症治疗的人更容易受到细菌感染。事实上,抗菌素耐药性已被世界卫生组织宣布为对人类健康的十大威胁之一[1]。 根据WHO的统计,到2035年耐药菌感染将超越癌症成为造成人类死亡(每年1 000万人)的主要原因[2]。因此,实现对细菌感染早期检测在细菌感染治疗中起着至关重要的作用,不仅可以筛选合适的抗生素,而且可以将益生菌与感染菌分选出来。目前临床采用的细菌检测方法是基于患者临床标本(血、尿、痰)进行的组织活检和细菌培养,这些操作不仅耗时费力,而且临床样本取样过程中不可避免地被污染,因此并不能反映真实的细菌情况。虽然新技术的细菌检测已经发展,如电化学测量[3], 实时的聚合酶链反应[4],表面强化的拉曼散射[5]等,但这些技术需要复杂的专业操作,同时缺乏足够的灵敏度。与上述方法和技术相比,基于荧光探针的荧光成像用来检测细菌感染是一种快速、可行的方法,其中荧光探针是一种精巧、灵敏的工具可以有效地对细菌进行实时检测。本文总结了目前存在的能够可视化检测细菌和感染的探针。这些探针根据其识别细菌的机制可分为共价结合型荧光探针和代谢标记型荧光探针。
1 基于化学结合策略的细菌识别荧光探针研究进展
与哺乳动物细胞的细胞膜成分不同,细菌细胞的细胞膜外有一层细胞壁,使细菌细胞免受恶劣环境的侵害。细菌的细胞壁是一个相当丰富和复杂的结构,并且有许多独特的成分,如肽聚糖、脂多糖和分支菌酸,因此,细菌的细胞壁被认为是检测和识别细菌的理想靶点,根据与细菌细胞壁上化学结合物的不同,基于化学结合策略的细菌探针包括基于抗生素结构的探针、基于锌(Ⅱ)二甲基吡啶胺和基于其它结构的探针。
1.1 基于抗生素结构的细菌识别探针研究进展
抗生素通过破坏细菌形态以及干扰功能底物的生物合成过程来消灭细菌,也就是说,具有与细菌结合能力的抗生素被认为是一种合理的细菌成像和可视化探针识别基团[6]。目前为止临床上批准用于治疗细菌感染的抗生素有6种,其中β-内酰胺、碳青霉烯类万古霉素和多粘菌素B启发了一系列检测细菌探针的设计。
1.1.1 基于B-内酰胺结构的细菌探针研究进展
细菌细胞壁的主要成分是肽聚糖(PG),它可以有效维持细菌的形状并保护它免受膨胀压力。PG是由b-(1,4)-连接的n-乙酰氨基葡萄糖(GlcNAc)和N-乙酰氨基葡萄糖(MurNAc)酸聚糖链和含有4~5个氨基酸的多肽链组成的聚合物结构,如图1所示,青霉素结合蛋白(PBP)作为转肽酶将D-丙氨酸(D-Ala)的羧基和L-赖氨酸的氨基交联成肽聚糖。B-内酰胺类抗生素通过与青霉素结合蛋白结合抑制肽聚糖正常交联使肽聚糖不能常规合成而导致细菌裂解。

图1 细菌肽聚糖的结构
b-内酰胺类抗生素为细菌成像提供了理想的识别基团。荧光标记的b-内酰胺类抗生素,如BODIPY偶联青霉素V类似物Bocilin(图2A)[7], 已被用于识别细菌以及检测活细菌中的PBP活性,这种策略也被称为基于活性的蛋白标[8-9]。此外一系列基于b-内酰胺类抗生素的荧光探针已经被陆续开发出来。Carlson[10]通过将四甲基罗丹明的荧光基团偶联到头孢菌素C的骨架上计并合成了一种含头孢菌素C的探针(图2B),体外细菌培养证明了CephC-T可以实现枯草芽孢杆菌PY79和D39肺炎链球菌的特异性体内成像。Xie[11]通过将头孢噻肟与4-羟基-1,8-萘酰亚胺(HN)进行偶联构建了一种比例型荧光探针CTX-HN(图2C),其结构中头孢噻肟作为b内酰胺酶识别片段,对ESBLs具有较好的选择性而不被其它b-内酰胺酶水解,在370 nm激发时,PBS中的CTX-HN在455 nm处荧光强烈,加入广谱b-内酰胺酶(ESBL)后CTX-HN的β-内酰胺环被水解并释放HN后,从而使得HN在455 nm处的发射逐渐降低,同时由于HN的大斯托克斯位移,560 nm处的发射增强(在450 nm激发)。在560 nm和455 nm处发射比的最大变化可达2 667倍。通过这种方法,CTH-HN可以有效区分产ESBL的耐药菌(ESPO)与一般细菌。

(A)Bocilin;(B)CephC-T;(C)CTX-HN。
1.1.2 基于碳青霉烯结构的细菌荧光探针研究进展
碳青霉烯类抗生素在β-内酰胺环上具有反式取代基,阻止了大多数β-内酰胺酶的水解从而可以被碳青霉烯酶选择性水解,因此碳青霉烯类抗生素探针有潜力作为探针的识别片段检测碳青霉烯酶产生菌(CPO),这是近年来迫切需要解决的一种引起严重感染的耐多药细菌[12]。Xie[13]设计了一种对CPO特异性响应的荧光探针CB-1(图3A)。CB-1以碳青霉烯母环为碳青霉烯酶识别基团。因为碳青霉烯结构的取代有效猝灭了BODIPY荧光发射因此CB-1最初是无荧光的(与未取代BODIPY相比),一旦与CPO接触后,碳青霉烯酶会特异性水解CB-1从而产生不稳定的二胺I,二胺I会进一步自发异构化或降解,破坏碳青霉烯酶与BODIPY的偶联,从而恢复BODIPY的强绿色荧光信号发射。Min[14]设计了以碳青霉烯母环为识别基团,苯基醚为连接体,香豆素为响应基团的探针1b(图3B)。1b可以全面识别产生各类碳青霉烯类酶的耐药菌。1b与产碳青霉烯酶肠杆菌科(CPE)临床标本孵育后,1b可以发出明显的荧光信号,证明探针1b具有良好的检测灵敏度和准确性。Yang[15]提出了一种比色型荧光探针CARBA-H(图3C),CARBA-H通过甲氧基苯基醚为连接体将识别片段与间萘酚的荧光团结合。CARBA-H与产碳青霉烯酶肠杆菌科(CPE)一起培养后,CARBA-H结构中的碳青霉烯母环会被碳青霉烯酶水解从而恢复间萘酚的荧光发射信号,因此CARBA-H可以实现对包括产Ambler在内的所有三个类别的碳青霉烯酶的广泛特异性鉴定和CPE临床分离株的荧光成像,特别是产OXA-48和oxa-181类型碳青霉烯酶的耐药菌株。

(A)CB-1;(B)1b;(C)CARBA-H。
1.1.3 基于万古霉素结构的细菌荧光探针研究进展
万古霉素(Van)是一种糖肽类抗生素,能特异性结合革兰氏阳性菌壁上的D-Ala-D-Ala序列,从而使得万古霉素成为构建革兰氏阳性菌特异性识别荧光探针的理想化识别基团。Dijl and Dam[16]通过将万古霉素偶联到近红外(NIR)荧光团IR-Dye 800CW设计了革兰氏阳性细菌识别探针Vanco-800CW(图4A),Vanco-800CW既可以对实现对小鼠体内革兰氏阳性细菌感染模型活体成像,也可以对死亡的革兰氏阳性菌进行成像。Xu[17]以FeCl3为氧化剂构建聚芴基噻吩-3-乙酸酯(PFPTA),所得聚噻吩(PFPTA)聚合物再与Van和a-甲氧基-邻氨基聚乙二醇(mPEG-NH2)通过酯胺反应偶联,成功构建荧光探针PTPVan(图4C)。
在体外MRSA培养模型中,PTPVan可作为革兰氏阳性细菌的荧光探针对MRSA(耐甲氧西林金黄色葡萄球菌)进行长时间的有效示踪。受到聚集诱导发光荧光团(AIEgen)优越的光学性能的启发,Liu[18]通过在自组装多肽链两侧分别偶联和AIEgen成功构建具有革兰氏阳性菌诊疗一体化功能的探针E-Probe(图4C)。E-probe与接触后,可与MRSA表面共价结合并进一步自组装形成纳米聚集体,激发光下E-Probe发光荧光信号并同时触发活性氧(ROS)的释放。在小鼠体内MRSA肌肉炎模型中,E-Probe不仅可以对MRSA引发的感染进行活体成像,而且可以治愈感染。
1.1.4 基于多黏菌素结构的细菌荧光探针研究进展
多黏菌素是一种结构中含有阳离子、两性、环状的抗菌肽[19],可以选择性地与革兰氏阴性细菌细胞壁上的脂多糖(LPS)的Lipid A发生化学结合。因此多黏菌素可用于构建对革兰氏阴性菌具有高亲和力的特异性探针Bradley[20]构建了亚甲基蓝-多黏菌素偶联物MB-PMX(图6A),可以同时对革兰氏阴性菌实现成像和杀伤。Dhaliwal[21]通过将多黏菌素b与环境敏感的7-硝基苯-2-氧杂-1,3-二唑(NBD)荧光基团进行化学偶联研制了一种水溶性光学成像探针NBD-PMX(图6B),NBD的极性敏感特性使得NBD-PMX在细菌感染后产生的疏水环境下能激发出更高的信噪比,同时该探针化学稳定无毒,经喉镜途径在肺腔内给入微量(MIC 1/10)的NBD-PMX后,能够在短短的几分钟内实现对于罹患呼吸机肺炎患者体内远端人体气道和肺泡中的革兰氏阴性菌的高分辨率实时成像。
1.2 基于锌(II)-二甲基吡啶胺结构的细菌荧光探针研究进展
锌(II)-二甲基吡啶胺(ZnDPA)是一种含有锌离子的化合物,可以特异性地与细菌包膜中普遍存在的磷酸化的两亲体、磷脂酰甘油、心磷脂发生化学结合[22],使得ZnDPA可以成功识别构建细菌识别探针理想化识别基团。Smith[23]以ZnDPA作为识别基团和BODIPY作为荧光团构建了两种结构类似的荧光探针。一种探针是微生物靶向荧光显像剂mSeek,另一种探针是氧光敏类似物mDestroy(图5A)。这两种ZnDPA-BODIPY偶联物都能实现特异性的细菌成像,同时侧链被碘原子修饰后的mDestroy可以在激发光下产生ROS从而有效杀死细菌。Smith[24]进一步构建了一个以花氰染料为荧光基团的ZnDPA探针Cy-ZnDPA(图5B),结果表明Cy-ZnDPA可以有效实现革兰氏阳性菌感染的小鼠活体成像。基于芳酸及其衍生物结构的染料及其偶联物已被制备和评价用于各种类型的成像应用[25-27]通过将芳酸类荧光基团包封在保护性大环内,构建了两个高稳定性的芳酸轮烷衍生物,然后将这两个轮烷衍生物与ZnDPA偶联到轮烷的两侧,成功构建出为两个结构相关的细菌探针Squaraine-Zndpa1和Suqaraine-ZnDPA2(图6C)。在腿部感染裸鼠模型中,两个探针都实现了细菌感染的成像, 并且Squaraine-ZnDPA-1比Squaraine-ZnDPA-2表现出更高的荧光强度和更快的体内清除速率。

(A)MB-PMX;(B)NBD-PMX。

(A)mSeek和mDestroy的结构;(B)Cy-ZnDPA;(C)squarine-ZnDPA1和squarine-ZnDPA2。
1.3 其它结构的细菌荧光探针研究进展
除了细胞壁的特殊成分以外,近年来还发现了细菌中存在的一些其他靶点。有研究表明证明含有硼酸的染料可以通过与表面的糖蛋白结构结合来标记革兰氏阳性细菌的孢子[27]。
Chang[29]合成并开发了一种基于BODIPY结构的荧光探针BacGo(图7A),体外细菌培养表明BacGo可以实现对几乎所有革兰氏阳性细菌的广泛成像,而不染色革兰氏阴性细菌。丝状温度敏感Z蛋白(FtsZ)已被证明在细菌细胞分裂过程[30-31]以及葡聚糖的生物合成[32]中发挥重要作用。也就是说,FtsZ蛋白被认为是开发新型抗生素的一个有希望的新靶点[33-34]。Matsumura 和Pilch[35]通过将荧光基团BPDIPY偶联到一个恶唑-苯甲酰胺结构的FtsZ抑制剂上开发了一种基于ftsz蛋白抑制剂的荧光探针BOFP(图6B),体外细菌培养表明:BOFP可以有效地标记上述所有革兰氏阳性和革兰氏阴性病原体,因此BOFP是一种优越的荧光探针,具有广谱的细菌识别和检测能力。

(A)BacGo;(B)BOFP。
2 基于代谢标记策略的细菌荧光探针研究进展
细菌是一种活的生命有机体,因此需要从周围环境中吸收营养并合成功能底物来满足自身的繁殖和生长的需要。值得注意的是细菌和哺乳动物的代谢途径存在巨大差异[36],根据代谢物质的不同,细菌代谢途径可以具体分为碳水化合物代谢途径,核苷,叶酸的代谢途径。细菌细胞膜独特组分的生物合成过程以及铁离子的代谢途径,其中碳水化合物的代谢和细菌细胞壁独特组分的生物合成可以为荧光探针实现细菌的敏感和选择性可视化提供坚实的基础。与传统的与细菌共价结合的探针相比,基于代谢标记策略的探针具有背景信号低、灵敏度和特异性好等显著优势。
2.1 基于糖代谢途径标记的细菌荧光探针研究进展
糖类是细菌繁殖必不可少缺的营养物质之一。与哺乳动物细胞类似,细菌通过活性转运体介导的主动转运吸收糖类,因此细菌细胞膜上有许多相应的转运体从而将胞外的糖转运到胞内[37-39]。根据糖类具体种类的不同,细菌的糖类代谢途径可以分为麦芽糖代谢途径以及海藻糖代谢途径。其中麦芽糖和麦芽糖己糖被各种活性细菌普遍利用,而海藻糖是分枝杆菌细胞壁上不可或缺独特成分,被分枝杆菌特异性吸收[40]。
2.1.1 基于麦芽糖代谢途径标记的细菌荧光探针研究进展
麦芽糖和麦芽己糖是细菌重要的供能物质之一[41]因此细菌可以表达一种独特的麦芽糖糊精转运蛋白[42]。然而这种麦芽糖糊精转运蛋白在哺乳动物细胞膜上是不表达的[43]。受到细菌和哺乳动物细胞中的独特麦芽糖途径差异的启发,Murthy[44]通过分别将炔功能化的苝和荧光染料IR-780与叠氮化的葡萄糖寡聚物进行点击反应,构建了两个基于麦芽糖的探针MDP1和MDP-2(图8A)。基于麦芽糖的探针充分利用了葡萄糖低聚物的亲水性和不透膜性以及麦芽糖糊精被细菌选择性内化的优势,并且在体内和体外实验中MDP-1和MDP-2均表现出良好的细菌成像能力。Gambhir[45]开发了一种麦芽糖的荧光衍生物Cy7-1(图9B),在体外细菌培养中和小鼠体内感染模型中Cy7-1可被多种革兰氏阳性和革兰氏阴性菌株吸收从而同时实现荧光与光声的双重成像。在大肠杆菌诱导的肌炎和临床相关的金黄色葡萄球菌伤口感染小鼠模型中证明了该探针不仅可以检测感染、评估感染程度,而且可以对抗生素治疗效果的能力进行可视化评估。

从左至右分别为碳水化合物、叶酸、细胞壁 铁离子和核苷代谢途径。

(A)MDP-1和MDP-2;(B)Cy7-1。
2.1.2 基于海藻糖代谢途径标记的细菌荧光探针研究进展b
如图10所示,海藻糖是海藻糖二羧酸酯(TDM)的前体,TDM是分枝杆菌菌膜的重要成分。外源性海藻糖分子可以通过两种代谢途径进入分枝杆菌外膜。第一种途径是通过糖abc-lpqy转运蛋白复合物将海藻糖的双糖转运到细胞质中[46]使得海藻糖转化为海藻糖二酸盐(TDM),接着通过Mmpl3转运体系统从细胞质转运到外膜[47]。第二种途径定位于外周质,涉及抗原Ag85介导的海藻糖真菌化[48]。Ag85蛋白复合体由三种相关的酰基转移酶Ag85A、Ag85B和Ag85C组成,它们负责海藻糖的酰化,形成海藻糖菌酸[49]。

图10 结核分枝杆菌细胞膜结构[50]
一些课题组已经观察到经过结构修饰的海藻糖荧光类似物[50-51]可以被整合到结核分枝杆菌的菌膜中。Bertozzi[52]通过将海藻糖与环境敏感的4-N,N-二甲氨基-1,8-萘酰亚胺(DMN)荧光基团偶联,构建了荧光模拟物DMN-Tre(图11A)可以实现对菌膜的准确标记和监测。得益于DMN-Tre被整合到疏水菌膜的过程是由Ag38复合物进行的,同时DMN从水环境过渡到疏水环境时可以触发更强的荧光强度,因此DMN-Tre被进一步开发为快速识别和检测患者痰液中存在的结核分枝杆菌的工具[53]。最近有研究证明[54-55]海藻糖二霉菌酸(TDM)可以被分枝杆菌特异性水解酶(Tdmh)水解从而增加结核分枝杆菌菌膜对营养物质的通透性,使得分枝杆菌能够主动获取更多的营养物质,以应对宿主免疫系统引起的营养剥夺。受此启发Swarts[56]构建了一种基于FRET的TDM类似物FRET-TDM(图11B),在与Tdmh接触后,FRET-TDM结构中的猝灭基团DABCYL会因为Tdmh水解作用而离去从而恢复荧光发射线信号。体外实验表明,FRET-TDM可被分枝杆菌产生的Tdmh特异性激活从而作为分枝杆菌鉴定和成像的探针。Kiessling[57]开发了一种含有猝灭剂的海藻糖探QTF,该探针由BODPI荧光团和DABCYL猝灭剂组成,QTF可以被Ag85的真菌转移酶特异性水解使得猝灭基团DABCYL离去,结构中残留的海藻糖类似物作为供体被结核分枝杆菌吸收从而实现分枝杆菌生长的实时荧光成像。

(A)DMN-Tre;(B)FRET-Tdm;(C)QTF。

(A)TPEDy-D-Al;(B)Si-Rhodamine;(C)IR-FGN。
2.2 基于细胞壁合成途径标记的细菌荧光探针研究进展
细胞壁是维持细菌重要组成部分可以有效维持细菌形态不受外界环境的影响。细胞壁是一个多维的复合体,其成分因细菌的种类而有所异,细菌需要吸收一系列的前体来形成细胞壁以维持自身形态,因此这些荧光标记前体类似物可以作为荧光探针来识别细菌。许多证据表明,d-氨基酸和3-脱氧-d-甘露-辛-2-酮糖酸(KDO)可以转化为代谢标记型荧光探针。
2.2.1 基于肽聚糖合成途径代谢标记的细菌荧光探针研究进展
如图11A所示,D-氨基酸是肽聚糖的成分之一,因此,荧光标记D-氨基酸(FDAA)可以作为氨基酸的供体被参与细菌的复制过程从而掺入PG中,实现对细菌的特异性成像[58]。同时,由于D-氨基酸不能被哺乳动物细胞吸收使得基于FDAA结构的探针可以实现高对比度成像,区分细菌感染细胞和无菌细胞。在FDAA中D-Ala是最广泛使用的荧光探针,因为D-Ala是PG肽链第4和第5位的天然残基,因此可以减弱FDAA标记PG的潜在空间位阻更容易整合到PG当中。Liu[59]通过将AIE光敏剂吡啶取代四苯基乙烯(TPEPy)与D-Ala结合构建出代谢标记性荧光探针TPEPy-d-Ala(图11A),当一旦代谢结合到细菌肽聚糖中,TPEPy-d-Ala的分子内运动被抑制导致荧光信号增强,与此同时TPEPy-d-Ala具备光敏剂特异性可以在激发光下产生单线态氧,有效清除细胞内细菌,更重要的是,由于结构中D-Ala和吡啶的亲水性,使得TPEPy-d-Ala在细胞内亲水环境中弱发射,从而保证了较低的背景信号实现高信噪比成像。生物正交化学的快速发展为荧光探针的设计提供了新的思路。Berottzi[60]将含罗丹明的叠氮化物基团与硅原子修饰的罗丹明和环二烯基团D-Ala进行偶联成功构建了一种基于氨基酸的细菌探针Si-Rhodamine(图11B)。既含D-Ala的环二烯先作为丙氨酸供体被掺入PG中,随后Si-Rhodamine通过点击反应与D-Ala结合,一旦与环二烯反应后,Si-Rhodamine的荧光量子产率提高到48倍,且Si-Rhodamine比罗丹明具有更长的发射波长。体外细菌培养证明Si-Rhodamine能够实现体内细菌病原体感染的可视化成像。Tan[61]开发了一种基于近红外二区(NIR-II)的代谢标记荧光探针(图11C),该探针由D-炔丙基甘氨酸和IR-FGN的NIR-II荧光团组成。先将D-炔丙基甘氨酸灌胃给予取C57BL/6小鼠,间隔3 h后收集C57BL/6的盲肠微生物,清洗干净后通过灌胃给与C57BL/6小鼠灌胃IR-FGN标记的菌群,并且NIR-II激发光下照射。移植了IR-FGN标记微生物群的C57BL/6小鼠模型腹部有清晰的荧光成像,当移植小鼠接受乙醇杀死IR-FGN标记微生物群时,荧光强度明显下降,实验结果证明IR-FGN可以实现小鼠体内肠杆菌的可视化实时成像。
2.2.2 基于KDO合成途径标记的细菌荧光探针研究进展
图13A所示,脂多糖(LPS)由三种结构成分组成:最外层的多糖结构域为O抗原,核心结构域由糖和LipidA组成,其中LipidA是一种与几种脂肪酸连接的磷酸化的氨基葡萄糖二糖。而3-脱氧-d-甘露-辛-酮糖酸(KDO)是LPS内核的一种特异性和必需成分,长期以来被认为存在于几乎所有革兰氏阴性物种的LPS中[62-63],因此,荧光标记的KDO可以实现革兰氏阴性菌的特异性识别成像[64]。
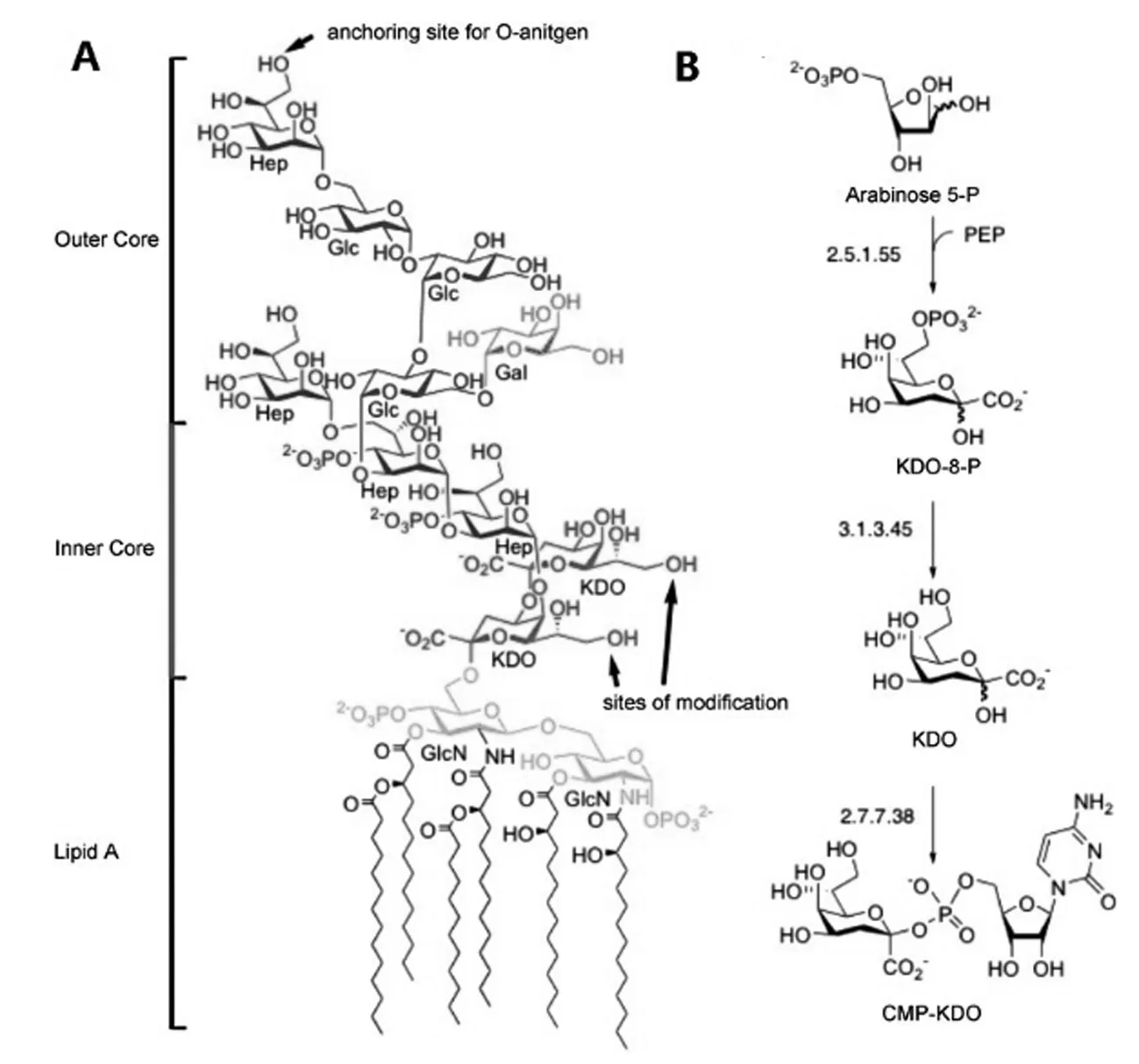
(A)LPS的结构;(B)KOD的合成途径。
受到生物正交与点击化学的启发,Vauzeilles[65]合成了叠氮化物基团偶联类似物KDO和罗丹明与丁炔偶联的荧光探针Rho-KDO(图14A)。叠氮化的KDO可被革兰氏阴性菌迅速吸收并结合到LPS中,随后,罗丹明与丁炔偶联的荧光团与LPS定位的KDO结合,使罗丹明对革兰氏阴性菌实现特异性成像。无独有偶,Liu[66]通过使用具有AIE特性的四苯基乙烯开发了一种基于生物正交的细菌探针TPEPA-KDO(图14B)。在体外细菌实验中,TPEPA不仅对革兰氏阴性菌进行了出色的特异性荧光成像,而且利用四苯基乙烯的光敏剂特性,实现了对革兰氏阴性细菌的特异性的诊疗一体化,综上所述KDO是构建革兰氏阴性细菌特异性识别荧光探针的理想化靶点。
3 总结与展望
在本文中,我们总结了目前用于细菌识别和可视化的荧光探针,包括基于细菌化学结合策略的探针和基于代谢途径标记策略的探针,其中相当一部分已用于临床实际细菌检测和筛选新的抗生素。展望未来,荧光探针在细菌成像和监测方面既有机遇,也有挑战。虽然荧光探针可以实现对细菌的灵敏、快速的可视化,但其自身存在光漂白、聚集猝灭(ACQ)和激发光穿透深度有限等一系列缺点和缺陷,其中最困难的障碍之一可能是需要开发出易于穿透细菌细胞包膜的并且荧光发射信号强度高并且光稳定的荧光团。一般来说,荧光探针由识别片段连接体和荧光基团组成,其中识别片段是必不可少的核心。生物化学和细菌细胞生物学的快速发展使我们对细胞的形态和分裂有了更深入的了解从而为高特异性与高灵敏度的细菌荧光探针的设计开发提供有效的理论基础。总之,荧光探针在未来几年将继续蓬勃发展,并且在可预见的未来,荧光探针将在细菌成像、新型抗生素筛选、细菌诊疗一体化等方面发挥不可或缺的作用。

