低位直肠癌保肛手术治疗直肠癌对TNF-α、IL-2 与T 淋巴细胞亚群的影响
储玮 王明月 张璇
直肠癌是常见的消化道恶性肿瘤,在胃肠道恶性肿瘤中其发生率仅次于胃癌,位居第二位[1]。直肠癌主要治疗方案以外科手术为主,但中下段直肠癌与肛管括约肌接近,手术时很难保留肛门及其功能是手术的难题[2]。Miles 术式(传统直肠癌根治术)虽具有一定疗效,但该术具有创伤性,易对机体产生一系列生理变化,释放大量炎性因子,进而影响术后恢复。随着临床对直肠癌生物学特征的不断研究,诸多学者认为手术不仅要完全切除肿瘤,还要尽可能保留肛门直肠功能,提高患者生活质量[3-4]。低位直肠癌保肛手术则符合上述理念,其在确保完整切除肿瘤的同时又可保留肛门的正常功能[5]。本文旨在分析低位直肠癌保肛手术治疗直肠肿瘤坏死因子-α(Tumor necrosis factor-alpha,TNF-α)、白介素-2(Interleukin-2,IL-2)与T 淋巴细胞亚群的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取2018 年3 月至2020 年2 月张家口市第五医院收治的直肠癌患者103 例,根据手术方案分为A 组(低位直肠癌保肛手术)53 例和B 组(Miles 术式)50 例。其中B 组男36 例,女14 例,平均年龄(53.27±5.66)岁,平均肿瘤直径(2.31±0.85)cm,TNM 分期[6]:Ⅰ期21 例,Ⅱ期29 例,分化程度:中分化腺癌31 例,高分化腺癌19 例;A 组男39 例,女14 例,平均年龄(52.58±5.37)岁,平均肿瘤直径(2.05±0.77)cm,TNM 分期:Ⅰ期23 例,Ⅱ期30 例,分化程度:中分化腺癌32 例,高分化腺癌21 例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经院医学伦理委员会批准通过,受试者或家属已签署《知情同意书》。
纳入标准:①经病理检查确诊为直肠癌,且符合《WHO 结直肠癌诊断标准在术前活组织检查病理诊断中的应用》中相关诊断标准[6];②凝血功能正常者;③临床资料齐全;④意识、精神正常者,可正常交流。排除标准:①具有手术禁忌症;②多发直肠癌肿瘤或存在远处转移;③心肝肾功能不全。
1.2 方法
1.2.1 手术治疗
A 组(低位直肠癌保肛手术):分离患者乙状结肠以及直肠系膜,解剖暴露患者的肠系膜下动脉和肠系膜下静脉,清扫肠系膜下动脉根部淋巴结,结扎血管;切除部分直肠,去除肿瘤,包扎缝合[7]。B 组(Miles 术式):直肠粘膜下静脉和动脉进行常规游离结扎处理,采用电刀相应处理肛门周围50 mm 处皮下组织和全部肛门括约肌,在左下腹部进行永久性乙状结肠单腔造口处理[8]。
1.2.2 采血、离心条件
所有研究对象均于术前、术后采集静脉血3 mL,及时送往实验室进行离心(转速3 500 r/min,10 min,离心半径10 cm)后采取上清液,放置-40℃冰箱进行冷藏,待检测。
1.3 观察指标
1.3.1 两组并发症发生率对比
统计并观察并发症发生情况,主要包括大便失禁、感染、尿道损伤等。
1.3.2 两组肿瘤局部复发率、生存率对比
患者出院后进行36 个月随访,随访截止时间为2023 年2 月,且要求患者来院复查,进行影像学、电子肠镜等检查,比较患者术后肿瘤局部复发率、转移率、生存率。
1.4 统计学方法
采用SPSS 21.0 统计软件进行统计分析,计量资料采用()表示,两组间比较采用t检验;计数资料通过n(%)表示,并采用χ2检验,均以P<0.05为差异具有统计学意义。
2 结果
2.1 两组手术指标比较
A 组失血量少于B 组,且手术时长、肛门排气时间、术后住院时长及术后肠道恢复时长均短于B组,差异有统计学意义(P<0.05)。见表1。
表1 两组手术指标比较()Table 1 Comparison of surgical indicators between the two groups()
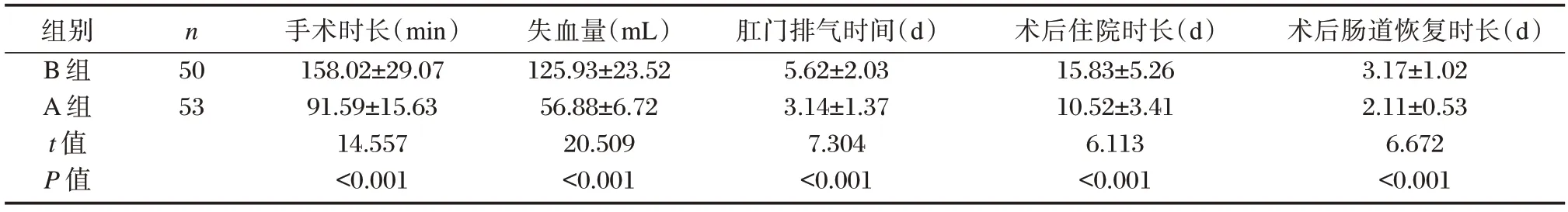
表1 两组手术指标比较()Table 1 Comparison of surgical indicators between the two groups()
2.2 两组炎症因子比较
术后两组TNF-α 水平均上升,IL-2 水平均下降,且A 组TNF-α 水平低于B 组,IL-2 水平高于B组,差异有统计学意义(P<0.05)。见表2。
表2 两组TNF-α、IL-2 水平比较()Table 2 Comparison of TNF-α,IL-2 levels between the two groups()
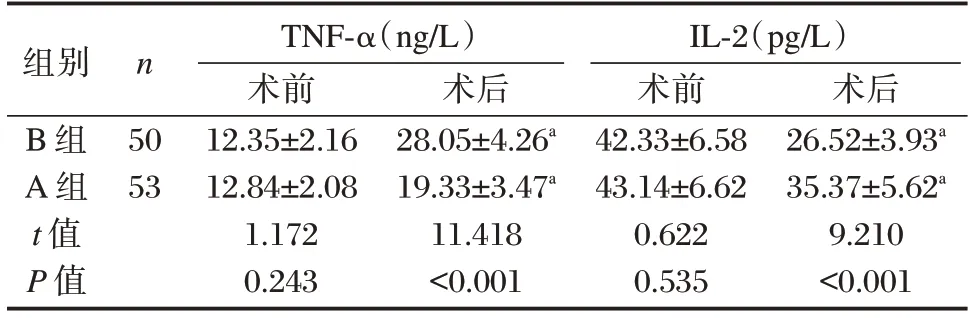
表2 两组TNF-α、IL-2 水平比较()Table 2 Comparison of TNF-α,IL-2 levels between the two groups()
注:与同组术前比较,aP<0.05。
2.3 两组T 淋巴细胞亚群比较
两组术后CD3+、CD4+水平均显著下降,CD8+水平上升,且A 组CD3+、CD4+水平高于B 组,CD8+水平低于B 组,差异有统计学意义(P<0.05)。见表3。
表3 两组T 淋巴细胞亚群水平比较[(),%]Table 3 Comparison of T lymphocyte subgroup levels between the two groups[(),%]
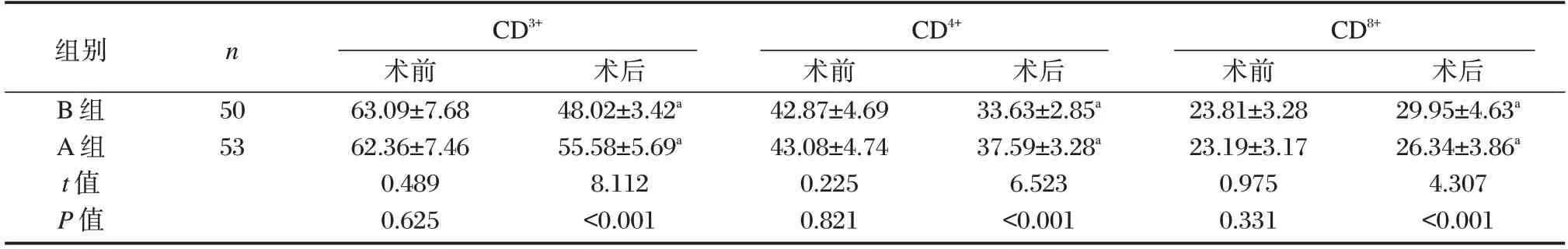
表3 两组T 淋巴细胞亚群水平比较[(),%]Table 3 Comparison of T lymphocyte subgroup levels between the two groups[(),%]
注:与同组术前比较,aP<0.05。
2.4 两组并发症比较
A 组(3.76%)并发症总发生率明显低于B 组(16.00%),差异有统计学意义(P<0.05)。见表4。
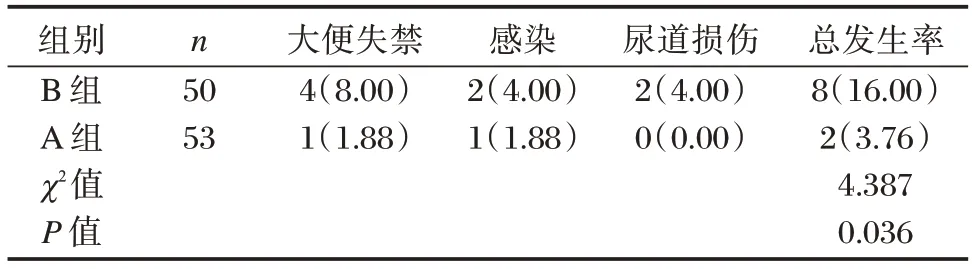
表4 两组并发症发生率比较[n(%)]Table 4 Comparison of the incidence of complications between the two groups[n(%)]
2.5 两组肿瘤局部复发率、转移率、生存率比较
A 组肿瘤局部复发率、转移率均显著低于B组,3 年生存率高于B 组,差异有统计学意义(P<0.05)。见表5。
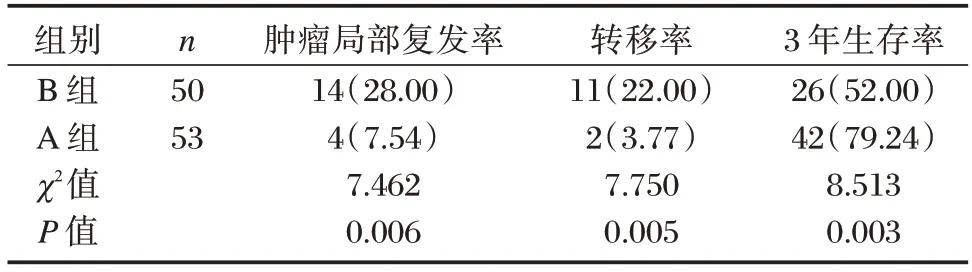
表5 两组肿瘤局部复发率、转移率、生存率比较[n(%)]Table 5 Comparison of local recurrence rate,metastasis rate and survival rate between the two groups[n(%)]
3 讨论
既往临床以Miles 术式作为直肠癌手术治疗的“金标准”,该术具有肿瘤组织切除范围广、根治率高等优点;但随着医学技术的提高,该术亦表现出一系列不足,如:对肛门功能损害高、术后易出现性功能障碍、感染等并发症、术后恢复慢等[9]。低位直肠癌保肛手术利用双吻合器技术、内窥镜切除技术对患者进行手术,可完整切除病变组织,保留肛门外形与功能[10]。有研究报道[11],低位直肠癌保肛手术拥有与Miles 术式同样的临床疗效,且可保留肛门正常的排便功能,利于提高患者生活质量,增强患者治疗自信心。本次研究显示,A 组失血量少于B 组,且手术时长、肛门排气时间、术后住院时长及术后肠道恢复时长均短于B组。分析主要是因为:与Miles 术式相比,低位直肠癌保肛手术操作简单,且无需切除会阴及盆底组织,具有创伤小、恢复快等优点[12]。
姚远等[13]曾报道,Miles 术式会对机体产生一定损伤,使机体发生一系列生理病理变化,对细胞因子分泌造成影响,如IL-2、TNF-α 等表达,从而不利于患者术后恢复。IL-2 作为免疫系统中的细胞生长因子,其水平降低则可能代表手术造成免疫抑制。TNF-α 是由巨噬细胞、单核细胞所产生的促炎细胞因子,可参与正常炎症反应与免疫反应。近年国外研究显示,直肠癌患者术后TNF-α 水平上升,提示手术损伤程度严重[14]。近年张泉等[15]提出直肠癌发生与肿瘤微环境具有密切联系,特别是T 淋巴细胞功能耗竭与肿瘤免疫逃逸相关。既往有研究显示,直肠癌患者外周血中CD4+T 淋巴比值下降,CD8+T 淋巴比值上升[16]。本次研究显示,A 组TNF-α 水平低于B 组,IL-2 水平高于B 组;A 组CD3+、CD4+水平高于B 组,CD8+水平低于B 组。说明低位直肠癌保肛手术术后患者创伤更小,所产生的炎症反应更小,T 淋巴细胞亚群变化更小。分析原因在于:低位直肠癌保肛手术保留肛管,彻底清除全肠系膜及周围血管、淋巴结、脂肪组织等,有利于缓解应激反应,改善免疫功能。另外,直肠癌术后肿瘤局部复发、转移并非受单一因素影响,与肿瘤部位、大小、形状、分期、分化程度等诸多因素均有相关[17]。本次研究显示,A 组肿瘤局部复发率、转移率均显著低于B 组,3 年生存率高于B 组,再次间接证实低位直肠癌保肛手术具有良好临床疗效,且可提高患者生存率,术后并发症少。分析原因在于:在内窥镜下进行手术,视野广阔,经腹及肛门联合切除吻合暴露良好,有效切除了癌肿组织,降低癌细胞生长、复发、转移发生率。
综上所述,低位直肠癌保肛手术治疗直肠癌临床疗效良好,术后对TNF-α、IL-2 与T 淋巴细胞亚群影响小,可显著提高生存率,降低并发症发生率。

