芯片式数字PCR 检测禽流感病毒方法的性能验证
严谨 姜欣余 阎琪 陈小凤
聚合酶链式反应(Polymerase Chain Reaction,PCR)是一种分子生物学技术,利用脱氧核糖核酸(Deoxyribonucleic Acid,DNA)聚合酶扩增DNA 片段。自20 世纪80 年代初发明以来,PCR 已成为检测微生物不可或缺的工具。数字PCR(digital PCR,dPCR)是传统PCR的改进型生物技术,可以扩增和直接定量DNA。1992 年,Sykes 提出了dPCR 的概念,它通过泊松分布和稀释模板来量化DNA 分子到单分子水平[1]。Volgelstein 和Kinzler 在1999 年首次将dPCR 应用于研究中,通过一系列四个96 孔板,对结直肠癌患者样品进行物理分区,以检测ras 癌基因中的突变[2]。近年来,随着微流控技术日臻成熟,基于微流控技术的数字PCR(chip-based digital PCR)技术得到了快速发展,在基因突变检测、拷贝数变异检测、病毒微生物检测、转基因食品检测以及二代测序等方面均得到广泛的应用。
禽流感病毒检测的金标准是实时荧光定量PCR 技 术(Quantitative real-time PCR,qPCR)[3],qPCR 方法的优点是高通量和较高灵敏度,但实验结果易受样品抑制剂影响,导致扩增效率低,在低浓度样品中精确度较低,且主观性强,量化取决于标准曲线[4-5]。作为新兴PCR 平台的dPCR,具有更高的抑制剂耐受性,且它是终点法测量,较少依赖于PCR 扩增效率[6-7]。其原理是将一个PCR 混合物分离成许多独立的纳升级亚反应,单个分区有少量或没有目标序列。PCR 完成后,确定每个样本的阳性和阴性分区的比例,并通过泊松统计来计算核酸绝对拷贝数[8]。由于分区被计数为正数或负数的二进制性质,使量化更加简单。
1 材料与方法
1.1 材料
1.1.1 标本来源
甲型流感标准品是由本单位储藏,浓度为1×107copies/mL 的质粒,并保存于-80℃超低温冰箱;根据重庆市禽流感监测方案,于2022 年1 月采集的人和加新农贸市场禽流感外环境标本31 份。
1.1.2 试剂与仪器
主要试剂与仪器:甲型流感病毒检测试剂盒(PCR 荧光探针法)、甲型流感病毒试剂盒(数字PCR 法)(均购自中山大学达安基因股份有限公司);核酸提取试剂盒(购自中元公司);dPCR 系统(购自新加坡JN MEDSYS 公司);核酸提取仪(购自硕世公司);生物安全柜、PCR 扩增仪(均购自美国Thermo 公司);振荡器(购自德国Eppendorf 公司);移液器(购自瑞士METTLER TOLEDO 公司)。
1.2 方法
1.2.1 标本采集、病毒基因组提取
禽流感标本从农贸市场摊贩的案板、笼具及刀具表面和禽类排泄物中涂抹采集到病毒采样管中,取200 μL 采样液用病毒核酸提取试剂盒抽提禽流感病毒基因组RNA。
1.2.2 反应体系配制、微反应制备
Clarity dPCR 系统应用了一种独特的管内芯片格式,通过使用自动装载器同时装载和划分8 个反应混合物,可以高效快速地进行实验。随后用密封增强剂和密封流体将反应混合物密封在隔板中。接着,对反应进行热循环。热循环后,管条被转移到Clarity 阅读器中,以检测隔板中的荧光信号。最后,通过Clarity 软件分析阳性与阴性分区的比例,并使用泊松统计来计算每个样本的拷贝数浓度。体系配制,微反应制备,结果读取均按说明书操作。
1.2.3 标准曲线的建立并比较两种方法的线性范围和吻合度
流感质粒标准品(以下简称为标准品)建立qPCR 的标准曲线,选取浓度为1×107copies/mL 的标准品进行10 倍稀释,稀释至1.00×103copies/mL,每个稀释度分别重复做三次检测,建立标准曲线。将质粒标准品倍比稀释成3.05×102copies/mL~1.00×107copies/mL 16 个稀释度,每个稀释度分别重复做三次检测。观察用两种方法检测上述16 个稀释度标准品结果的线性范围以及和预期结果的相关性,并用线性回归比较两种方法的吻合程度。
1.2.4 精密度试验
分析方法的精密度取决于同一样品在特定条件下多次测定获得的一系列测量结果的接近程度,通过分析标准品在不同稀释度下的变异系数(Coefficient of Variance,CV),测试使用相同的设备,通过计算标准品在各稀释水平下被测浓度的变异系数(CV)来评价衡量精密度,用百分比表示。CV 值越低,精密度越高。
1.2.5 灵敏度试验
通过将标准品浓度依次稀释到2.00×103,1.00×103,8.00×102,6.00×102,5.00×102,3.00×102,2.50×102,1.25×102,测定分析灵敏度,定义为检测下限(Limit of Detection,LOD)。每个稀释度进行20 次重复实验,并使用概率回归分析结果。LOD 定义为检测概率为95%的反应中目标DNA 的浓度,并通过插值概率曲线确定。
1.2.6 dPCR 和qPCR 在检测环境样本中的比较
用两种方法分别检测31 份农贸市场环境标本,分别得到荧光定量PCR 和数字PCR 的检测结果。
1.2.7 统计学分析
采用SPSS 26 统计软件和Graphpad prism8.0 进行统计学分析。用Bland-Altman 分析评价dPCR 与qPCR 的一致性。采用配对卡方检验评估两种方法阳性率的差异。以P<0.05 为差异有统计学意义。
2 结果
2.1 两种方法的线性范围及线性回归分析
dPCR在3.05×102copies/mL~1.00×107copies/mL测量范围内,测量值和预测值具有良好的线性关系。两者在线性范围内斜率之间的差异无统计学意义(F=0.996,P=0.321)。见图1。
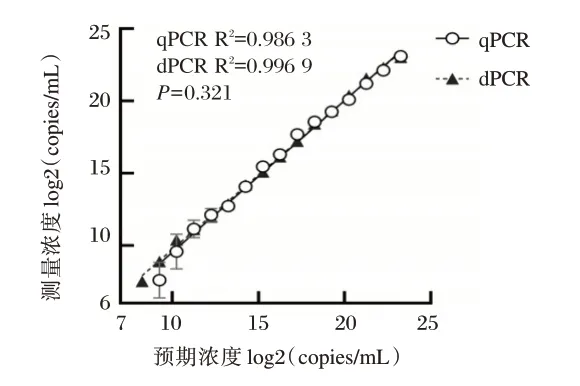
图1 核酸标准品与dPCR 和qPCR 定量结果的线性关系Fig. 1 Linear relationship of dPCR and qPCR for plasmid DNAs
2.2 两种方法的批内精密度
相同条件下,随着浓度降低,dPCR 和qPCR 的CV 值越高,精密度下降,在15 个都能检测出标准品稀释度中,dPCR 有12 个稀释度的CV 值低于qPCR,特别是在标准品浓度小于1×104copies/mL,dPCR 的CV 值远低于qPCR。见图2。
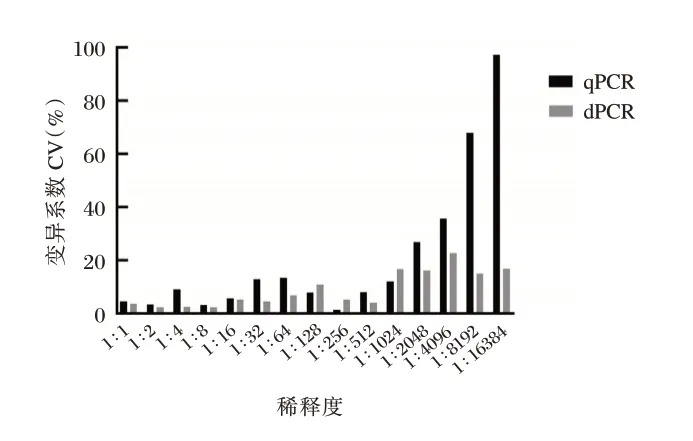
图2 dPCR 和qPCR 在各稀释水平下的变异系数Fig. 2 Coefficient of Variation at each dilution level by dPCR and qPCR
2.3 两种方法的检测下限(LOD)
标准品的连续稀释的概率回归分析,估算dPCR的LOD 为410(95%CI:344~570)copies/mL,qPCR的LOD 为845(95%CI:749~1 004)copies/mL,相比之下,dPCR 检测具有更低的检测下限。见图3。
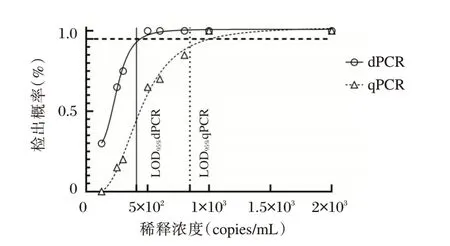
图3 概率分析曲线计算dPCR 和qPCR 的最低检出限Fig. 3 Probit analysis sigmoid curve reporting the LoD of dPCR and qPCR
2.4 两种方法检测禽流感环境标本结果比较
针对31 份禽流感环境标本的核酸检测,结果表明dPCR 的检出率(96.8%)高于qPCR 检出率(80.6%),差异无统计学意义(Kappa=0.244,P=0.063)。采 用Bland-Altman 分析评 价dPCR 与qPCR 的一致性,经分析两种定量检测方法的偏倚值为1.265 139,两种方法95%一致性界限为1.265 139±1.96×4.689 898。见图4。
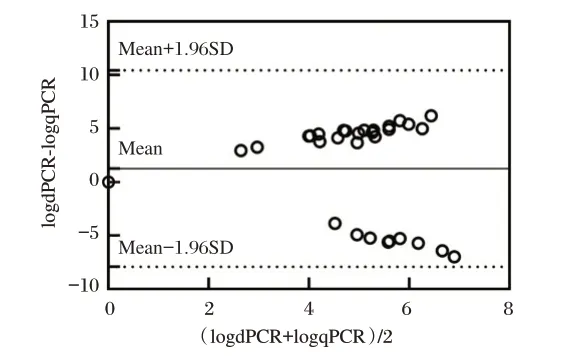
图4 dPCR 和qPCR 定量检测禽流感病毒的Bland-Altman分析图Fig. 4 The Bland-Altman analysis of quantitative Avian influenza virus by dPCR and qPCR
3 讨论
市场上现有的商业dPCR 平台主要采用两种方法:一种是QX100™/200™滴式dPCR 系统(Bio-RadLaboratories)和Naica®系统(StillaTechnologies)采用的基于水油乳化液滴技术的方法;另一种是BioMark™HD(Fluidigm)、QuantStudio®3D(Thermo-FisherScientific)、qiacity(QIAGEN)和Clarity™(JNMedsys)采用的基于芯片/纳米板技术[9]的方法。然而,液滴式dPCR 在热循环过程中可能会出现液滴合并的现象,导致样品丢失[10-11],因此低丰度样品可能存在漏检的情况。本实验采用JNMedsys公司推出的一种名为Clarity™的新型dPCR 系统,该系统结合了基于液滴和基于芯片系统的优点,用一种新颖的管中芯片的方法来进行样品划分。每个反应混合在高密度芯片上被细分为10 000 个分区。这种基于芯片的分区设计提供了更好的稳定性,且简化了液滴式PCR 相关的繁琐工作流程,减少了检测时间。需要指出的是,dPCR 作为一种新兴技术,目前可用的系统代表了第一代或第二代平台。研究人员正在开发新的平台和方法,通过强化利用dPCR 的理论优势,来解决现有的局限性。例如,增加dPCR 可检测的荧光通道数量[12];开发基于分区体积的变化[13]来纠正目标分子丰度的估计的算法。因此,随着时间的推移,dPCR 有望得到不断的改进和增强,我们可以展望,比起现有检测技术,未来的检测平台可能会表现出更多指标上的优势。
禽流感病毒的定量分析能力可以提高对病毒生物学的认识,而dPCR 提供了一个更加高效的平台。在本研究中,质粒标准品在3.05×102copies/mL~1.00×107copies/mL 是因为这一范围覆盖了仪器制造商推荐的输入拷贝范围。在这一浓度范围内,与dPCR 检测值呈良好的线性关系,R2=0.996 9,dPCR 和qPCR 在线性范围内斜率之间的差异无统计学意义;dPCR 在不同稀释度的批内精密度变异系数(CV)范围为2.36%~22.78%,在低浓度下,dPCR 比qPCR 展现出更好的精密度;dPCR的估计检测下限(LOD)为410(95%CI,344~570)copies/mL,qPCR 的估计LOD 为845(95%CI,749~1 004)copies/mL;用dPCR 和qPCR 检测31 份农贸市场环境标本,dPCR 的检出率96.8%,qPCR 的检出率80.6%,两种方法的定量一致性较好。由于标准品的限制,未能精确的确定dPCR 的线性动态范围上限,但数据显示Clarity Plus™dPCR 至少在1.00×102~1.00×107,6 个数量级的浓度范围内展现了良好的线性关系。
研究表明增加dPCR 的分区数量或者稀释目标DNA 可以获得较高的检测范围[14]。Clarity Plus™dPCR 系统在检测禽流感病毒中展现出优异的性能,并成功检测出低丰度病毒RNA 样本,具有较高检测精确度。鉴于这些优点,使用Clarity-Plus™dPCR 有可能在临床应用中作为一种有效的分子诊断工具,用于检测低丰度的禽流感病毒标本或通过绝对定量来监测病人治疗的有效性。此外,该技术还可用于其他病毒例如新型冠状病毒(SARS-CoV-2)的环境监测。在废水等环境样本中检测SARS-CoV-2,可以为社区中的疾病传播和暴发提供早期预警信号[15]。
综上,与传统qPCR相比,dPCR在性能方面的优势使其在病原检测上显示出巨大的潜力和应用前景。

