低温诱导表达SlBRI1增强番茄幼苗耐寒能力
杨文文,冯梦颖,瞿 芮,刘心雨,聂书明
(西华师范大学 生命科学学院,西南野生动植物资源保护教育部重点实验室,四川南充 637000)
番茄(SolanumlycopersicumL.)属于茄科(Solanaceae)番茄属(LycopersiconMiller)的喜温性草本植物,是开展生物学基础研究的一个重要对象,同时也是一种模式植物[1]。干旱[2]、弱光[3]、低温[4]等非生物胁迫是影响植物生长发育的重要因素。由于部分地区气候条件恶劣,番茄极易遭受低温冷害。低温胁迫会导致植物出现光合作用减弱、抗氧化酶活性降低、活性氧含量增加、叶绿素降解、生长发育受阻等生理现象,造成植株生长迟缓、幼苗萎蔫、坐果率低等情况,最终影响番茄的产量和品质[4]。光合作用对温度十分敏感,通过将光能转化为稳定的化学能为植物生长发育提供能量,是影响作物产量的关键要素之一[5]。研究发现低温会破坏叶绿体亚显微结构,并发生光抑制,致使叶绿体内光能剩余过多,活性氧产率增加,进而造成光合作用下降[6]。在自然光照条件下,叶绿素荧光参数和光合速率两者之间存在负相关关系,通过叶绿素荧光参数可以评估植物对过剩光能的消散能力[7]。因此,植物受胁迫程度可通过植物光合作用和叶绿素荧光特性评估[8]。
油菜素内酯(brassinosteroids,BRs)参与调节植物的生长、发育以及胁迫响应等多个生理过程[9],对作物的产量、品质、抗逆性和抗病性等方面有着重要的调控作用[10]。目前外源施加天然BRs已被用于提高多种植物抵抗低温能力[11-12]。BR在信号转导过程中首先与BRI1(brassinosteroid insensitive 1)结合,促进其依次转磷酸化,并与其共受体BAK1(BRI1-ASSOCIATED KINASE 1)结合形成异源二聚体,BRI1与BAK1相互作用并激活BR信号,随后BR信号被转导到下游元件。去磷酸化的BES1(bri1-EMS suppressor 1)和BZR1(brassinazole resistance 1)在细胞核中积累,调控几千个BR响应基因的表达[2]。研究发现过表达BR合成基因DWARF可提高番茄幼苗BR含量和抗寒性,与之相反突变体降低了BR含量,降低了植物的抗寒性[12]。BR信号基因BIN2(brassinosteroids-insensitive 2)是BR信号的负调控因子,在植物对低温胁迫的反应中起着关键作用。bin2突变体表现出更高的抗冻性,而BIN2过表达降低了番茄幼苗的抗冻性[4]。过表达SlBZR1通过提高ABA水平和CBF1的表达来提高转基因植株的耐寒性,而bzr1突变体则降低番茄植株的耐寒性[13]。BRI1作为BR的主要信号受体,35S启动子驱动过表达SlBRI1能有效清除ROS,缓解光抑制以及调控植物激素合成和信号传导,提高了转基因植物的抗寒性,而BRI1突变体bri1-1和bri1-301降低了植物的抗寒能力[14-16]。rd29A作为一种重要的逆境诱导型启动子,能够响应低温、盐胁迫、干旱等环境胁迫[17-18]。目前,rd29A已经被广泛应用于缓解基因的负面影响[19]。rd29A启动子驱动的AtDREB1A/CBF3,通过增强关键抗氧化酶的活性来缓解转基因番茄干旱诱导的氧化应激[20]。由rd29A启动子驱动的ICE1基因在正常条件下在转基因水稻品系中正常表达,而低温胁迫后转基因品系ICE1基因表达增加,抗寒性提高[21]。在目前研究的低温调控网络中,ICE-CBF-COR信号途径为报道较广泛的通路之一[22]。ICE1是CBF3低温响应中的关键基因,其通过磺酰化修饰被激活后,能够与CBF3启动子相结合,上调CBF3基因的表达,从而显著提高植株低温胁迫的应答[23]。
前人研究结果显示,BR信号基因在植物响应冷胁迫过程中发挥重要作用,可以通过调节植物激素、增强抗氧化酶活性和抗寒基因的表达来提高植物的抗寒性[17]。但目前关于番茄Atrd29A启动BR受体SlBRI1在响应冷胁迫过程中的调节规律尚不清楚。本研究以Atrd29A启动的SlBRI1基因为切入点,番茄品种Micro-Tom(MT)、SlBRI1过表达株系(Atrd29A:SlBRI1)为材料,在低温环境下对番茄幼苗的抗寒能力进行比较分析。通过相关指标阐明SlBRI1过表达对番茄抗冷性的生理调控效应,旨在揭示BR信号强度与番茄抗冷性两者之间的关系,为今后选取耐寒性番茄品种提供理论依据,对农业生产也有一定的参考价值。
1 材料和方法
1.1 试验设计
试验于西华师范大学生命科学学院实验室进行。实验材料为番茄Micro-Tom (MT)种子和SlBRI1过表达T3代转基因种子。SlBRI1过表达转基因番茄植物参考Nie等人的方法获得[24]。根据SlBRI1表达量选取2个独立的纯合SlBRI1过表达株系(Atrd29A:SlBRI1-2、Atrd29A:SlBRI1-5)进行低温实验。选取饱满且大小一致的番茄种子,进行消毒、浸种,置于25 ℃培养箱中催芽处理,种子露白后播于营养钵内(泥炭∶MIKSKAAR=1∶1),幼苗生长在温度为25 ℃,光周期为16 h/8 h的温室中。当番茄苗长至五叶一心时,对MT、Atrd29A:SlBRI1-2和Atrd29A:SlBRI1-53组材料进行4 ℃低温处理,试验设3次重复。测定低温胁迫后0 d、5 d的光合参数、荧光参数以及相关逆境基因转录水平,并对其幼苗的抗寒能力进行比较分析。
1.2 测量指标及方法
光合参数:利用LI-6400便携式光合作用测量系统(LI-COR公司,美国)测定幼苗从上而下第3片完全展开叶的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)。所有的测量均在CO2浓度为400 μmol/mol,叶片温度25 ℃和1 200 μmol/(m2·s)光强下进行。
叶绿素荧光参数:将叶片暗处理30 min后,使用LI-6400便携式光合作用仪测定叶绿素荧光参数值。测定初始荧光(Fo)、最大荧光(Fm)、光下最小荧光(Fo′)、光下最大荧光(Fm′)及稳态荧光(Fs)。根据测定的叶绿素荧光参数计算光系统Ⅱ(PS Ⅱ)中的最大光化学效率值:Fv/Fm=(Fm-Fo)/Fm,实际光能转化效率值:ΦPS Ⅱ=(Fm′-Fs)/Fm′,开放的PS Ⅱ反应中心最大的光能转化效率值:Fv′/Fm′=(Fm′-Fo′)/Fm′,光化学猝灭系数值:Qp=(Fm′-Fs)/(Fm′-Fo′),测定3次。
基因转录水平分析:用天根试剂盒提取番茄叶片总RNA。质量合格的RNA采用Vazyme反转录试剂盒合成cDNA。在实时荧光定量PCR仪(Bio-Rad)上进行qRT-PCR反应。定量检测体系为20 μL:10 μL 2×ChamQ Universal SYBR qPCR Master Mix,8 μL cDNA模板,正/反向引物各0.4 μL,1.2 μL ddH2O。反应条件为95 ℃ 30 s; 95 ℃ 10 s, 60 ℃ 30 s,40 个循环。每个样品 3 次重复,以番茄UBI3基因为内参,采用2-ΔΔCT方法[25]计算所有株系中抗逆基因的相对表达量(SlBRI1、SlICE1、SlCBF1、SlCBF3和SlDRCI7)。
1.3 数据处理
采用SPSS 19.0软件对数据进行单项因素方差分析,用Duncan’s多重比较进行差异显著性分析(P<0.05),数据用平均值±标准误差表示。
2 结果与分析
2.1 Atrd29A启动子表达SlBRI1对番茄幼苗SlBRI1表达水平的影响
如图1所示,低温胁迫0 d时,野生型和转基因植株中SlBRI1基因的相对表达量具有显著性差异。与低温处理0 d相比,低温胁迫5 d提高了MT、Atrd29A:SlBRI1-2和Atrd29A:SlBRI1-5中SlBRI1基因的相对表达量,MT野生型提高了3.45倍,而转基因株系Atrd29A:SlBRI1-2和Atrd29A:SlBRI1-5分别提高了7.06倍和7.17倍。说明Atrd29A启动子在低温环境下能够增强SlBRI1的表达。

柱状图上不同小写字母表示材料间差异显著(P<0.05)。下同。图1 野生型(MT)和Atrd29A:SlBRI1番茄幼苗在低温胁迫下SlBRI1转录水平的相对变化Different lowercase letters indicate significant differences among materials (P<0.05). The same as below.Fig.1 Relative changes of transcription levels of SlBRI1 in tomato seedlings of wild type (MT) and Atrd29A:SlBRI1 under low temperature stress
2.2 Atrd29A启动子表达SlBRI1对番茄幼苗外在形态的影响
如图2所示,低温胁迫0 d时, MT和Atrd29A:SlBRI1转基因植株外在形态无明显差异,低温胁迫5 d后,所有植株均表现出不同程度的萎蔫现象。Atrd29A:SlBRI1-2、Atrd29A:SlBRI1-5出现轻微的萎蔫,而MT植株萎蔫程度更明显。说明Atrd29A:SlBRI1转基因植株比MT抗寒能力更强。在25 ℃条件下恢复3 d后,各株系萎蔫状况均有缓解,但MT植株的萎蔫程度仍比Atrd29A:SlBRI1-2、Atrd29A:SlBRI1-5枯萎程度明显。表明SlBRI1基因对植株低温后的恢复能力也有一定的调节作用。

图2 野生型(MT)和Atrd29A:SlBRI1番茄幼苗在低温胁迫0 d、5 d和恢复3 d后的表型Fig.2 Phenotypes of tomato seedlings of wild type (MT) and Atrd29A:SlBRI1 after 0 and 5 days of low temperature stress and 3 days of recovery
2.3 Atrd29A启动子表达SlBRI1对番茄幼苗气体交换参数的影响
如图3所示,低温胁迫0 d时,Pn、Gs、Tr和Ci野生型和Atrd29A:SlBRI1转基因植株没有显著性差异。与胁迫0 d相比,低温胁迫5 d后番茄叶片的Pn、Gs和Tr显著下降(图3,A、B、D),Ci呈上升趋势(图3,C)。说明在低温条件下,CO2向叶绿体的转运受到了限制,造成光合作用原料供应减少,从而导致光合速率的下降。其中Pn分别降低69.61%、64.91%、63.70%;Gs分别降低49.50%、32.91%、36.52%;Tr分别降低66.41%、59.13%、57.79%;Ci分别升高75.57%、61.33%、63.69%。较SlBRI1转基因植株而言MT受低温影响更明显,低温胁迫5 d后Atrd29A:SIBRI1-2、Atrd29A:SlBRI1-5的Pn、Gs和Tr均显著高于MT,Ci显著低于MT。说明诱导SlBRI1的表达能减缓低温胁迫对植株光合特性的影响。
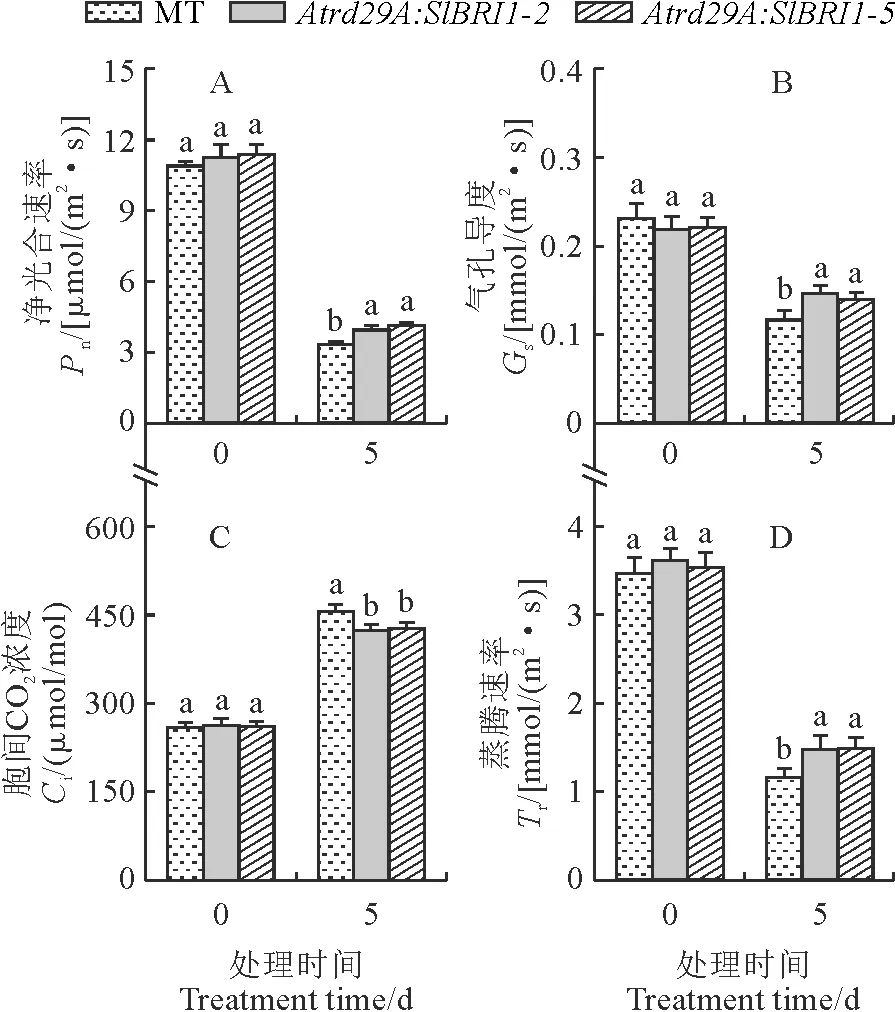
图3 低温胁迫对番茄幼苗叶片气体交换参数的影响Fig.3 Effect of low temperature stress on gas exchange parameters of tomato seedling leaves
2.4 Atrd29A启动子表达SlBRI1对番茄幼苗叶绿素荧光参数的影响
如图4所示,低温胁迫0 d时,MT和Atrd29A:SlBRI1转基因植株的Fv/Fm、ΦPSⅡ、Fv′/Fm′、qP没有显著性差异。低温胁迫5 d后,Fv/Fm、ΦPSⅡ、Fv′/Fm′和qP均低于胁迫前,Fv/Fm分别降低43.88%、36.36%、36.68%;ΦPSⅡ分别降低74.46%、66.49%、65.74%;Fv′/Fm′分别降低64.73%、57.65%、57.04%;qP分别降低57.52%、53.37%、52.63%。说明在光合作用过程中,低温可能导致PSⅡ平衡被打破,导致光抑制,进而影响光合电子供给,在一定程度上影响了光能向化学能的转化。低温胁迫5 d后,Atrd29A:SlBRI1-2、Atrd29A:SlBRI1-5的Fv/Fm、ΦPSⅡ、Fv′/Fm′和qP降低的程度明显低于MT。说明诱导SlBRI1的表达能减缓低温胁迫对植株荧光特性的影响。

图4 低温胁迫对番茄叶片荧光参数的影响Fig.4 Effect of low temperature stress on fluorescence parameters of tomato leaves
2.5 Atrd29A启动子表达SlBRI1对番茄幼苗抗冷基因表达的影响
如图5所示,低温处理0 d时MT、Atrd29A:SlBRI1-2和Atrd29A:SlBRI1-5的SlCBF1、SlCBF3表达水平具有显著差异。
与低温处理0 d相比,低温处理5 d提高了MT、Atrd29A:SlBRI1-2和Atrd29A:SlBRI1-5中SlICE1、SlCBF1、SlCBF3和SlDRCI7基因的相对表达量,SlICE1基因相对表达量分别增加23.33%、87.07%、723.73%;SlCBF1基因相对表达量分别增加340.71%、392.34%、283.47%;SlCBF3基因相对表达量分别增加73.05%、572.79%、458.21%;SlDRCI7基因相对表达量分别增加325.46%、532.20%、6 993.82%。低温处理5 d后,Atrd29A:SIBRI1-2和Atrd29A:SlBRI1-5中SlICE1、SlCBF1、SlCBF3和SlDRCI7基因的相对表达量显著高于MT。表明Atrd29A:SlBRI1转基因植株增强了低温逆境基因表达水平,对低温胁迫的响应能力显著提高。
3 讨 论
光合作用是一种受温度影响较大的生理过程,在较低的温度下,由于气孔导度的降低,导致了叶面气孔的闭合,从而降低了CO2的供给,光合作用受到气孔因素限制[26]。在重度胁迫下,植物的光合能力受到气孔因素和非气孔因素的双重限制,且以非气孔因素为主[27]。本研究发现,低温胁迫下番茄幼苗的Pn、Gs和Tr都有较大幅度地下降,表明低温胁迫对番茄幼苗气孔有明显的抑制作用。同时,植株的Ci显著升高,说明在较低的温度下,气孔的阻滞将对CO2的吸收和气体交换造成不良的影响,光合作用受阻,这与杨鸿基等的研究结果[28]相一致。本研究结果显示,经过5 d的低温胁迫后,Atrd29A:SlBRI1转基因植株叶片的Pn、Gs和Tr下降幅度小于MT野生型,Ci增长幅度大于野生型,表明野生型叶片气体交换参数对低温胁迫的敏感性大于转基因型,诱导SlBRI1的表达能够缓解低温胁迫对植株光合作用的破坏,提高植株的抗寒能力[29]。
叶绿素荧光参数包含了极其丰富的生理信息,是检测作物生长发育和光合特性的有效手段[30]。Fv/Fm体现了植物PSⅡ光能转换的最大潜能,它反映了PSⅡ的原初光能转化效率,Fv/Fm下降表明植株受到光抑制[31]。PSⅡ是光化学反应中心,极易受低温影响,主要表现在光能的吸收、转换与电子传递等方面[32]。Fv′/Fm′是开放PSⅡ反应中心的激发能捕获效率[33]。qP是PSⅡ光化学猝灭系数,体现在光化学传输中所占PSⅡ天线色素吸收的光能的份额,qP下降表明植物光合作用中的暗反应受到影响[7]。本研究结果表明,低温显著降低了番茄叶片的Fv/Fm、ΦPSⅡ、Fv′/Fm′和qP,这与在葡萄上的研究结果[34]一致。此类结果说明在光合作用中低温胁迫会破坏PSⅡ,并发生光抑制,影响其碳代谢过程中的电子供应[32],也对番茄幼苗PSⅡ的光能转换成化学能有一定程度的阻碍。本研究结果显示,SlBRI1转基因植株在低温环境下Fv/Fm、ΦPS Ⅱ、Fv′/Fm′和qP都显著高于野生型植株,说明诱导SlBRI1的表达有利于缓解低温对叶绿素荧光参数的影响。
ICE1-CBF-COR途径作为植物应对低温胁迫的重要一环,在提高植物胁迫应答层面具有不可忽视的效用[29]。CBFs转录因子是低温胁迫过程中的重要分子开关,在一定程度上调控大量与低温相关的基因,ICE1是其重要的转录调控因子[35]。在响应低温应答过程中,ICE1转录因子被激活,使其下游基因CBFs及COR被诱导表达,能够提高自身抵御低温胁迫的能力[36]。植株通过过表达SlCBF2、SlCBF3和SlCBF1提高植物的耐寒性,相关研究表明,低温能有效地诱导CBF1的表达,CBF的表达量则在低温短期内快速升高,并达到最大值[37]。因此CBF1基因的表达量和抗冷性之间存在着一定的相关关系,可以作为评价番茄抗冷性的指标之一[38]。在低温胁迫中,SlICE1与CBF1的启动子结合,提高SlCBF1和SlDRCI7基因的表达[39]。本研究结果表明,在低温胁迫下所有植株的SlICE1、SlCBF1、SlCBF3和SlDRCI7基因表达水平都显著上升,并且SlBRI1转基因植株的SlICE1、SlCBF1、SlCBF3和SlDRCI7基因的表达水平在低温胁迫后均显著高于MT植株。这与拟南芥相关研究结果[40]一致。这些结果表明,诱导SlBRI1的表达可能通过ICE-CBF-COR途径提高番茄植株的抗寒能力。
该研究通过对野生型(MT)和SlBRI1过表达株系(Atrd29A:SlBRI1)进行低温处理,较野生型而言SlBRI1过表达缓解了冷害对番茄植株Pn、Gs、Tr、Fv/Fm、ΦPS Ⅱ、Fv′/Fm′和qP降低的程度。同时,减缓植株的Ci上升。低温胁迫后,SlBRI1转基因植株的SlICE1、SlCBF1、SlCBF3和SlDRCI7基因表达水平均显著高于MT植株。综上所述,Atrd29A启动的SlBRI1过表达能够缓解低温胁迫对植株光合作用的抑制,显著提高对低温胁迫的响应能力。

