滇水金凤转录因子TT8的克隆及表达分析
李新艺,李 洋,向南星,李泽凤,黄美娟,黄海泉
(西南林业大学 园林园艺学院,国家林业和草原局西南风景园林工程技术研究中心,云南省功能性花卉资源及产业化技术工程研究中心,西南林业大学 园林园艺花卉研发中心,昆明 650224)
植物绚丽多彩的颜色是决定植物观赏价值的关键因素之一,其中花色占据了不可或缺的地位[1]。花色的相关研究具有十分深远的意义,目前国内外对植物花色的研究主要集中在花色的形成调控和变异机理等方面[2-3],而对花色影响最直接的就是植物中花色苷的合成代谢[4]。
花色素苷代谢途径中结构基因编码合成各种相关酶,如4CL和DFR等[5],其上游的调节基因可调控上述结构基因的表达,如bHLH、MYB、WD40等[6],其中bHLH参与了植物的各种生命活动,如花色素苷的合成和生长发育等,还与植物对不良环境的响应调节有关[7-9]。TT8(TRANSPARENT TESTA 8)基因属于bHLH家族的IIIf亚组,该亚组还包括GL3、EGL3和AtMYC1等基因,均与植物花青素的代谢有关[10]。
TT8能够与TT2(MYB)、TTG1(WD40)蛋白形成稳定三元复合物调控花青素合成途径中后期结构基因的表达,还能够通过正负反馈调节自身的表达,进而促进花青素和原花青素的合成[11-12]。细茎石斛(Dendrobiumcandidum)DcTT8可以通过结合DcF3′H和DcUFGT的启动子来调节它们的表达,进而影响花青素的生物合成[13]。在蒺藜苜蓿(Medicagotruncatula)中,MtTT8基因可以使拟南芥(Arabidopsisthaliana)Attt8突变体以及蒺藜苜蓿Mttt8突变体恢复花青素和原花青素的积累,且MtTT8可以和WD40家族的MtWD40-1以及MYB家族的MtPAR或MtLAP1相互作用来激活ANR和ANS的启动子,进而分别调节原花青素和花青素的生物合成[14]。莲(Nelumbonucifera)NnTT8基因是AtTT8的同源基因,可以恢复拟南芥tt8突变体表型,这表明NnTT8基因在调节花青素和原花青素生物合成方面具有与AtTT8相似的功能[15]。
在拟南芥tt8突变体中过表达腊梅(Chimonanthuspraecox)CpTT8基因能促进植株中花青素的积累,并使拟南芥突变体恢复表型,表明CpTT8基因可以正向调控腊梅中花青素的合成[16]。转录因子在植物花色调控方面的作用已成为研究热点,随着人们对不同物种花色的深入研究,bHLH在花青素调控方面的作用得到了科学验证,但目前国内外鲜见凤仙花bHLH的相关报道,TT8基因在凤仙花中的功能和作用机制有待阐明。
滇水金凤(ImpatiensuliginosaL.)是中国特有的凤仙花属植物,集中分布于中国西南地区,一年生或多年生。滇水金凤具有花色丰富、开花期长、生物量大、观赏性较高且抗性强等特点,所以其在滇池等湿地的建设中应用广泛[17]。
本研究以RT-PCR技术克隆滇水金凤中的TT8基因,生物信息学方法分析其序列结构特征以及系统发育等,并以本课题组在野外发现的野生型(红色)及突变型(白色、粉色和深红色)滇水金凤花器官为植物材料,通过qRT-PCR检测TT8基因在滇水金凤4种花色以及4个花发育时期中的表达规律,为进一步研究花色调节相关转录因子IuTT8在滇水金凤花色苷代谢途径的调控机制以及花色变异机理奠定基础。
1 材料和方法
1.1 试验材料
滇水金凤4个花色均采自于昆明市捞鱼河湿地公园。目的基因的克隆和qRT-PCR分别以红色滇水金凤以及4种花色及其4个花发育阶段(S1花苞期、S2始花期、S3盛花期、S4谢花期)的滇水金凤花器官为材料(图1)。

图1 滇水金凤花器官的4种花色及其4个花发育时期Fig.1 Floral organs of four colors and their four flower development stages in I.uliginosa
1.2 方 法
1.2.1 RNA提取与TT8基因克隆
滇水金凤总RNA以OMEGA公司的RNA提取试剂盒提取,然后以全式金公司的逆转录试剂盒将其逆转录为cDNA,并置于-20 ℃中备用。
根据转录组数据设计IuTT8的特异性引物,将其分成3段进行克隆,IuTT81F(5′-ATGGCGGCGCCTCCTAGCTT-3′)、IuTT81R(5′-GCCAA-ACTCAACCACACCATCC-3′);IuTT82F(5′-AGCAAGCTCTTCACTAGAGC-3′)、IuTT82R (5′-CTTCTTCGTCGTCAACATCC-3′);IuTT83F(5′-CTTCTCTCCCTGCCTTGTAC-3′)、IuTT83R(5′-TTAACATTGTGGTATTATTCTG-3′),共2 136 bp。以红色滇水金凤花器官为模板进行IuTT8基因的cDNA和gDNA扩增。PCR反应程序:95 ℃ 5 min;95 ℃ 50 s,61 ℃(IuTT81)/55 ℃(IuTT82)/51 ℃(IuTT83)30 s,72 ℃ 2 min,35次循环;72 ℃ 10 min。连接转化后进行菌检,将电泳条带正确的送往生工测序,结果用DNAMAN 6.0进行序列拼接。
1.2.2IuTT8基因生物信息学分析
使用Gene Structure Display Server分析IuTT8基因的结构;用ExPasy对IuTT8进行基本理化性质分析;分别以SignalP-4.1与TMHMM Server预测IuTT8的信号肽与跨膜结构;PSORTⅡ预测IuTT8的亚细胞定位;IuTT8的二、三级结构分别以SOPMA和Swiss-Model预测;CDD预测IuTT8蛋白的保守结构域;MEME预测IuTT8及其同源蛋白的基序,并以TB Tool进行蛋白基序可视化。DNAMAN 6.0用于序列比对;MEGA 7.0用于构建系统发育树。
1.2.3IuTT8基因的表达特性分析
IuTT8基因的qRT-PCR引物:qIuTT8F(5′-GCTGGAAGAAACCTGAAGAG-3′)、qIuTT8R(5′-CTAAACGACCGATGGTAATTC-3′);内参基因为Actin[17]。每个样品重复3次,使用2-ΔΔCT计算4种花色及其4个花发育时期中IuTT8基因的相对表达量,用SPSS进行数据显著性分析。
2 结果与分析
2.1 滇水金凤IuTT8基因的克隆
通过克隆获得IuTT8基因的最大开放阅读框和gDNA,其最大开放阅读框为2 136 bp,其gDNA全长为3 938 bp,共6个内含子,分别长613 bp(105~717 bp)、802 bp(988~1 789 bp)、107 bp(1 887~1 993 bp)、106 bp(2 009~2 114 bp)、93 bp(2 172~2 264 bp)、81 bp(3 779~3 859 bp),见图2和图3。
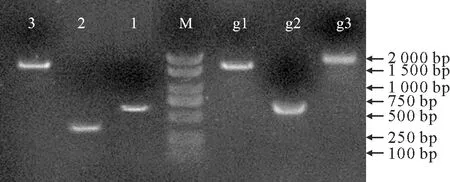
M. DL 2000 Marker; 1. IuTT8-1; 2. IuTT8-2;3. IuTT8-3; g1. IuTT8-1 gDNA;g2. IuTT8-2 gDNA; g3. IuTT8-3 gDNA.图2 滇水金凤TT8基因的克隆Fig.2 Cloning of TT8 from I.uliginosa

图3 滇水金凤IuTT8基因的基因结构分析Fig.3 Gene structure analysis of IuTT8 gene in I. uliginosa
2.2 IuTT8蛋白的基本理化性质及保守域分析
IuTT8基因全长为2 136 bp,编码711个氨基酸。IuTT8蛋白的相对分子量为79 249.06 D;pI为5.17;分子式为C3459H5500N980O1104S24;原子总数为11 067;不稳定指数(instability index)为65.03,为不稳定蛋白质;IuTT8的GRAVY为-0.509,是亲水性蛋白。
预测表明IuTT8不存在信号肽与跨膜区(图4)。PSORT Ⅱ 预测结果表明,IuTT8蛋白主要(56.5%)定位在细胞核中。
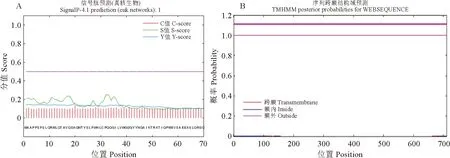
图4 滇水金凤IuTT8蛋白的信号肽(A)及跨膜区(B)预测Fig.4 The signal peptide (A) and transmembrane region (B) prediction of IuTT8 protein in I. uliginosa
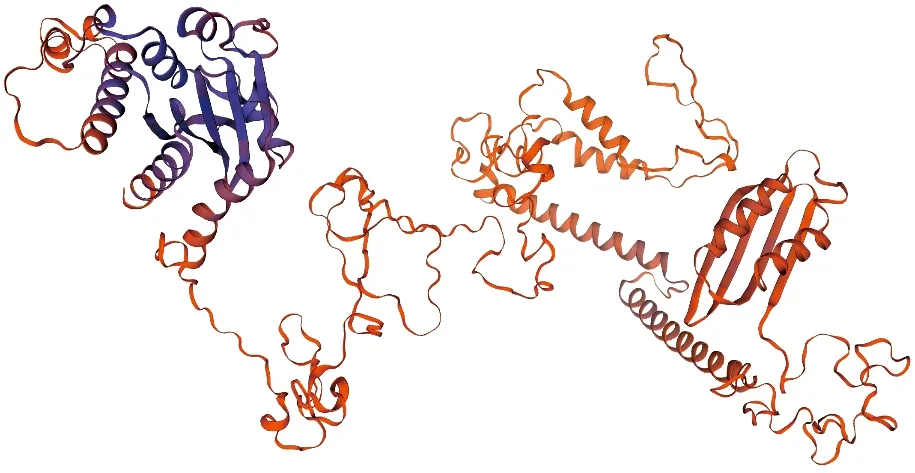
图5 IuTT8蛋白三级结构Fig.5 The tertiary structure of IuTT8 protein
二级结构预测发现IuTT8蛋白主要包含了51.2%无规则卷曲,还有36.57%的α-螺旋以及少量的延伸链(9.14%)和β-转角(3.09%)等结构。上述预测结果表明 IuTT8蛋白的稳定性不高,且此蛋白无规则卷曲结构占比大,其结构可能比较复杂。运用Swiss-Model,以拟南芥TT8蛋白为模型,预测滇水金凤IuTT8的三级结构,其QMEAN值为0.46,GMQE值为0.41,预测结果表明IuTT8蛋白三级结构以无规则卷曲与α-螺旋为主(图 5),结果与二级结构预测的一致。
2.3 IuTT8蛋白保守域和Motif预测
结构域分析表明IuTT8蛋白具有2个保守的区域,其中1个是N端的MYB互作区;另1个是C末端的HLH区,该区在其他物种中除了可以与自身形成同型二聚体外,还能够与其他蛋白质一起形成异型二聚体。由图6可知IuTT8蛋白含有bHLH超家族的特征蛋白序列,具有DNA binding site和dimer interface区域,因此推测滇水金凤IuTT8蛋白属于bHLH超家族成员(图6)。
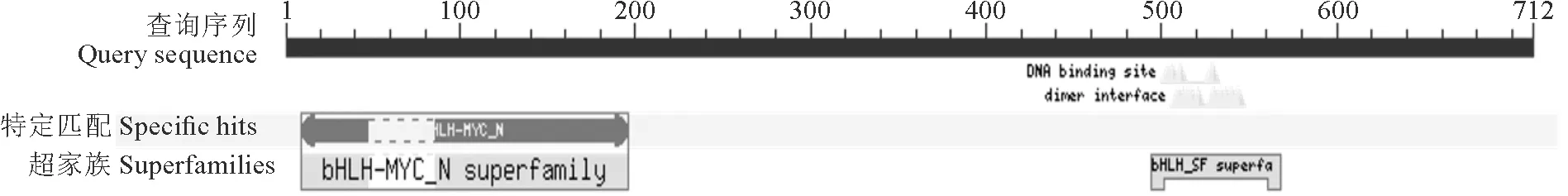
图6 滇水金凤IuTT8蛋白的保守结构域分析Fig.6 Conserved domains analysis of IuTT8 protein in I. uliginosa
通过MEME进行IuTT8及其同源蛋白的基序预测,分别命名为motif1~motif10,分析发现TT8氨基酸的保守序列分析呈现相似性,且都含有10种保守基序,其中motif 6、motif 3、motif 1和motif 5位于MYB互作区,motif 2位于保守的DNA binding site和dimer interface区域。除此之外,滇水金凤、喜马拉雅凤仙花(I.glandulifera)和山茶(Camelliasinensisvar.assamica)的TT8蛋白还含有1个重复的motif 7(图7)。
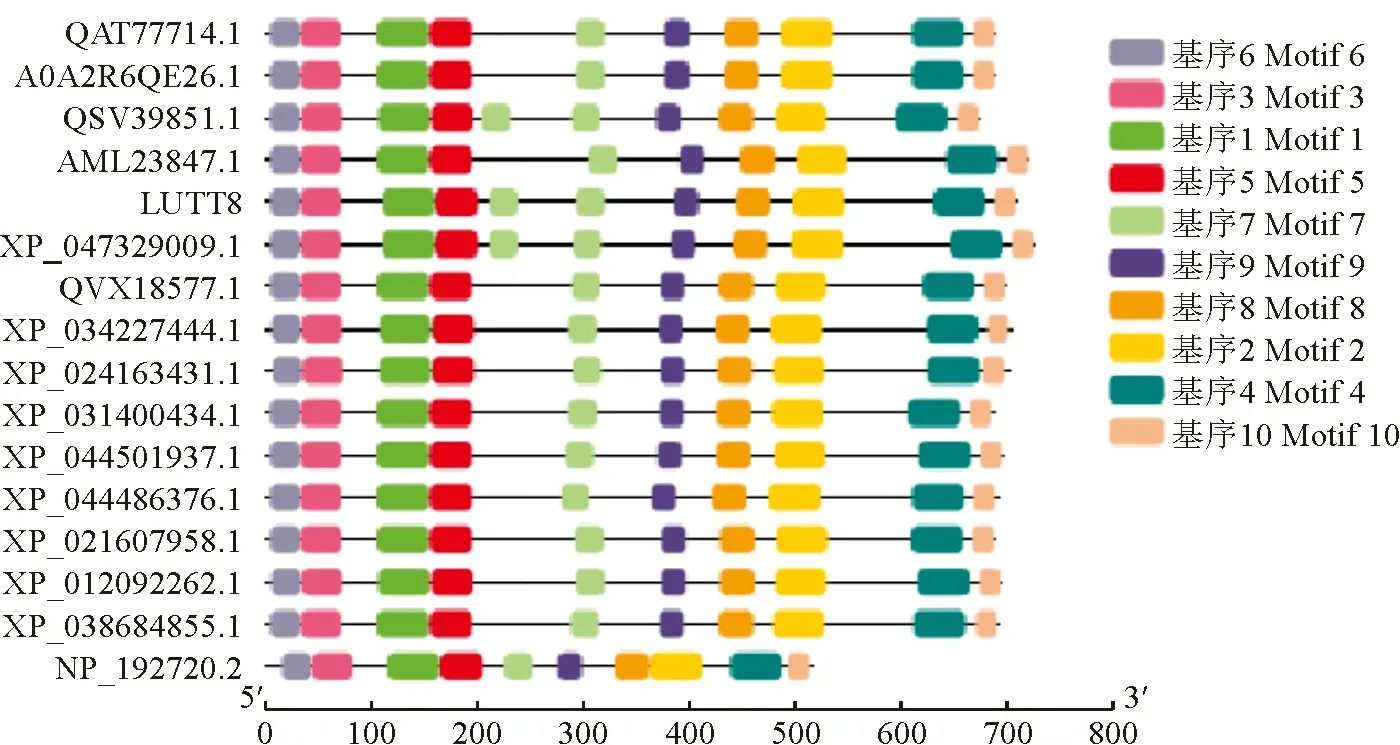
图7 IuTT8及其同源氨基酸序列的motif预测Fig.7 Motif prediction of IuTT8 and its homologous amino acid sequence
2.4 IuTT8蛋白序列比对与系统进化分析
以BLAST和DNAMAN等对滇水金凤IuTT8进行氨基酸序列比对分析,结果表明其与同属植物喜马拉雅凤仙花的相似性最高(86.34%),与其他植物也具有较高的相似性,约60%,如猕猴桃科的中国猕猴桃(Actinidiachinensis,QAT77714.1)等。此外,IuTT8具有bHLH家族典型的Basic-HelixⅠ-Loop-HelixⅡ保守结构域,该结构域包含DNA结合位点和二聚体区域,并且源自不同物种的TT8氨基酸序列在该区域的保守性高(图8)。运用NJ(neighbor-joining)法,Bootstrap值设为1 000,以JTT+G模型构建IuTT8及其同源氨基酸序列的系统发育树,发现IuTT8与同属植物喜马拉雅凤仙花的聚为一支,同时与杜鹃花目的柿(Diospyroskaki)、猕猴桃(Actinidiachinensisvar.chinensis)、山茶(Camelliasinensisvar.assamica)等植物的同源蛋白聚成大支(图9)。

划线部分为Basic-HelixⅠ-Loop-HelixⅡ保守结构域。图8 滇水金凤IuTT8蛋白的同源氨基酸序列比对The lined sections are Basic-HelixⅠ-Loop-HelixⅡ conservative domains.Fig.8 Alignment analysis of homologous amino acid sequence of IuTT8 protein in I. uliginosa
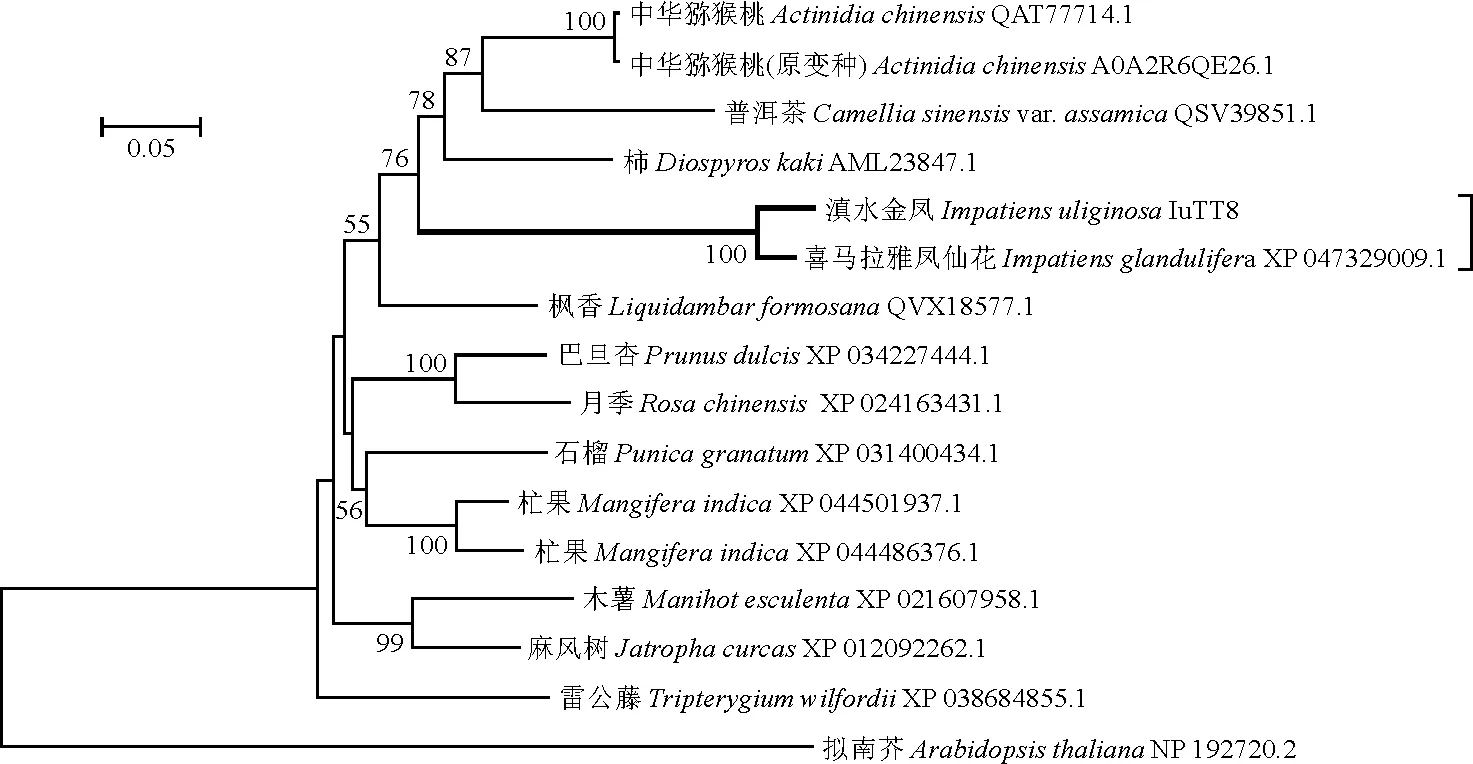
图9 IuTT8及其同源氨基酸序列的系统发育树(NJ法)Fig.9 Phylogenetic tree of IuTT8 and its homologous amino acid sequence(NJ method)
2.5 IuTT8基因的表达分析
IuTT8基因的表达特性分析见图10,分析发现IuTT8在深红色花中的表达量要显著高于其他花色,其次是红色、粉色和白色滇水金凤。IuTT8基因在白色花中的表达量无显著变化;在粉色、红色和深红色滇水金凤中IuTT8基因的表达量先上升,并在S3时期升到了最高,与其他3个花发育时期差异显著,而后减少,其中以深红色S3阶段表达量最高。随着滇水金凤花发育的进行,IuTT8基因的表达量在除白色外的滇水金凤中均呈先升后降的趋势,且IuTT8基因的表达量随着滇水金凤花色的加深而增加,红色和深红色S3的表达量分别约为白色S2阶段的14,48倍,这在一定程度上表明滇水金凤的花色与IuTT8基因的表达量呈正相关(图10)。
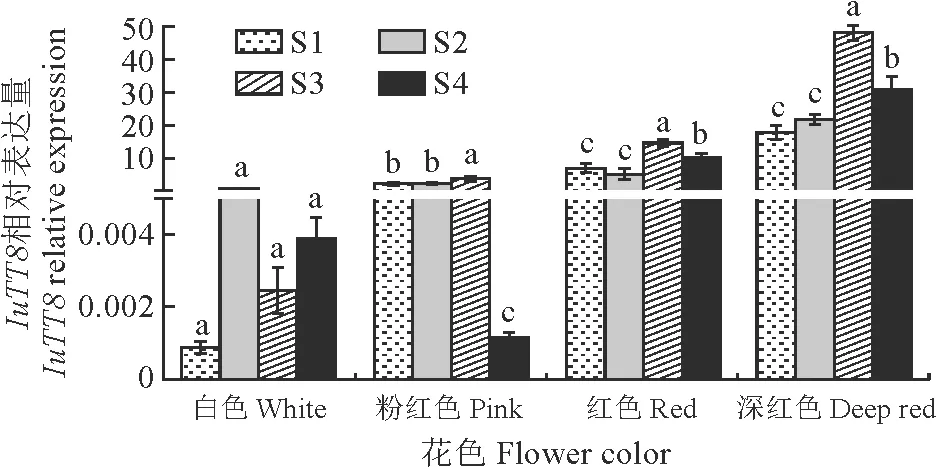
S1.花苞期;S2.始花期;S3.盛花期;S4.谢花期。不同小写字母表示时期之间差异显著(P<0.05)。图10 滇水金凤4种花色及其4个花发育时期中IuTT8基因的表达特性分析S1. Bud stage; S2. Beginning flowering stage; S3. Blooming stage;S4. Withering stage. Different lowercase letters indicate significant difference among stages (P<0.05).Fig.10 Analysis of the expression characteristics of IuTT8 during the four flower development periods and the four color variations of I. uliginosa
3 讨 论
bHLH转录因子主要参与植物的类黄酮、生物碱、萜类化合物及其他生物代谢合成的调控[18-20]。IuTT8基因gDNA为3 938 bp,含有6个内含子,拟南芥和甘蓝型油菜(Brassicanapus)中的TT8基因gDNA长度分别为4 643 bp和2 949 bp,并且都具备6个内含子[21];拟南芥的第5个内含子长达1 684 bp,但甘蓝型油菜的第5内含子仅为252 bp,其最长的第2内含子也只有399 bp;滇水金凤的第5内含子长93 bp,其最长的第2内含子长802 bp,这说明不同植物其TT8基因的内含子进化程度可能不同。
IuTT8蛋白具有与其他物种TT8类似的bHLH家族所特有的结构域,包括位于N末端可以与DNA活性位点结合的保守结构功能域,以及位于C末端的HLH保守区域,猕猴桃(Actinidiachinensiscv. ‘Hongyang’)[22]和扁桃(Prunusdulciscv. ‘Texas’)[23]等TT8蛋白均包括这个功能保守结构域,推测IuTT8蛋白属于bHLH家族。通过不同物种TT8蛋白Motif基序预测发现,IuTT8具有与其他物种相似的基序,这进一步证明本研究所克隆片段为滇水金凤中的TT8基因。bHLH的C端可形成同型或异型二聚体,但是IuTT8在滇水金凤中是以同源还是异源二聚体的形式发挥作用还有待进一步的验证,IuTT8是否与MYB和WD40蛋白存在相互作用也需要进一步研究。系统进化树结果显示IuTT8与同属植物喜马拉雅凤仙花的亲缘关系最近,聚在一支,这与相似性分析的结果一致。与其聚在同一支的AcbHLH42可以调节中华猕猴桃内果皮中花青素的生物合成,其主要通过AcMYB123和AcbHLH42的共表达激活AcF3GT1和AcANS或同源基因的转录,进而调控花青素的合成[21];滇水金凤IuTT8基因可能与之具有相似的功能,在花青素合成中起作用。另有研究表明双子叶植物花青素合成过程中的早期结构基因是由MYB基因控制的,晚期结构基因是由MBW复合物控制的,如在过表达紫花椰菜(Purplecauliflower)BoTT8基因的烟草花器官中只有晚期结构基因表现出上调[24];拟南芥AtTT8基因也可以控制花青素代谢途径中晚期结构基因的表达[25];在滇水金凤中TT8基因是否存在通过调控晚期结构基因的表达进而影响花青素合成的机制,还需要进一步验证。
对4种花色及4个时期滇水金凤花器官中的IuTT8基因进行qRT-PCR分析发现,IuTT8的表达量随着滇水金凤花色的加深而逐渐升高,且随着花发育时期的进行呈先升后降的趋势,推测IuTT8基因与滇水金凤花色的正调控相关,在滇水金凤花青素合成中发挥重要作用,但还需要进行更深入的研究,以了解IuTT8基因在滇水金凤中的具体功能和调控机制。
4 结 论
该研究从滇水金凤中克隆了bHLH家族的转录因子IuTT8,并分析了其在不同花色中的表达规律,初步验证了IuTT8的表达量与花色呈正相关,在滇水金凤花色的形成中发挥重要作用,但是否与其他蛋白存在相互作用以及是否能够对晚期结构基因进行调节还需要深入研究。

