PASP及RVAW联合血清肌酐在COPD-PH预后中的价值
李 慧 白晓青 杨 静 耑 冰
(宁夏回族自治区人民医院呼吸内科,宁夏 银川,750000)
慢性阻塞性肺疾病(COPD)是最常见的气道疾病。由于其全球发病率的增加,已演变为一个主要的健康问题,严重影响患者的生活质量,给患者和社会带来了极大的负担。肺动脉高压(PH)是COPD最常见的并发症之一。据报道,COPD患者中PH的患病率估计为18%~50%[1]。PH是由多种病因引起、多种机制参与的肺血管结构或功能改变,可导致肺血管阻力或肺动脉压力升高,造成右心室超负荷和右心衰竭,最终甚至死亡。COPD继发的PH属于第3大类肺动脉高压,是临床工作中最常见的类型,研究发现PH与临床症状加重、运动能力下降和住院频繁有关,是COPD不良预后的指标。
PH的临床症状缺乏特异性,经右心导管检查(RHC)是诊断的金标准,但因其有创性及花费较多,难以在临床普遍开展。超声心动图作为PH首选的无创性检查,研究显示晚期肺部疾病经超声心动图测得肺动脉压力值与RHC测得的具有良好相关性,可对PH的诊断筛查及预后判断。经胸超声心动图能够反映PH严重程度和提示预后[2-3],但研究关注到右室壁厚度与COPD-PH的预后相关性较少。血清肌酐(SCr)的测量是简单实用,在临床上很容易获得,却在PH预后相关研究中较少见。
本研究收集了伴有PH的COPD患者的临床资料,出院后1年随访患者生存状态,分析实验室资料、心脏彩超参数等指标与死亡的关系,来研究这些指标是否可以成为死亡高风险人群的预测因子。
1 资料与方法
1.1 一般资料
本研究回顾性分析了2021年1月—2021年6月在宁夏回族自治区人民医院住院的有PH的COPD患者,共纳入85例患者资料,期间多次住院者取第一次住院资料。根据患者1年后(2022年6月截止)电话随访的预后结果分为死亡组和存活组。死亡组患者26例(30.59%),存活组患者59例(69.41%)。两组患者间年龄、性别、吸烟等一般资料比较,差异无统计学意义(P<0.05),具有可比性,见表1。所有患者对本研究知情同意并签署知情同意书,本研究经宁夏回族自治区人民医院伦理委员会审批。
1.2 纳入与排除标准
纳入标准:①确诊COPD-PH:COPD诊断符合《慢性阻塞性肺疾病诊治指南》[4];经超声心动图筛查存在PH。②资料完善。
排除标准:①有其他慢性呼吸系统疾病,包括支气管扩张、活动性肺结核、肺癌、肺间质纤维化、支气管哮喘、气胸等;②合并有恶性肿瘤、血液、免疫系统疾病;③严重的肝肾功能不全;④左心衰竭患者[射血分数(EF)<50%];急性心脑血管疾病;⑤其他原因如慢性肺血栓栓塞、动脉性肺动脉高压等所致的肺动脉高压。
1.3 方法
通过电子病案系统收集病例的一般资料包括年龄、性别、并发症、身高、体质量及吸烟史等,以及实验室资料包括血常规、肝功能、肾功能、凝血功能、血气分析等,采用的是入院首次的血化验指标。
超声心动图检查采用Philips IE33彩色多普勒超声诊断设备,S5-1探头,探头频率2.0~3.5 MHz。嘱检查者左侧卧位,平静呼吸,由心脏彩超室专业医生测量左室射血分数(LVEF),三尖瓣最大反流速度(TVR),右室前壁厚度(RVAW)和右心室前后径。肺动脉收缩压(PASP)是根据三尖瓣返流频谱峰值速度估测。PASP>35 mm Hg定义为有PH。
1.4 统计学分析
采用SPSS 25.0统计学软件进行数据分析。计量资料如符合正态分布,使用()表示,两组间比较使用独立样本t检验;如不符合正态分布,使用[M(Q1,Q3)]表示,组间比较使用秩和检验;计数资料使用[n(%)]表示,组间比较用χ2检验。使用Logistic回归分析,探讨COPD-PH预后的危险因素;绘制受试者操作特征(ROC)曲线,使用z检验比较各曲线下面积(AUC),评价各因素单独及联合预测COPD-PH预后的价值,P<0.05为差异有统计学意义。
2 结果
2.1 死亡组和存活组的心脏彩超资料比较
死亡组的PASP、RVAW、右室前后径明显高于存活组,差异有统计学意义(P<0.05);两组患者EF比较,差异无统计学意义(P>0.05),见表2。
表2 死亡组和存活组的心脏彩超资料比较 [M(Q1,Q3)/()]

表2 死亡组和存活组的心脏彩超资料比较 [M(Q1,Q3)/()]
注:PASP,肺动脉收缩压;EF值,射血分数;RVAW,右室前壁厚度;RV-ap,右室前后径。
项目死亡组(n=26)存活组(n=59)t/zP肺动脉收缩压(mm Hg)65.00(48.25,85.25)40.20(36.95,53.33)-4.164<0.001射血分数(%)63.77±3.0063.53±2.94 0.351 0.726右室前壁厚度(mm)4.10(3.80,6.70)3.80(3.60,4.00)-3.465 0.001右室前后径(mm)24.90(18.60,29.80)20.30(19.00,22.9)-3.048 0.002
2.2 死亡组和存活组的实验室资料比较
死亡组患者动脉血pH值、动脉血PO2、白蛋白水平低于存活组,差异有统计学意义(P<0.05);死亡组患者RDWCV、RDW-SD、肌酐、尿素氮、纤维蛋白原降解产物、D-二聚体均高于存活组,差异有统计学意义(P<0.05)。而两组患者动脉血PCO2、中性粒细胞百分比(NEUT%)、血红蛋白、血小板、CRP、红细胞沉降率、ALT、AST、尿酸比较,差异均无统计学意义(P>0.05),见表3。
表3 死亡组和存活组的实验室资料比较 [M(Q1,Q3)/()]

表3 死亡组和存活组的实验室资料比较 [M(Q1,Q3)/()]
注:NEUT%,中性粒细胞百分比;HB,血红蛋白;PLT,血小板;CRP,C反应蛋白;ESR,红细胞沉降率;ALT,谷丙转氨酶;AST,谷草转氨酶;ALB,白蛋白;UA,尿酸;Scr,肌酐;BUN,尿素氮;FDP,纤维蛋白原降解产物;D-D,D二聚体。
实验室资料死亡组(n=26)存活组(n=59)t/zP pH值7.40(7.36,7.43)7.43(7.41,7.46)-3.2950.001 PO2(mm Hg)56.00(48.00,66.00)66.00(55.50,79.50)-2.3470.019 PCO2(mm Hg)46.00(36.00,55.00)42.00(37.50,49.50)-0.8380.402 NEUT%(%)70.70(57.00,82.50)73.50(63.00,78.95)-0.1430.886 HB(g/L)155.79±34.49154.10±24.61 0.2570.798 RDW-CV(%)13.80(13.30,15.60)13.25(12.38,14.33)-3.4400.001 RDW-SD(fL)49.00(45.00,53.10)44.45(42.00,49.78)-3.1190.002 PLT(109/L)166.00(106.00,197.00)185.50(150.75,218.00)-1.2400.215 CRP(mg/L)8.36(2.93,18.73)7.24(2.07,33.41)-0.0050.996 ESR(mm/h)5.00(2.00,24.00)9.00(2.00,36.00)-0.7820.434 ALT(U/L)15.00(12.00,24.75)17.00(11.80,26.25)-0.7350.462 AST(U/L)22.50(18.25,27.90)20.00(16.40,26.23)-0.8590.390 ALB(g/L)35.63±3.9337.59±3.72-2.1620.034 UA(μmmol/L)381.38±165.18329.37±113.28 1.6620.100 Scr(μmmol/L)76.50(65.25,93.25)66.00(56.00,72.00)-2.7760.006 BUN(mmol/L)8.91(6.03,12.77)6.19(5.13,7.87)-2.8190.005 FDP (μg/mL)2.76(1.71,6.58)1.49(1.148,2.75)-2.4580.014 D-D(μg/mL)0.27(0.15,0.71)0.19(0.10,0.29)-2.3370.019
2.3 COPD-PH发生死亡的危险因素分析
单因素二元logistic回归分析提示,身体质量指数、肺动脉收缩压、右室前壁厚度、右室前后径、RDW-SD、白蛋白、肌酐、尿素氮、纤维蛋白原降解产物为COPD-PH发生死亡的危险因素。多因素二元logistic回归分析提示,在校正身体质量指数、右室前后径、RDW-SD、白蛋白、尿素氮、纤维蛋白原降解产物、D-二聚体后,肺动脉收缩压升高(OR=1.055,95%CI 1.011~1.100,P=0.013) ,右室前壁增厚(OR=2.321,95%CI 1.138~4.732,P=0.021),肌酐增多(OR=1.051, 95%CI 1.017~1.086,P=0.003)是COPD-PH死亡的独立危险因素,见表4。
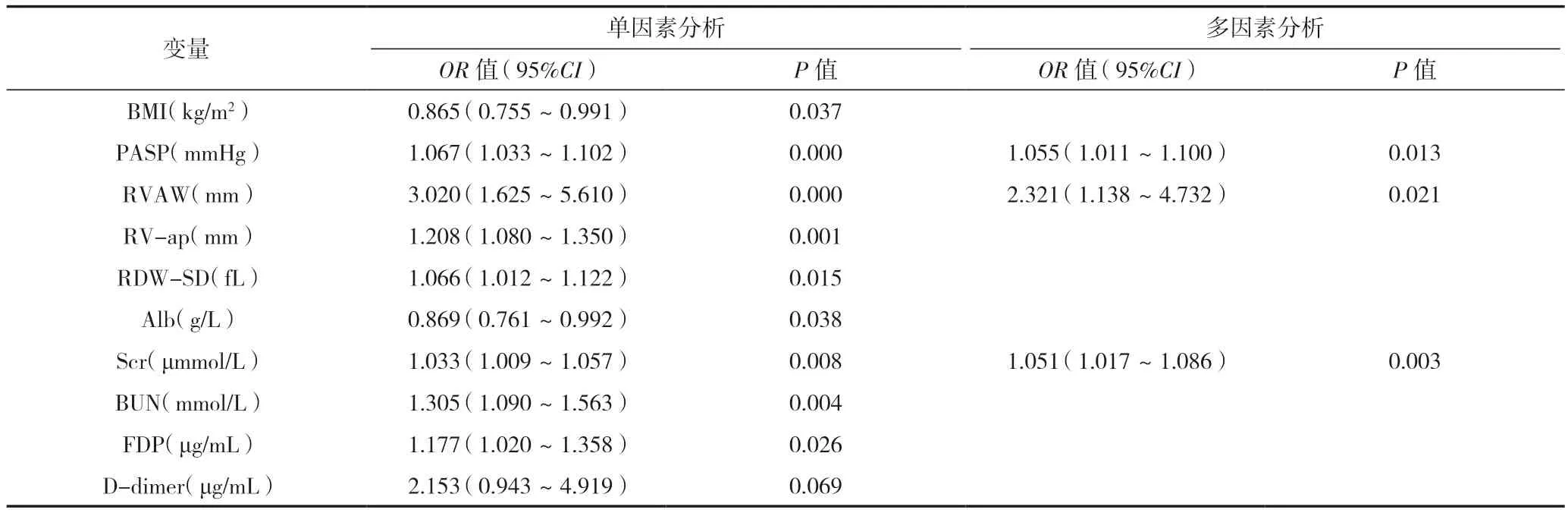
表4 COPD-PH的死亡的危险因素(Logistic回归分析)

表5 分析比较各危险因素单独及联合预测COPD-PH的死亡
2.4 采用受试者操作特征(ROC)曲线分析评价多因素Logistic回归模型中各参数对预后的诊断效果
统计学诊断性能最高的参数是P ASP+RVAW+Scr,AUC=0.858(95%CI 0.762~0.954,P<0.01),最大约登指数0.610,敏感度=80.0%,特异度=81.0%,具有一定诊断价值,见图1)。

图1 ROC曲线分析PASP、RVAW及Scr对于COPD-PH死亡的预测价值
3 讨论
本研究评估了 PASP、RVAW和肌酐在COPD-PH预后中的价值。本研究发现,死亡组患者的PASP、RVAW和肌酐水平高于存活组;并且PASP、RVAW和肌酐是COPD-PH死亡的独立危险因素。
肺部疾病,特别是COPD,是世界各地肺动脉高压的其中一个主要原因。由于与潜在肺部疾病的症状有明显重叠,PH的诊断常常被推迟;随着病情加重,可出现PH及右心衰竭的征象。合并肺动脉高压会加重右心功能衰竭、COPD急性加重的风险,更容易导致预后不良。研究发现,即使调整了其他已知的影响预后的变量,如肺功能、血气或年龄,COPD-PH患者的病死率约为正常肺动脉压患者的两倍。导致引起慢性肺部疾病的肺动脉高压的机制可能是多因素的,包括低氧肺血管收缩、肺血管重构、炎症介质及基因多态性等均有参与[5]。
超声心动图测定的参数对肺高压疾病的诊治中是非常有价值的,包括PASP、 右心室舒张末期横径(RVEDTD)和三尖瓣环收缩期位移(TAPSE),来预测严重COPD-PH患者的预后[6];RVAW也被证实为急性高危肺栓塞的独立预测因子[7];长期以来,右心体系概念,尤其是右心功能,在肺高压研究领域中发挥重要价值[8]。右心室功能障碍通常被认为和PH的预后有关,而PASP又是右心室功能障碍评估的核心。既往研究发现,PASP升高被证明与全因死亡率有关[9],即使是中度的PH也会增加COPD的病死率[10]。本研究结果与文献报道一致,PASP升高是COPD-PH死亡的独立危险因素。右心室游离壁及肺动脉压力作为维护正常右心结构、功能的重要构成部分,却很少有研究关注到RVAW在肺高压疾病预后中的价值。本研究中死亡组的PASP、RVAW及右室前后径均高于存活组,差异有统计学意义(P<0.05),表明死亡患者右心室后负荷较大,伴随右心室形态及大小改变。如同拉普拉斯定律,当血管负荷增加,右心室会发生肥厚以降低室壁应力。有动物实验观察到随肺动脉压力上升,心室肌细胞体积增大,导致右心室壁增厚、右心室扩大[11]。
肾功能不全是心血管疾病发病率和病死率的一个有效和独立的预测指标。理论上肌酐预测PH死亡是成立的,肌酐反映的是肾脏灌注功能受损,这又是肺高压疾病出现右心衰竭的常见后果。一项随访20年的大型队列研究显示肾功能不全会引起血流动力学特征显著异常,是肺动脉高压死亡风险增加的独立预测因子[12]。本研究结果也同样显示死亡患者的血肌酐较高,是死亡的独立的危险因素,为肺高压死亡的预判提供了一种简便无创的预测方法。BUN也是早期反映肾脏损伤的指标之一,也有研究提出BUN可能是PH的一个新的潜在预后预测因子[13]。PH患者较高的BUN水平与较高的住院病死率、90 d 病死率和4年病死率以及较低的4年生存率相关。BUN可作为PH住院、90 d和4年病死率的独立预测因子。我们也发现了类似的相关关系,死亡组的BUN较高,也是死亡的危险因素。虽然BUN和Scr都和死亡有关,但最终只有Scr是死亡的独立危险因素,说明Scr比BUN更重要。研究报道尿酸升高会使得肺动脉高压恶化[14],并且可以提供患者预后的信息[15],在本研究中死亡组的血尿酸水平高于存活组,差异无统计学意义(P>0.05)。
红细胞分布宽度(RDW)是评价循环红细胞体积变异性的一个参数。既往认为它在心血管及呼吸系统临床预后评估中是一个有意义的指标[16],近年来越来越多的研究关注到RDW和PH的相关性,认为RDW与PAH呈显著正相关[17],RDW是预测COPD-PH的一个有价值的生物标记物[18]。本研究中发现死亡组的RDW均高于存活组,并且经过回归分析显示是死亡的危险因素,这与既往研究一致。
目前可用的治疗PH的药物尚未发现对COPD-PH的治疗有效,治疗的关键第一步是优化肺部基础疾病治疗[10],推荐长程氧疗,不推荐常规给靶向药物治疗。因此,对COPDPH进行危险分层就非常重要,对于有不良预后的高危人群应强化原发病治疗及随访观察。本研究通过Logistic回归分析显示PASP,RVAW及Scr是COPD-PH死亡的独立危险因素,利用ROC曲线分析三者单独预测COPD-PH死亡的AUC>0.5,具有一定准确性;三者联合的AUC(0.858)最接近于1,提示能够较好地识别具有死亡风险的COPD-PH患者。
本研究的局限性:①本研究纳入的样本量较小,仍需要大规模的研究去证实我们的发现;②纳入的患者均处于COPD急性加重期,而未收集稳定期的COPD患者的资料,可能对试验结果产生影响。
综上所述,PASP及RVAW联合Scr在识别具有死亡风险的COPD-PH患者中具有预测价值,可为临床工作提供参考。

