食管鳞状上皮内瘤变内镜黏膜下剥离术后病理升级的危险因素分析*
饶星宇 蒲柯 崔逵 莫琳 蹇顺海 杨国栋
食管癌是世界范围内第八大常见肿瘤,具有预后不良、复发率及死亡率高等特点,其全球发病率居于第7 位,死亡率在所有恶性肿瘤中居于第6 位[1]。食管癌主要类型为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺癌(esophageal adenocarcinoma,EAC),在中国以ESCC 为主[2]。食管鳞状上皮内瘤变是癌前病变,其致癌作用通常是从低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN)至高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN),再到早期食管癌,最后至进展期食管癌分段逐步发展的过程[3]。对于HGIN,根据目前指南[4]建议均行内镜下治疗,而对于LGIN,治疗策略仍存在争议,指南推荐随访或内镜下治疗。内镜下钳夹活检术(endoscopic forceps biopsy,EFB)是诊断食管黏膜病变的金标准,但在临床工作中,其评估准确性受多种因素影响,术前EFB 与内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)术后病理结果存在差异,如出现病理升级、降级等现象。食管癌患者的生存时间与其临床分期密切相关,在积极接受治疗后5 年生存率可达95%[5]。因此,有效识别食管鳞状上皮内瘤变易发生病理升级的高危患者、提高术前EFB 的准确性非常有必要。本研究旨在探讨术前EFB提示食管鳞状上皮内瘤变ESD 术后易发生病理升级的危险因素,为临床干预提供有价值的指导意见。
1 材料与方法
1.1 临床资料
回顾性分析2019 年11 月至2023 年5 月就诊于川北医学院附属医院经内镜及病理诊断为食管鳞状上皮内瘤变并行ESD 手术的255 例患者的临床资料(共收集255 处病灶),包括年龄、性别、吸烟史、饮酒史、病变累及管腔范围、病灶纵向直径、病变部位(按照第八版食管癌TNM 分期标准)[6]、有无白苔样变、上皮乳头内毛细血管袢(intrapapillary capillary loop,IPCL)分型、大体分型、是否伴有糜烂、溃疡或出血和黏膜色泽改变、有无粉色征、活检块数、术前EFB 与术后病理等,内镜下大体分型依据巴黎分型标准,IPCL 分型参照日本食管学会AB 分型[7]。
1.2 方法
纳入标准:1)术前均行全面的影像学检查排除周围淋巴结及远处转移情况;2)术前EFB 诊断为食管LGIN 或HGIN,并接受ESD 手术;3)术前通过白光内镜、放大内镜联合窄带成像技术(magnifying endoscopy with narrow-band imaging,ME-NBI);4)所需临床资料完整;5)患者均无严重基础疾病。
排除标准:1)缺乏临床资料;2)术后病理提示食管腺癌、乳头状瘤、梭形细胞癌等;3)合并有其他肿瘤病史。本研究获得本院伦理委员会批准(审批号:2023ER343-1),由于研究的回顾性质,获得免除患者知情同意要求。
内镜检查:由本院高年资内镜医师使用普通白光内镜或ME-NBI 对病灶进行观察并予以活检。参照第八版食管TNM 分期标准[6]将食管从上颌中切牙至肿瘤中心的距离进行分段。1)颈段食管:上颌中切牙至肿瘤中心距离15~19 cm;2)胸上段食管:上颌中切牙至肿瘤中心距离20~24 cm;3)胸中段食管:上颌中切牙至肿瘤中心距离25~29 cm;4)胸下段食管:上颌中切牙至肿瘤中心距离30~40 cm。巴黎分型标准[7]将病变形态分为隆起型、平坦型、凹陷型。
组织病理评估:食管鳞状上皮内瘤变ESD 术后病理升级病例(图1)。术前EFB 与术后病理诊断均由本院2 名年资高于10 年的病理科医师独立完成。如出现不一致的结果,将与第3 名高年资病理科医师对标本进行重新阅片商讨后确定诊断。采用WHO 组织学分型最新分类标准[8]。并将术前EFB 诊断为LGIN,术后病理诊断为HGIN 和ESCC;术前EFB 诊断为HGIN,术后病理诊断ESCC 分为病理升级组、病理未升级组,比较2 组的临床特征及内镜表现,分析影响差异的因素。所有病理标本均为整块切除,如标本基底(垂直)切缘或任一侧切缘显微镜下发现异型细胞(LGIN、HGIN 细胞或癌细胞)残留,则为切缘阳性(不完全切除)[9]。
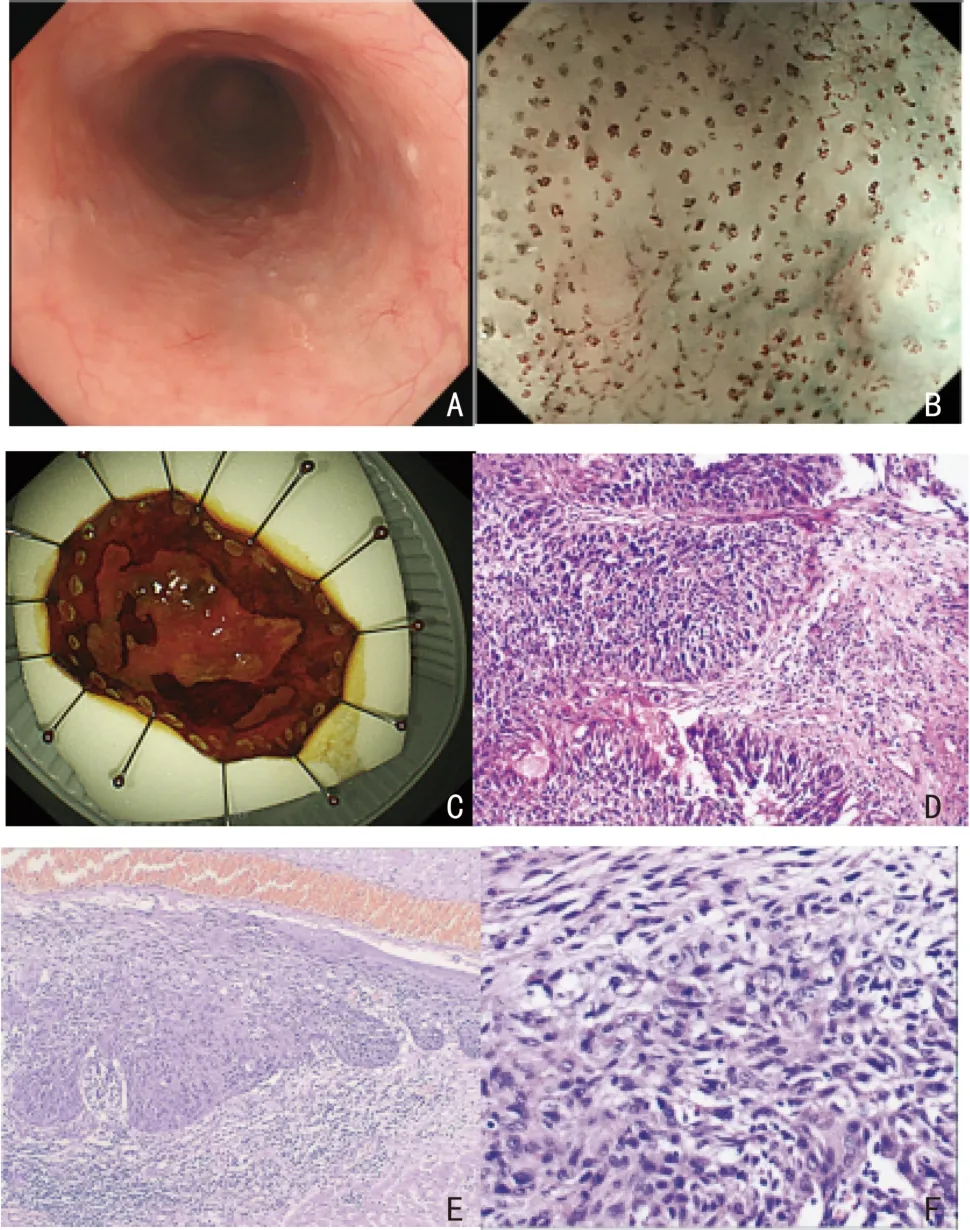
图1 1 例典型病例显示术前EFB 和ESD 术后标本之间的组织病理学差异
1.3 统计学分析
采用SPSS 25.0 软件进行统计学分析。计数资料以处(%)表示,行x2检验或Fisher 概率确切法。采用单因素分析对纳入的变量进行筛选,将筛选后P<0.05 的变量纳入多因素分析,多因素分析采用二元Logistic 回归分析,所纳入的变量记录OR 值及95%CI,以P<0.05 为差异具有统计学意义。
2 结果
2.1 患者一般情况及病理结果
共纳入的255 处病灶中病理升级123 处,未升级132 处;男性占60.4%(154/255),女性占39.6%(101/255)。男女比例为1.52(154:101),年龄28~84 岁,平均年龄(65.45±7.98)岁。LGIN 组术前EFB与ESD 术后病理一致率为42.9%(18/42);45.2%(19/42)升级为HGIN;11.9%(5/42)升级为ESCC,总升级率为57.1%(24/42)。HGIN 组中44.1%(94/213)术后病理仍为HGIN,46.0%(98/213)升级为ESCC,9.9%(21/213)病理降级为LGIN(表1)。

表1 术前EFB 与ESD 术后的病理结果比较 处
2.2 病理升级的单因素分析
单因素分析提示饮酒史、IPCL 分型、糜烂、溃疡或出血、病变纵向直径≥2 cm、病变累及管腔范围≥1/2 的患者具有更高的病理升级风险(均P<0.05)。两组在性别、年龄、吸烟史、有无白苔、黏膜色泽改变、病变部位、粉色征和大体分型、活检块数方面进行比较,差异均无统计学意义(均P>0.05,表2)。
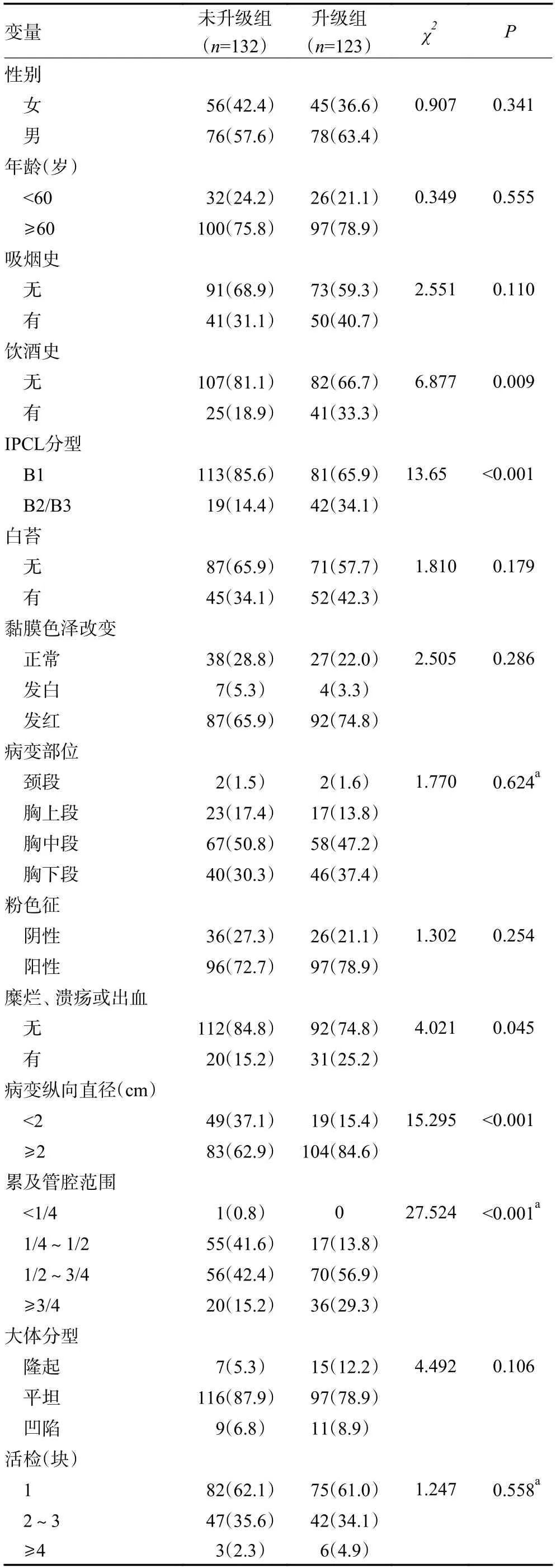
表2 术前EFB 示食管鳞状上皮内瘤变ESD 术后病理升级的单因素分析 处 (%)
2.3 病理升级的多因素分析
将单因素分析中P<0.05 的变量纳入多因素Logistic 回归分析,结果显示病变纵向直径≥2 cm、病变累及管腔范围≥1/2 和B2/B3 型IPCL 是食管鳞状上皮内瘤变ESD 术后病理升级的独立危险因素(表3)。
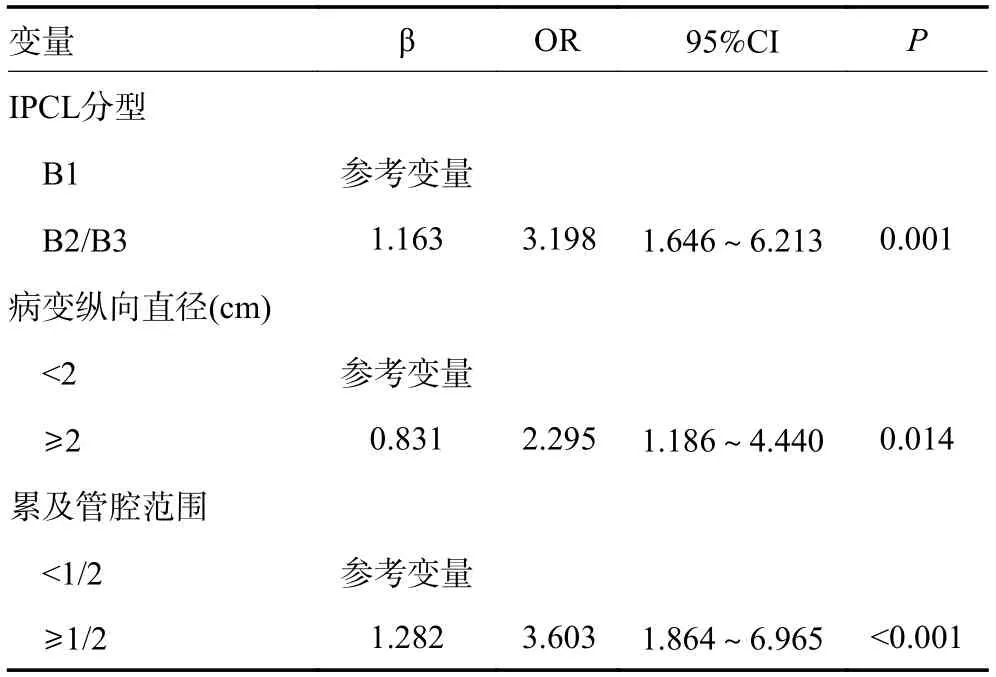
表3 术前EFB 显示食管鳞状上皮内瘤变ESD 术后病理升级的多因素分析
3 讨论
精准的术前病理诊断能为患者的治疗方案提供可靠依据。然而,近年来研究发现,术前EFB 与术后病理结果存在一定差异,其诊断结果符合率为42%~63%[10-13],病理升级率为43%[14],这为医生在临床选择干预时增加了困难。因此,本研究旨在探讨术前EFB提示食管鳞状上皮内瘤变ESD 术后病理升级的危险因素,为临床干预提供有价值的指导意见。
病灶直径较大者,其手术前后病理诊断也往往具有较高的病理学差异率[15]。研究指出,EFB 诊断上消化道上皮内瘤变且直径>2 cm 的病灶有33%~50%已发生癌变[16]。Lee 等[12]指出食管病灶直径≥2 cm 是术后病理升级的危险因素,认为病灶较大,活检仅取少量标本,不足以反映整体病灶的严重程度。Cho 等[17]认为食管病灶直径≥1 cm 是术后病理升级的危险因素。Cen 等[18]报道了食管病灶直径≥1.2 cm 是术后病理升级的危险因素。上述报道均表明病灶直径大小与病理升级存在相关性。本研究发现病灶直径≥2 cm 是术后病理升级的独立危险因素,与上述研究基本相符。然而,另有研究表明病变的直径大小与EFB 诊断的准确率无关[19],其研究结果的准确性还需要更多的样本进行证实。此外,本研究表明病变累及管腔范围≥1/2是ESD 术后病理升级的独立危险因素,这与Chen 等[20]研究结果基本相符。因此,推测病变累及管腔范围与病变直径存在一定的相关性。
研究显示,普通内镜对于癌前病变的漏诊率较高,所占比例约40%[21]。随着内镜技术的不断发展,MENBI 已广泛应用于临床。Chen 等[20]认为背景着色(background coloration,BC)是术后病理升级的独立危险因素,而IPCL 分型不是危险因素。本研究表明B2/B3 型IPCL 是术后病理升级的独立危险因素,且在较大病灶的升级病变中诊断较高。因此,推测病变大小与B 型IPCL 对影响危险因素的一致性有关,未来可针对病变大小与B 型IPCL 的相关性对病理升级风险的影响做出探索。B2 型IPCL 判断浸润深度的准确性较B1 和B3 型血管低[22]。这是由于B2 型IPCL 病变广泛,介于黏膜内及黏膜下之间,且在临床实践中容易受病变周围炎症影响,将非成袢的炎性血管B2i 误认是B2 型血管,从而影响活检标本选取,降低活检精确度。因此,建议对于ME-NBI 观察为B2/B3型IPCL,但活检未确诊为HGIN 或ESCC 的患者,仍应尽快接受重复活检或内镜下治疗。
食管癌变可能以点状癌灶的形式存在,Jeon 等[23]提出大钳活检并不能增加准确率,但可通过增加活检块数来提高诊断的准确率。据报道,多次活检与ESD术后病理一致率为70.4%[24]。另有多项研究[25-26]发现活检块数与术后病理升级无显著性相关,这与本研究结果一致(P=0.558),但仍需更多样本进行验证。目前对于增加活检块数是否可以提高准确率尚无统一定论,但多块活检可改变病灶局部微环境,尤其是浅表的小病变,可诱导黏膜下纤维化,增加内镜下治疗难度。因此,精准活检对提高诊断准确率及后续内镜下治疗至关重要。
本研究结果显示,LGIN 组中,术后病理升级24 处;HGIN 组中,术后病理升级98 处。分析病理升级原因:1)该病灶可能为点状癌灶或炎症、增生及瘤变的混合病灶,而钳夹病灶较小,且只能代表活检部位的病理情况,无法代表整个病灶;2)活检通常只能钳夹到病灶黏膜层及固有层,很少到达黏膜肌层。目前,如何提高活检取材的准确性,降低手术前后病理结果差异率是临床医生关注的焦点。因此,在临床工作中使用白光内镜的基础上可联合超声内镜、ME-NBI 及卢戈液染色技术以提高活检准确率。可通过超声内镜观察食管壁结构,判断出病变进展的部分,染色内镜使碘染后的食管癌及癌前病变呈现不染色或浅染区[27],更清楚地显示病变范围及微小病灶,用于指导内镜靶向活检,尽可能减少活检取材位置的偏差,提高内镜下活检取材的准确性。除此之外,活检时应避开破溃、坏死部分,如溃疡病变可选取边缘组织;取材要有一定深度,达黏膜肌层为佳;同一活检区域部位先取低位,避免取高位后出血影响后续取材。
在研究过程中,21 处术前EFB 诊断HGIN 而ESD 术后病理降级的情况,可能因部分病灶为点状癌灶或病变部分占比较小,活检时已将病灶钳除,达到治疗的目的,除此之外,EFB 与ESD 手术的时序差异以及期间药物的应用,可能使病变出现病理逆转[28]。本研究中,共切除病灶255 处,完整切除率为96.08%,15 处切缘阳性,2 处病灶水平切缘HGIN,其中1 处脉管浸润;1 处垂直切缘有癌组织累及,转外科行手术治疗。其余12 处切缘均为LGIN,内镜下随访,未追加外科手术。
综上所述,对于内镜下提示B2/B3 型IPCL、病变纵向直径≥2 cm、病变累及管腔范围≥1/2 的病灶,临床医生应高度警惕病灶病变程度被低估的可能性。当进行活检时,可通过联合超声内镜、染色内镜等技术用于指导活检的具体部位及范围,尽可能减少活检取材位置的偏差,提高内镜下活检取材的准确性。本研究为回顾性研究,存在一定的选择偏倚,结论有待多中心、更大样本量、前瞻性研究加以证实。
本文无影响其科学性与可信度的经济利益冲突。

