小鼠血浆中黄卡瓦胡椒素B 的HPLC-MS/MS 定量分析方法建立与药代动力学特征研究
吴启鑫赵小亮焦玥罗明珠王怡婷李晶哲王靖怡马琰岩李涛刘长振*
(1. 中国中医科学院医学实验中心,北京市中医药防治重大疾病基础研究重点实验室,北京 100700;2. 中国中医科学院中药研究所,北京 100700)
卡瓦胡椒(Piper methysticum)是一种原产于南太平洋地区的药食同源植物,属胡椒科,入药部位主要为根及根茎。 在当地,卡瓦胡椒作为一种失眠、焦虑和更年期症状的自然疗法,现临床多用于镇静催眠、抗痉挛、局部麻醉、抗真菌等方面[1-2]。近年,其相关制剂已作为非处方药或食品添加剂进入欧美国家,我国亦有相关报道[2]。 黄卡瓦胡椒素B(Flavokawain B,FKB)是从卡瓦胡椒中分离出来的一种天然甲氧基化查耳酮,具有抗炎[3-4]、抗癌[5-6]、镇痛[7]、抗血管生成[8-9]和免疫调节等多种治疗作用。 FKB 在治疗恶性肿瘤方面表现出色,尤其是胃癌、肺癌、前列腺癌和乳腺癌,其开发前景令人瞩目,引起了全球的广泛关注[5,10-14]。 另外,FKB 有潜在的肝毒性报道[9,15]。 但截至目前,对FKB 的体内过程了解尚不充分,为阐明FKB 的药代动力学特征,本研究利用高效液相色谱-质谱联用(HPLCMS/MS)建立血药浓度定量分析方法,并进一步比较了静脉给药、腹腔注射和灌胃给药后血浆中FKB的药代动力学特征和生物利用度数据,这将为FKB药理机制、安全性研究和进一步开发提供方法和数据支撑。
1 材料与方法
1.1 材料
1.1.1 实验动物
168 只SPF 级雄性KM 小鼠,7 ~8 周龄,体重(31.0 ± 1.5)g,购自北京华阜康生物科技股份有限公司【SCXK(京)2019-0008】。 在昼夜交替照明、恒温(23 ~ 25℃)、恒湿(49% ~ 51%)环境中喂养3 d,适应饲养环境,自由饮食饮水。 实验前禁食12~16 h,自由饮水。 所有动物饲养于中国中医科学院中医基础理论研究所【SYXK(京)2021-0017】,实验均经过中国中医科学院医学实验中心伦理委员会批准(ERCCACMS21-2106-08)。
1.1.2 主要试剂与仪器
木犀草素(批号:RDD-00702005014)、黄卡瓦胡椒素B(批号:RDD-H-02802301004)购于成都瑞芬思德丹生物科技有限公司,纯度均大于98%;二甲基亚砜(Sigma 公司,批号:103209528),羧甲基纤维素钠(国药集团,批号:20120330),Tween80(MCE 公司,批号:HYS000006634),PEG-300(MCE 公司,批号:HYW000084018);甲醇、乙腈(LC/MS 级,北京迪马公司),甲酸(LC/MS 级,美国Sigma 公司),甲酸铵(LC/MS 级,美国Sigma 公司),其他试剂均为分析纯。
Targin VX-Ⅲ多管涡旋振荡器(北京踏锦科技有限公司);Milli-Q Integral 5 超纯水制备仪(美国Millipore 公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);Rotanta 460R 高速冷冻离心机(德国Hettich 公司)。 HPLC-MS/MS 系统(美国AB Sciex 公司),包括ExionLC-20AC 高效液相色谱仪、Ion DriveTMTurbo V 离子源、Sciex6500+三重四极杆检测器、Analyst 1.7 数据采集系统和MutiQuant 3.0.3 数据处理系统等。
1.2 方法
1.2.1 药品配制
(1)尾静脉注射组和腹腔注射组:称取适量的FKB,加入所需药液体积的4%二甲基亚砜,充分振荡使药物完全溶解,再加入所需药液体积的40%PEG-300 和5% Tween80,最后加入剩余体积的生理盐水,振荡并超声处理60 s,配制成4 mg/mL、8 mg/mL、12 mg/mL 的FKB 溶液。
(2)灌胃组:称取适量的FKB,加入4%二甲基亚砜和5% Tween80,混合后溶于0.5%羧甲基纤维素钠,振荡并超处理声60 s,最终配制成40 mg/mL、80 mg/mL、120 mg/mL 的FKB 溶液。
1.2.2 动物实验
7 周龄雄性KM 小鼠,随机分成7 个组:(1)尾静脉注射组(i.v.20 mg/kg)、(2)低剂量腹腔注射组(i.p.20 mg/kg)、(3)中剂量腹腔注射组(i.p.40 mg/kg)、(4)高剂量腹腔注射组(i.p.60 mg/kg)、(5)低剂量灌胃组(i.g.200 mg/kg)、(6)中剂量灌胃组(i.g.400 mg/kg)、(7)高剂量灌胃组(i.g.600 mg/kg),每个组由24 只小鼠组成11 个取血时间点(每只小鼠3 个取血时间点),每个时间点平行6 只小鼠。 实验于小鼠给药后0、5、30 min 及1、2、4、6、8、12、16、24 h,于眼底静脉丛取血100 μL,迅速装入EDTA·Na2抗凝管中,在4℃4362 r/min 条件下离心15 min,弃沉淀,取上层血浆装于新Ep 管中,-80℃保存备用。
1.2.3 样品溶液配制
(1)对照品溶液配制:精密称取FKB 对照品约10 mg,倒入5 mL 容量瓶中,加入甲醇,超声5 min助溶,将溶液稀释至刻度,摇匀即得。 所配制贮备液浓度为2 mg/mL,逐级稀释后得到1.0、2.0、4.0、8.0、16.0、32.0、61.5、125.0、250.0、500.0、1000.0、2000.0 和4000.0 ng/mL 浓度的对照品系列溶液,置于-80℃保存备用。
(2)内标溶液配制:精密称取木犀草素对照品约10 mg,倒入5 mL 容量瓶中,后加入甲醇,超声5 min 助溶,将溶液稀释至刻度,摇匀即得内标母液,-80℃冰箱中备用。 临用前用甲醇将内标母液稀释成10 μg/mL 的内标溶液。
(3)质量控制(QC)样品的配制:取低、中、高3 个浓度的对照品溶液,加入一定量的空白血浆充分混合,摇匀即得低浓度质控(LQC,0.5 ng/mL)、中浓度质控(MQC,20 ng/mL)和高浓度质控(HQC,600 ng/mL)样品,置于-80℃条件下保存备用。
1.2.4 血浆样品的处理
血浆样品在室温下融化后,充分混匀,精密量取50 μL,置于0.6 mL 干净离心管中,精密加入10 μL 内标溶液和140 μL 乙腈,6000 r/min 涡旋混合5 min,4℃13 795 r/min 离心10 min,取上清液,4℃13 795 r/min 再次离心10 min,取上清待测。
1.2.5 HPLC-MS/MS 条件
(1)色谱条件:色谱柱为XSelect@HSS T3 色谱柱(2.5 μm,2.1 × 50 mm,美国Waters 公司);流动相为A(水,含0.1%甲酸) ∶B(乙腈-异丙醇[50 ∶50]),梯度洗脱程序如下:0 ~ 4.0 min,20% ~100% B;4.0 ~6.0 min,100% B ~100% B;6.0 ~6.1 min,100% B ~20% B;6.1 ~8.0 min,20% B~20% B。 柱温为35℃;样品室温度为4℃;流速为0.3 mL/min;进样量为2 μL。
(2)质谱条件:电喷雾离子源(ESI),气帘气(N2)为40 psi,碰撞气(N2)为9 psi,喷雾电压为+5500 V,雾化温度为550℃,雾化气(GS1,N2)和辅助气(GS2,N2)均为55 psi。 实验采用多反应监测(MRM)模式正离子扫描,FKB 和内标木犀草素离子对及相应的去簇电压、碰撞能量、保留时间等质谱参数见表1。

表1 黄卡瓦胡椒素B 和内标木犀草素优化后的液相色谱质谱参数Table 1 Optimized liquid chromatography-mass spectrometry parameters of Flavokawain B and internal standard luteolin
1.2.6 方法学的建立与验证
(1)选择性:随机取6 只小鼠空白血浆,除不加内标(等体积纯水替代)外,按“1.2.4”项下方法操作,进行HPLC-MS/MS 分析,并记录相应的色谱图。通过色谱图比较定量限(limit of quantification,LOQ)样品、小鼠空白血浆样品和小鼠给药后血浆样品,考察该方法的选择性。
(2)线性范围及定量限:取FKB 对照品系列溶液,分别随机加入小鼠空白血浆,得到0.2、0.4、0.8、1.6、3.2、6.1、12.5、25.0、50.0、100.0、200.0、400.0 和800.0 ng/mL 的模拟生物样品,同样按“1.2.4”项下方法操作,进行HPLC-MS/MS 分析。横坐标X 为血浆样品中待测物的浓度,纵坐标Y 为待测物与内标的峰面积比值,1/X 为权重系数,回归分析采用加权最小二乘法,最终得到各成分的标准曲线和线性范围。 各成分的LOQ 经信噪比S/N =10 计算,并以LOQ 作为标准曲线的最低浓度点。
(3)基质效应与提取回收率:取QC 和LOQ 样品,每一浓度配制6 份,按“1.2.4”项下方法操作,进样分析得到FKB 与内标的色谱峰面积比值A;取用纯水配制以上等浓度的样品,进样分析得到FKB与内标的色谱峰面积比值B;另随机取空白血浆,按“1.2.4”项下方法操作,上述相应等浓度的对照品和内标溶液分别加入于经提取的上清液中,进样分析后可得FKB 与内标的色谱峰面积比值C。A 与B 的比值即基质效应,A 与C 的比值即提取回收率。
(4)准确度与精密度:LOQ 样品和QC 样品1 d之内测定6 次,且连续3 d 检测,计算日内、日间精密度及准确度。
(5)残留:取定量上限样品,按“1.2.4”项下方法操作,然后进样空白样品;该循环连续操作3 次,之后统一分析各待测物的残留。
(6)稀释可靠性:配制6 份模拟生物样品,约10倍QC 样品浓度(6000 ng/mL),稀释到600 ng/mL(使用空白血浆稀释),如“1.2.4”的步骤操作,进样以分析,并计算稀释后样品的准确度及精密度。
(7)稳定性:配制3 份相同浓度的QC 样本,按“1.2.4”步骤操作,考察室温稳定性是通过室温放置0.5 h 和2 h;考察后期稳定性是通过4℃条件下放置12 h 和24 h;考察冻融稳定性是通过-80℃冻存,室温融化,重复3 次;考察长期稳定性是通过-80℃冻存1 个月。
取QC 样品,每一浓度配制3 份,并按“1.2.4”项下方法操作,在4℃放置12 h 和24 h,考察后期稳定性;在室温下放置0.5 h 和2 h,考察室温稳定性;经历3 次冻融(-80℃冻存,室温融化),考察冻融稳定性;在-80℃条件下冷冻1 个月,考察长期稳定性。
1.3 统计学分析
本实验使用MutiQuant(版本:3. 0. 3,美国AB Sciex 公司)处理数据,Origin Pro 2016(版本:b9. 3.226,美国OriginLab 公司)和ChemBioDraw Ultra(版本:14. 0,美国PerkinElmer 公司)绘图DAS 软件(版本:3.0,上海博佳医药)的非房室模型计算药代参数。 最大血药浓度(Cmax)和达峰时间(Tmax)均为实测值,采用梯形法计算时间浓度曲线下面积(AUC),使用AUC0-t和相应给药剂量进行多剂量线性关系分析。
2 结果
2.1 质谱分析
选择低分子质量模式下进行FKB 的质谱分析,结果正离子模式监测优于负离子模式,在正离子模式下FKB 主要生成[M +H]+峰。 对[M +H]+峰的主要碎片离子进行扫描分析,结果见图1。

图1 质谱碎片及可能的裂解过程Figure 1 Product ion spectra and chemical structures with the fragmentation pattern
选择丰度最高且稳定性好的离子对(285.1/181.1)作为定量离子对用于FKB 的定量分析,另外选择一对丰度高且稳定性好的离子对(285.1/131.1)作为定性离子对用于FKB 的确认。
由于FKB 尚无商业化的稳定同位素标记物可供使用,本实验选择的内标是黄酮类化合物木犀草素,在正离子模式下对木犀草素进行离子扫描和离子对优化,结果见图1。 在MRM 模式下,FKB 和内标木犀草素的各离子对的保留时间、碰撞能量和去簇电压等液相-质谱参数结果见表1。
2.2 方法学考察
2.2.1 残留效应
使用含高浓度FKB 的模拟生物样品(800 ng/mL)及内标,考察XSelect@HSS T3、XSelect@HSS PFP 等不同色谱柱的残留,结果XSelect@HSS T3 色谱柱残留最少;考察甲醇-水、乙腈-水、乙腈-异丙醇-水等不同洗脱体系下系统的残留,结果乙腈-异丙醇-水洗脱条件下残留最少,结果见图2。 因此使用XSelect@HSS T3 色谱柱以乙腈-异丙醇-水为洗脱相来进行方法学的验证。
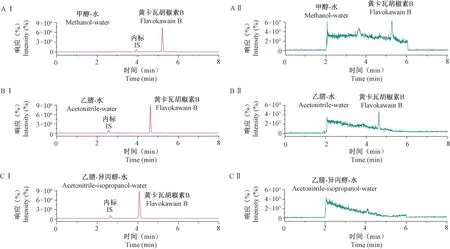
注:AⅠ,AⅡ:黄卡瓦胡椒素B(800 ng/mL)/内标(IS)在甲醇-水洗脱体系下残留的离子流图;BⅠ,BⅡ:黄卡瓦胡椒素B(800 ng/mL)/内标(IS)在乙腈-水洗脱体系下残留的离子流图;CⅠ,CⅡ:黄卡瓦胡椒素B(800 ng/mL)/内标(IS)在乙腈-异丙醇-水洗脱体系下残留的离子流图。图2 不同洗脱体系下的残留色谱图Note. AⅠ,AⅡ. Extracted ion chromatogram of Flavokawain B (800 ng/mL) / internal standard(IS) in methanol-water elution system. BⅠ,BⅡ. Extracted ion chromatogram of Flavokawain B (800 ng/mL) / internal standard (IS) in acetonitrile-water elution system. CⅠ,CⅡ.Extracted ion chromatogram of Flavokawain B (800 ng/mL) / internal standard (IS) in acetonitrile isopropanol water elution system.Figure 2 Carry-over results under different elution systems
2.2.2 提取溶剂选择
将含FKB 的模拟生物样品(100 ng/mL)按“1.2.4”项下方法操作,考察FKB 和内标木犀草素在3 倍甲醇和3 倍乙腈提取条件下的提取率。 提取率结果表明3 倍乙腈(FKB 为97.08% ± 6.60%、IS为92.12% ± 4.24%)稍优于3 倍甲醇(FKB 为84.70% ± 1.89%、IS 为96.83% ± 4.50%),因此采用3 倍乙腈作为提取溶剂进行后续方法学验证。
2.3 方法学确证
2.3.1 方法的选择性
如图3 所示,待测成分峰形和分离效果较好,FKB 出峰时间约为4.06 min,内标出峰时间约为2.65 min,小鼠血浆和脑组织中的内源性物质、代谢产物等基本不干扰以上成分的检出。
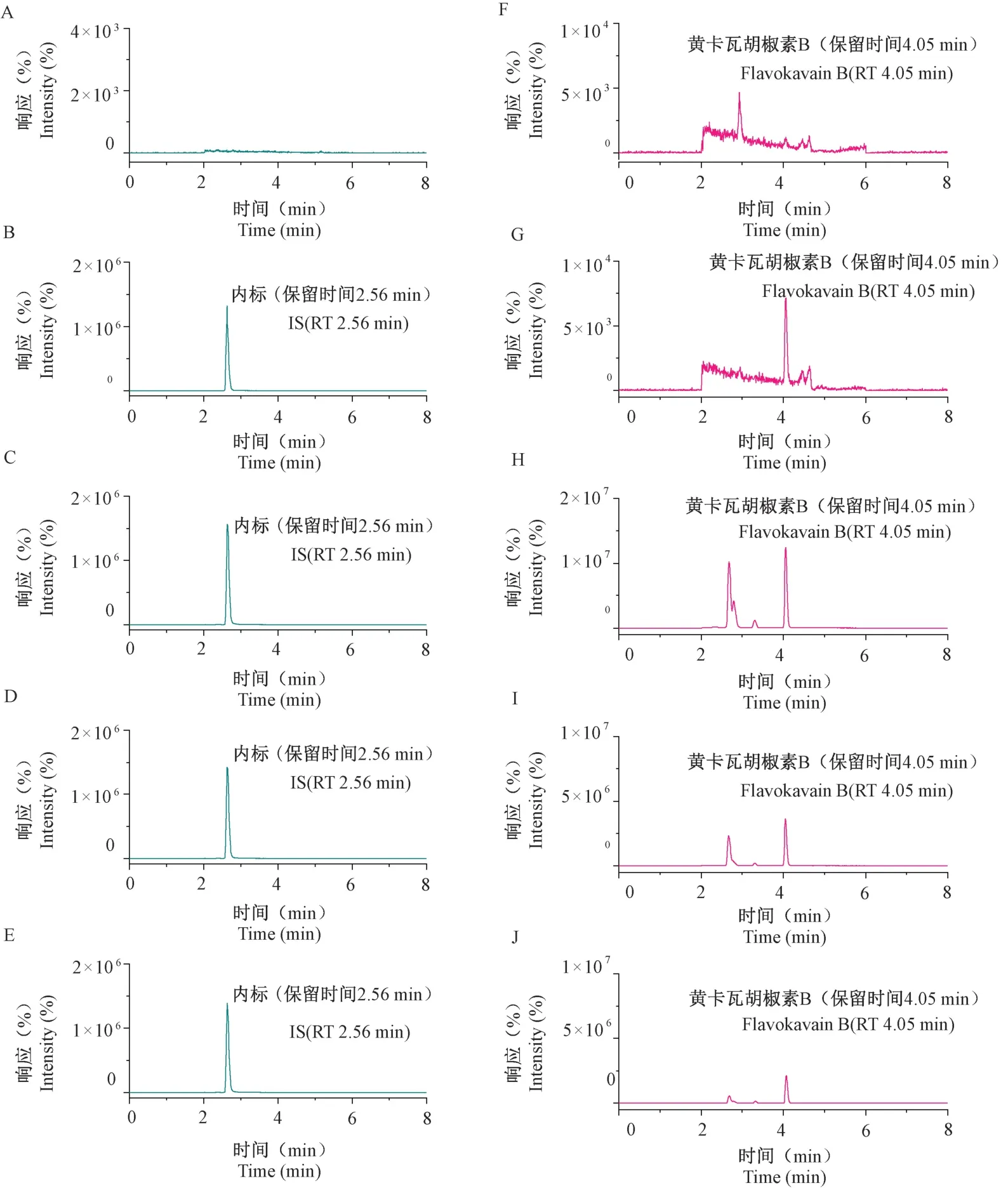
注:A,F:空白血浆样品提取离子流图;B,G:空白血浆样品加入内标(IS,木犀草素)和FKB(LOQ 浓度,0.2 ng/mL)的提取离子流图;C,H:小鼠尾静脉注射给药0.083 h 后的血浆样品提取离子流图;D,I:小鼠腹腔注射给药0.083 h 后的血浆样品提取离子流图;E,J:小鼠灌胃给药0.083 h 后的血浆样品提取离子流图。图3 血浆中黄卡瓦胡椒素B 和内标的MRM 色谱图Note. A,F. Extracted ion chromatogram of blank plasma sample. B,G. Blank plasma samples spiked with internal standard (IS,luteolin) and Flavokawain B (LOQ concentration,0.2 ng/mL). C,H. Extracted ion chromatogram of plasma sample obtained 0.083 h after intravenous injection in mice. D,I. Extracted ion chromatogram of plasma sample obtained 0.083 h after intraperitoneal injection in mice. E,J. Extracted ion chromatogram of plasma sample obtained 0.083 h after intragastric administration in mice.Figure 3 Multiple reactions monitoring chromatogram of Flavokawain B and internal standard in plasma
2.3.2 线性范围及定量限
血浆中FKB 典型的标准曲线回归方程为Y=0.010X+0.0033,相关系数r为0.9995,在0.2 ~800 ng/mL 范围内线性关系良好,经信噪比S/N =10 计算的LOQ 为0.2 ng/mL。
2.3.3 基质效应与提取回收率
LOQ 样品及各浓度QC 样品的基质效应为88.68% ~ 102.04%,提取回收率在95.42% ~101.55%,表明样品提取和分析方法良好。
2.3.4 准确度与精密度
结果显示,LOQ 相对误差在- 4.45% ~12.50%,各浓度QC 样品相对误差在-8.50% ~9.70%;日内和日间精密度LOQ 样品的RSD 在13.00%以内,各浓度QC 样品的RSD 在10.00%以内,表明分析方法准确、稳定可行。
2.3.5 残留与稀释效应
进样高浓度QC 样品后,空白样品的残留均低于内标响应的0.03%,低于LOQ 样品的11.03%;稀释后样品准确度为2. 43% ~8. 62%,精密度为2. 48%,表明分析方法的残留及稀释可靠性良好。
2.3.6 稳定性
测定低、中、高浓度QC 样品在不同处理条件的稳定性,实验结果表明FKB 在室温放置2 h(回收率:92.89% ~109.20%),经过3 次冻融(回收率:95.69% ~103.98%),-80℃条件下储存1 个月(回收率:90.86% ~103.46%),及处理后的样品在进样室内放置24 h(回收率:109.04% ~111.70%),稳定性基本良好。
2.4 药代动力学结果
小鼠在静脉(20 mg/kg)、腹腔注射(20、40 和60 mg/kg)和灌胃(200、400 和600 mg/kg)给药后未发现明显不良反应,FKB 的平均药时浓度曲线见图4,计算的主要药代动力学参数见表2。 FKB 在小鼠体内吸收速度很快,各给药组在第1 个采血时间点0.083 h 即为峰值;体内滞留时间MRT0-t较短,为2.78 ~4.51 h;表观分布容积较大,均高于243.63L/kg。 与尾静脉注射和腹腔注射给药(半衰期:4.89 ~9.70 h;清除率:22.25 ~44.23 L/(h·kg)相比,FKB 灌胃给药体内半衰期(1.71 ~2.78 h)明显减小;清除率(1263.38 ~2001.95 L/(h·kg))明显加快。 与静脉给药相比,腔腔注射FKB 的绝对生物利用度为46.31% ~62.06%,灌胃FKB 的绝对生物利用度仅为1.14% ~1.81%。 腹腔注射和灌胃给药FKB 多剂量线性关系分析结果见图5,可知小鼠在腹腔注射20 ~60 mg/kg 及灌胃200 ~600 mg/kg 给药剂量范围内,药代动力学过程呈明显的线性关系(Pearson’sr>0.97)。
表2 小鼠尾静脉注射、腹腔注射和灌胃黄卡瓦胡椒素B 后血浆中药代动力学参数(±s,n =6)Table 2 Pharmacokinetic parameters of plasma Flavokawain B in mice after intravenous injection,intraperitoneal injection,and intragastric administration (±s,n =6)

表2 小鼠尾静脉注射、腹腔注射和灌胃黄卡瓦胡椒素B 后血浆中药代动力学参数(±s,n =6)Table 2 Pharmacokinetic parameters of plasma Flavokawain B in mice after intravenous injection,intraperitoneal injection,and intragastric administration (±s,n =6)
参数Parameter i.v.20(g/kg)i.p.20(mg/kg)i.p.40(mg/kg)i.p.60(mg/kg)i.g.200(mg/kg)i.g.400(mg/kg)i.g.600(mg/kg)AUC0-t(h·ng/mL)852.940529.320786.9601436.280154.490217.640292.130 AUC0-∞(h·ng/mL)898.820578.840898.5601437.080158.310341.190299.710 MRT0-t(h)4.5104.2203.2705.0903.7303.5802.780 MRT0-∞(h)6.0605.8306.3505.1003.99011.2503.090 t1/2z(h)7.6004.8908.3302.0401.8108.8402.180 Tmax(h)0.0830.0830.0830.0830.0830.0830.083 Vz/F (L/kg)244.060243.630534.920122.950329.0801495.880630.400 CLz/F L/(h·kg)22.25034.55044.52041.750126.340117.240200.200 C5 min or Cmax(ng/mL)503.860294.160532.460602.39062.29097.510211.440 F(%)-62.06046.13056.1301.8101.2801.140

注:A:小鼠尾静脉注射给药后黄卡瓦胡椒素B 的平均药时浓度曲线;B:小鼠腹腔注射给药后黄卡瓦胡椒素B 的平均药时浓度曲线;C:小鼠灌胃给药后黄卡瓦胡椒素B 的平均药时浓度曲线;D:小鼠腹腔注射给药后黄卡瓦胡椒素B 在0 ~4 h 的平均药时浓度曲线局部放大图;E:小鼠灌胃给药后黄卡瓦胡椒素B 在0 ~4 h 的平均药时浓度曲线局部放大图。图4 小鼠给药后黄卡瓦胡椒素B 的平均药时浓度曲线(x¯±s,n =6)Note. A. Mean concentration-time curve of Flavokawain B after intravenous injection in mice. B. Mean concentration-time curve of Flavokawain B after intraperitoneal injection in mice. C. Mean concentration-time curve of Flavokawain B after intragastric administration in mice. D. Partially enlarged plot of the mean concentration-time curve of Flavokawain B from 0 ~4 h after intraperitoneal injection in mice; E. Partially enlarged view of the mean concentration-time curve of Flavokawain B in mice after intragastric administration from 0 ~4 h.Figure 4 Mean concentration-time curve of Flavokawain B in mice after administration(x¯±s,n =6)

注:A:小鼠腹腔注射给药后血浆中黄卡瓦胡椒素B 的AUC0-t 与给药剂量间的线性关系;B:小鼠灌胃给药后血浆中黄卡瓦胡椒素B 的AUC0-t与给药剂量间的线性关系。图5 小鼠给药后血浆中黄卡瓦胡椒素B 的AUC0-t与给药剂量间的线性关系(x¯±s,n =6)Note. A. The linear relationship between AUC0-t and dosage of Flavokawain B in plasma after intraperitoneal injection in mice. B. The linear relationship between AUC0-t and dosage of Flavokawain B in plasma after intragastric administration in mice.Figure 5 Linear relationship between AUC0-t and the dosage of Flavokawain B in the plasma of mice after administration(x¯±s,n =6)
3 讨论
关于卡瓦胡椒相关制剂中FKB 的含量测定方法有多种,如HPLC-紫外光谱法、高效薄层色谱法、核磁共振波谱法和HPLC-MS 法等[16-19],但FKB 在生物样品中检测方法的报道相对较少。 Kanumuri等[17]报道了健康志愿者血浆中FKB 的超高效液相(UHPLC)-MS 方法,Yang 等[20]报道了大鼠血浆中FKB 的UHPLC-MS 方法,以上检测方法的血浆样品来源分别为人和大鼠,定量限分别为0.25 ng/mL 和0.53 ng/mL,在小鼠血浆中FKB 的检测方法尚未见报道。 为深入了解FKB 在小鼠体内的药代动力学特征,本研究利用HPLC-MS/MS 建立灵敏、准确度高的血药浓度分析方法,并进一步探讨该方法在小鼠尾静脉注射、腹腔注射和灌胃给药不同剂量后血药浓度分析的适用性,这将为后期FKB 在小鼠体内药理机制和安全性研究提供依据。 在前期实验中,发现FKB 容易在色谱柱残留,因此优化了不同色谱柱和不同洗脱条件的残留,提高了FKB 的检测准确度,同时还考察了样品的稀释效应,控制定量上限,达到进一步减少FKB 残留的目的。 并且,通过色谱柱等液相条件和质谱参数的优化,本方法检测FKB的LOQ 低至0.20 ng/mL,和上述方法相比有一定的提高。 本文建立的FKB 的HPLC-MS/MS 分析方法,经验证符合中国药典《生物样品分析方法指导原则》的要求[21],可同时满足小鼠尾静脉注射、腹腔注射和灌胃给药不同剂量FKB 后血浆中药物浓度的样品检测(0.34 ~1814.32 ng/mL),并完整绘制了各给药途径血浆中FKB 的药时曲线,成功用于FKB 的药代动力学特征及生物利用度研究。
文献报道FKB 小鼠灌胃剂量为500 mg/kg[22],在此基础上依据初步的急性毒性结果对剂量进行了探索,FKB 的最终剂量范围设计为腹腔注射20 ~60 mg/kg、灌胃200 ~600 mg/kg,尾静脉注射为20 mg/kg。 在整个实验过程中小鼠状态良好,未发现明显不良反应。
小鼠灌胃和腹腔注射后,FKB 吸收速度很快,血药浓度在给药后第一个采血时间点5 min 即为峰值,通过PubChem 网站查询FKB 的油水分配系数LogP 为3.8,说明FKB 的脂溶性高、渗透性高,这可能是其体内迅速吸收的重要原因。 FKB 表观分布容积(高于243.63 L/kg)远大于小鼠的体液体积(0.73 L/kg)[23],说明FKB 在小鼠体内的分布极为广泛。 FKB 灌胃给药的绝对生物利用度极差(1.38%),这与灌胃给药的体内消除半衰期较短及清除率较快有关。 文献报道查尔酮等黄酮类成分代谢稳定性差,口服后以原型形式吸收入血少,并且药物极易受胃酸、消化酶和肠道菌群的影响[24-25],亦能导致进入体循环的药量相对变少,这提示在后期FKB 的相关制剂开发过程中对生物利用度需要特别关注。 另外,在FKB 质谱检测的285.1/181.1 离子对通道上约2.69 min 处有一色谱峰(图3H ~3J),并随FKB 的浓度变化而呈规律性变化,推断可能是FKBⅡ相代谢物,如FKB 的葡萄糖醛酸苷等进一步电离而形成的。 关于FKB 体内主要代谢物及相关活性的研究,课题组未来将进一步探索。 FKB 腹腔注射给药的绝对生物利用度为53.29%,相比灌胃给药有很大提升,并且在20 ~60mg/kg 给药剂量范围内呈现线性的药代动力学过程,这为使用腹腔给药进行FKB 相关药理机制的探索提供了依据。
在研究中,发现受试药物FKB 溶解度低(0.012 g/L,25℃),几乎不溶于水,因而使用5% Tween80和4% DMSO 辅料助溶。 虽然Tween80 和DMSO 是科研常用的助溶剂,但我国近年临床研究发现,不少品种中药注射剂出现的严重不良反应均与使用了Tween80 相关[26-27]。 此外,高剂量的DMSO 静脉注射可能也会带来副作用[28]。 因此,本研究中静脉注射方式给药在助溶剂用量上存在一定的不足之处。 在未来研究中,将尝试通过化学修饰等手段增加FKB 溶解度或减少药物起效浓度等方式来减少助溶剂的用量,进而再次开展其药代动力学相关研究。 总之,本研究建立的HPLC/MS-MS 测定小鼠血浆中FKB 的方法简便、准确、灵敏度高,适用于FKB在小鼠血浆中药代动力学特征和生物利用度研究,研究结果为FKB 相关制剂的进一步研究开发提供了新方法和数据参考。

